2017-2018年高中化学必修二课件化学能与热能
文档属性
| 名称 | 2017-2018年高中化学必修二课件化学能与热能 |

|
|
| 格式 | zip | ||
| 文件大小 | 234.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-20 00:00:00 | ||
图片预览








文档简介
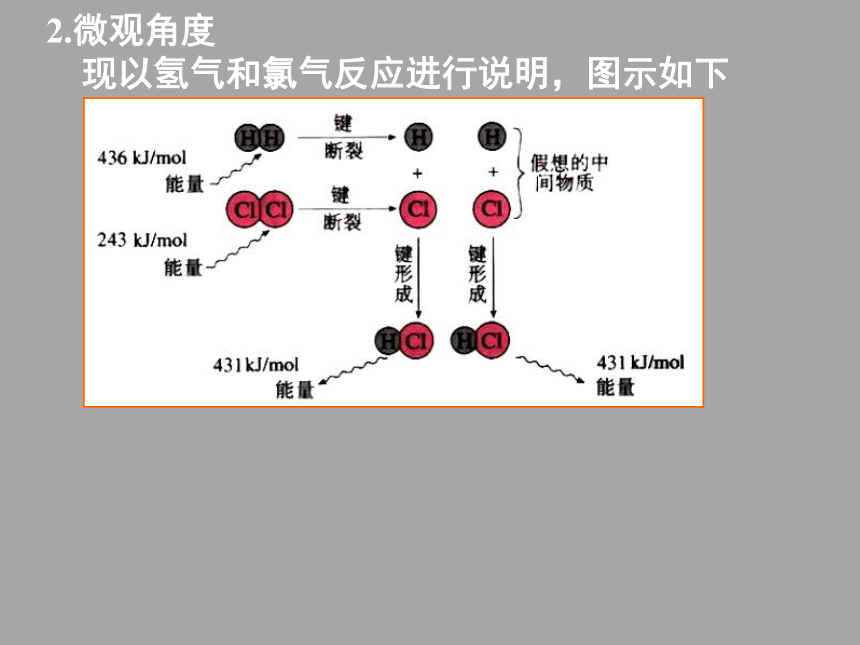
课件71张PPT。化学能与热能?E= E(生成物的总能量)— E(反应物的总能量)当?E<0,放热反应,反应体系能量降低;当?E>0,吸热反应,反应体系能量升高。分析点拨1.宏观角度2.微观角度
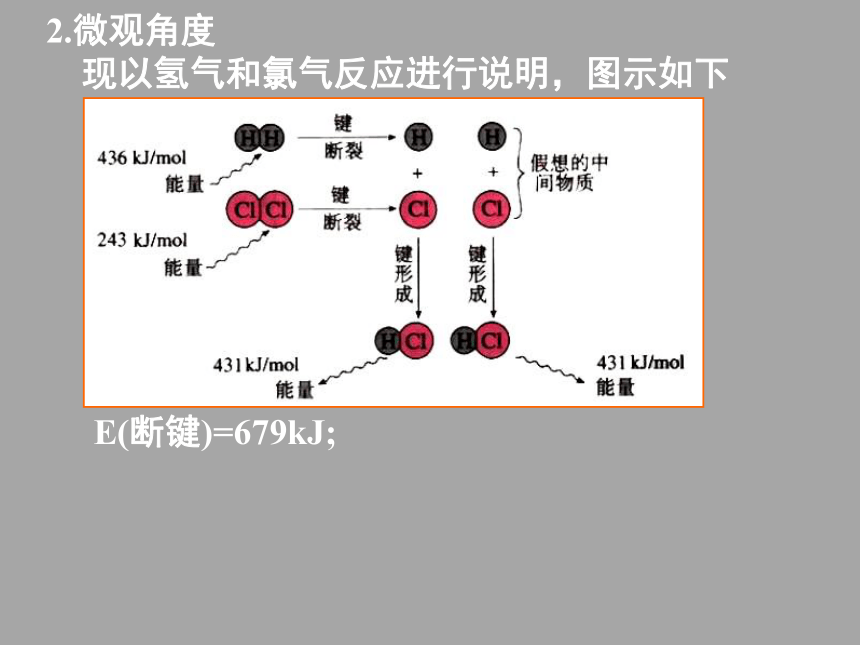
现以氢气和氯气反应进行说明,图示如下E(断键)=679kJ;2.微观角度
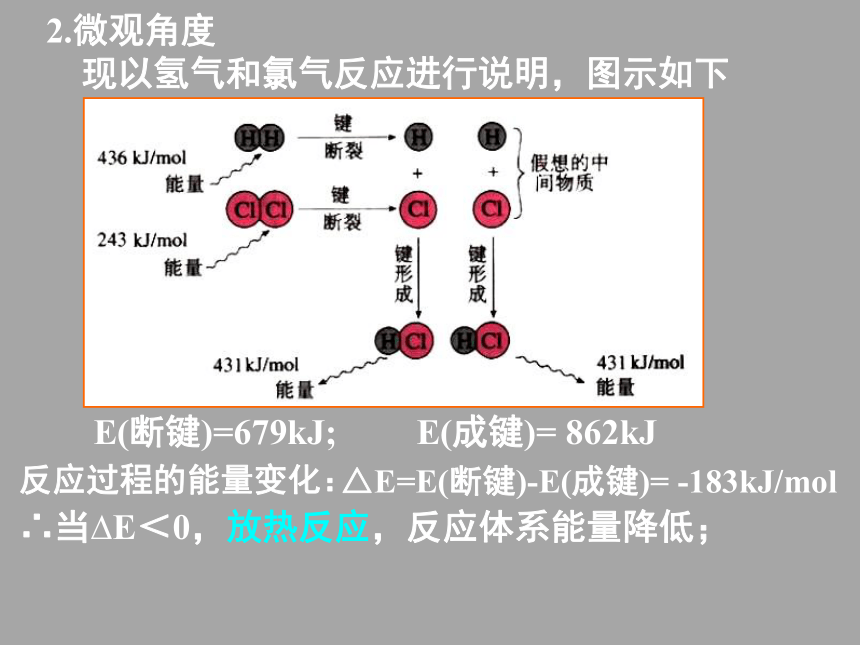
现以氢气和氯气反应进行说明,图示如下E(成键)= 862kJE(断键)=679kJ;2.微观角度
现以氢气和氯气反应进行说明,图示如下反应过程的能量变化:E(成键)= 862kJ△E=E(断键)-E(成键)= -183kJ/molE(断键)=679kJ;2.微观角度
现以氢气和氯气反应进行说明,图示如下反应过程的能量变化:E(成键)= 862kJ△E=E(断键)-E(成键)= -183kJ/molE(断键)=679kJ;2.微观角度
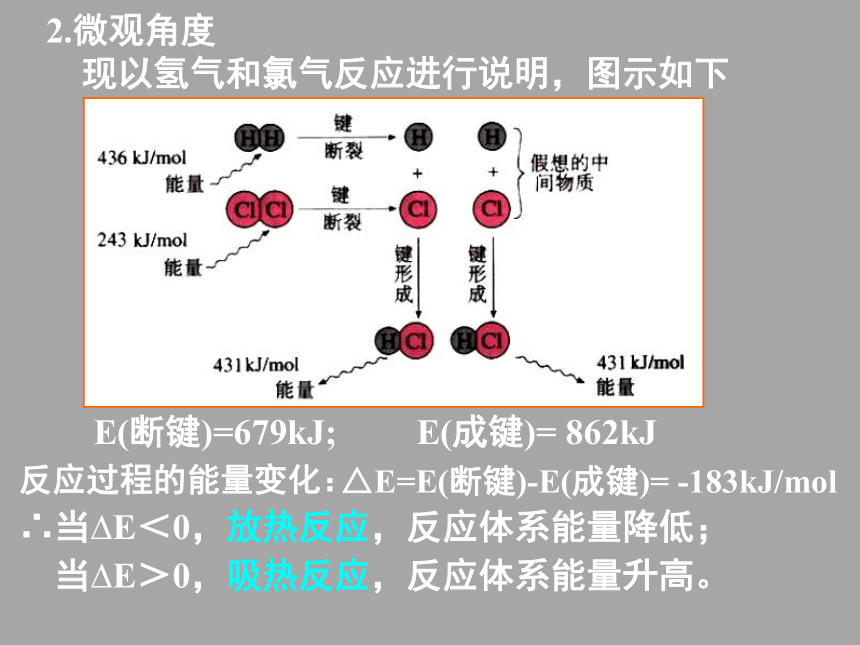
现以氢气和氯气反应进行说明,图示如下∴当?E<0,放热反应,反应体系能量降低;反应过程的能量变化:E(成键)= 862kJ△E=E(断键)-E(成键)= -183kJ/molE(断键)=679kJ;2.微观角度
现以氢气和氯气反应进行说明,图示如下∴当?E<0,放热反应,反应体系能量降低; 当?E>0,吸热反应,反应体系能量升高。在298K,101kPa条件下,将1mol理想气体分子AB断开为中性气态原子A、B时所需的能量,称为A-B键的键能。已知2H2+O2=2H2O,求2molH2和1molO2
生成2molH2O的能量变化。(已知H-H键能是
436kJ/mol,O=O键能是496kJ/mol,H-O键
能是463kJ/mol)在298K,101kPa条件下,将1mol理想气体分子AB断开为中性气态原子A、B时所需的能量,称为A-B键的键能。放出484kJ的能量在298K,101kPa条件下,将1mol理想气体分子AB断开为中性气态原子A、B时所需的能量,称为A-B键的键能。已知2H2+O2=2H2O,求2molH2和1molO2
生成2molH2O的能量变化。(已知H-H键能是
436kJ/mol,O=O键能是496kJ/mol,H-O键
能是463kJ/mol)放出484kJ的能量通常,键能越大,键越牢固,由该键构成的
分子也越稳定,该分子本身所具有的能量就越低。已知2H2+O2=2H2O,求2molH2和1molO2
生成2molH2O的能量变化。(已知H-H键能是
436kJ/mol,O=O键能是496kJ/mol,H-O键
能是463kJ/mol)在298K,101kPa条件下,将1mol理想气体分子AB断开为中性气态原子A、B时所需的能量,称为A-B键的键能。1.下列各图,表示反应吸收能量的是( )即时练习A 1.下列各图,表示反应吸收能量的是( )即时练习2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习×燃料燃烧2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习×为什么许多放热反应还需要加热才能发生?2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√×2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化正反应:拆开H2和I2的键,形成HI键; 逆反应:拆开HI键,形成H2和I2的键。2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化正反应:拆开H2和I2的键,形成HI键; 逆反应:拆开HI键,形成H2和I2的键。2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√√×二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.总质量二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.总能量总质量二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.实验探究【实验2-1】气泡实验探究【实验2-1】升高气泡实验探究【实验2-1】升高气泡放热实验探究【实验2-1】【实验2-2】【实验2-2】刺激性【实验2-2】刺激性变蓝【实验2-2】刺激性变蓝有NH3生成【实验2-2】刺激性变蓝有NH3生成变得很凉【实验2-2】刺激性变蓝有NH3生成变得很凉吸热【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在了烧杯底部【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在吸收了烧杯底部【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在吸收Ba(OH)2·8H2O+2NH4Cl=BaCl2 +2NH3 +10H2O了烧杯底部酸碱中和反应【实验2-3】酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论思考与交流酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。4. 实验操作时动作要快,以尽量减少热量的散失。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。4. 实验操作时动作要快,以尽量减少热量的散失。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。5.重复实验,取平均值。思考与交流酸碱中和反应【实验2-3】升高酸碱中和反应【实验2-3】升高放热酸碱中和反应【实验2-3】常见的放热反应和吸热反应归纳总结常见的放热反应和吸热反应1.放热反应归纳总结常见的放热反应和吸热反应1.放热反应
(1)一切燃烧反应
(2)活泼金属与酸或水的反应
(3)酸碱中和反应
(4)大多数化合反应(但也有些化合反应是吸热反应,如C+CO2==2CO)
(5)物质的缓慢氧化
(6)放热过程
浓H2SO4溶于水、生石灰溶于水、NaOH固体溶于水等归纳总结2.吸热反应高温2.吸热反应
(1)大多数的分解反应
如:NH4Cl == HCl↑+NH3↑
(2)少数晶体的反应,如Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
(3)以C、H2、CO为还原剂的氧化还原反应.
如:C+2CuO === 2Cu+CO2↑
(4)弱电解质的电离
(5)吸热过程
化学键的断裂,多数铵盐溶于水等。科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.能量科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.新物质能量2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。煤 石油天然气2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。煤 石油绿色天然气2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。太阳能煤 石油绿色天然气生物能氢能核能1.定义:补充:反应热1.定义:在化学反应过程中放出或吸收的热量补充:反应热1.定义:在化学反应过程中放出或吸收的热量补充:反应热符号:△H 单位:kJ/mol1.定义:在化学反应过程中放出或吸收的热量△H<0表示放热反应△H>0表示吸热反应补充:反应热符号:△H 单位:kJ/mol1.定义:在化学反应过程中放出或吸收的热量符号:△H 单位:kJ/mol△H<0表示放热反应△H>0表示吸热反应补充:反应热2.计算方法:生成物的总能量减去反应物的总能量1.定义:在化学反应过程中放出或吸收的热量△H<0表示放热反应△H>0表示吸热反应3.分类:①燃烧热,②中和热补充:反应热符号:△H 单位:kJ/mol2.计算方法:生成物的总能量减去反应物的总能量3.分类:①燃烧热,②中和热3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热②中和热在稀溶液中,酸跟碱发生中和反应 生成1mol水所释放的热量叫中和热。 室温下中和热约为57.3KJ/mol3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热②中和热在稀溶液中,酸跟碱发生中和反应 生成1mol水所释放的热量叫中和热。 室温下中和热约为57.3KJ/mol中和反应,燃烧反应均为放热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习×燃料燃烧2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习×为什么许多放热反应还需要加热才能发生?2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√×2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化正反应:拆开H2和I2的键,形成HI键; 逆反应:拆开HI键,形成H2和I2的键。2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√×例:H2+I2 2HI,分析该反应的能量变化正反应:拆开H2和I2的键,形成HI键; 逆反应:拆开HI键,形成H2和I2的键。2.判断以下说法是否正确:(1)需要加热才能进行的反应一定是吸热反应
(2)化学反应开始时都需要吸收能量
(3)E(拆键) < E(成键),则反应放热
(4)可逆反应若正向放热,则逆向一定吸热即时练习√√√×二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.总质量二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.总能量总质量二、化学能和热能的相互转化.
1.两条基本的自然定律:
(1)质量守恒定律
自然界的物质发生转化时, ________不变.
(2)能量守恒定律
一种能量可以转化为另一种能量,但是体系 包含的__________不变.实验探究【实验2-1】气泡实验探究【实验2-1】升高气泡实验探究【实验2-1】升高气泡放热实验探究【实验2-1】【实验2-2】【实验2-2】刺激性【实验2-2】刺激性变蓝【实验2-2】刺激性变蓝有NH3生成【实验2-2】刺激性变蓝有NH3生成变得很凉【实验2-2】刺激性变蓝有NH3生成变得很凉吸热【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在了烧杯底部【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在吸收了烧杯底部【实验2-2】刺激性变蓝有NH3生成变得很凉吸热粘在吸收Ba(OH)2·8H2O+2NH4Cl=BaCl2 +2NH3 +10H2O了烧杯底部酸碱中和反应【实验2-3】酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论思考与交流酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。4. 实验操作时动作要快,以尽量减少热量的散失。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。思考与交流2. 酸碱浓度要准确。3. 温度计要读准,水银球要全浸在溶液中,且要 稳定一段时间再读。4. 实验操作时动作要快,以尽量减少热量的散失。酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热,如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学交流讨论1. 保温隔热的效果一定要好。5.重复实验,取平均值。思考与交流酸碱中和反应【实验2-3】升高酸碱中和反应【实验2-3】升高放热酸碱中和反应【实验2-3】常见的放热反应和吸热反应归纳总结常见的放热反应和吸热反应1.放热反应归纳总结常见的放热反应和吸热反应1.放热反应
(1)一切燃烧反应
(2)活泼金属与酸或水的反应
(3)酸碱中和反应
(4)大多数化合反应(但也有些化合反应是吸热反应,如C+CO2==2CO)
(5)物质的缓慢氧化
(6)放热过程
浓H2SO4溶于水、生石灰溶于水、NaOH固体溶于水等归纳总结2.吸热反应高温2.吸热反应
(1)大多数的分解反应
如:NH4Cl == HCl↑+NH3↑
(2)少数晶体的反应,如Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
(3)以C、H2、CO为还原剂的氧化还原反应.
如:C+2CuO === 2Cu+CO2↑
(4)弱电解质的电离
(5)吸热过程
化学键的断裂,多数铵盐溶于水等。科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.能量科学视野1.社会发展与能源利用(1)化学能转化为热能为人类生存和发展 提供所需要的__________,进行生产、生活 和科研。
(2)热能转化为化学能又帮助人类进行化 工生产和研制___________.新物质能量2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。煤 石油天然气2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。煤 石油绿色天然气2.人类利用能源的三个阶段(1)柴草时期
该时期从火的发现至18世纪产业革命,以 树枝杂草为主要能源。
(2)化石能源时期
从18世纪中期到现代,以_____、_____、 _______为主要能源。
(3)多能源结构时期
以可再生能源和清洁能源(______能源)为 主要能源,主要包括_______、_______、______、_________等。太阳能煤 石油绿色天然气生物能氢能核能1.定义:补充:反应热1.定义:在化学反应过程中放出或吸收的热量补充:反应热1.定义:在化学反应过程中放出或吸收的热量补充:反应热符号:△H 单位:kJ/mol1.定义:在化学反应过程中放出或吸收的热量△H<0表示放热反应△H>0表示吸热反应补充:反应热符号:△H 单位:kJ/mol1.定义:在化学反应过程中放出或吸收的热量符号:△H 单位:kJ/mol△H<0表示放热反应△H>0表示吸热反应补充:反应热2.计算方法:生成物的总能量减去反应物的总能量1.定义:在化学反应过程中放出或吸收的热量△H<0表示放热反应△H>0表示吸热反应3.分类:①燃烧热,②中和热补充:反应热符号:△H 单位:kJ/mol2.计算方法:生成物的总能量减去反应物的总能量3.分类:①燃烧热,②中和热3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热②中和热在稀溶液中,酸跟碱发生中和反应 生成1mol水所释放的热量叫中和热。 室温下中和热约为57.3KJ/mol3.分类:①燃烧热,②中和热①燃烧热在101KPa时,1mol纯物质完全燃烧 生成稳定的化合物时所放出的热量 叫做该物质的燃烧热②中和热在稀溶液中,酸跟碱发生中和反应 生成1mol水所释放的热量叫中和热。 室温下中和热约为57.3KJ/mol中和反应,燃烧反应均为放热反应
