2017-2018年高中化学必修二课件晶体的类型与性质
文档属性
| 名称 | 2017-2018年高中化学必修二课件晶体的类型与性质 |  | |
| 格式 | zip | ||
| 文件大小 | 456.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-20 11:12:25 | ||
图片预览







文档简介
课件95张PPT。晶体的类型和性质1.在以下过程中,未发生化学键破坏的是
_____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤④⑥课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
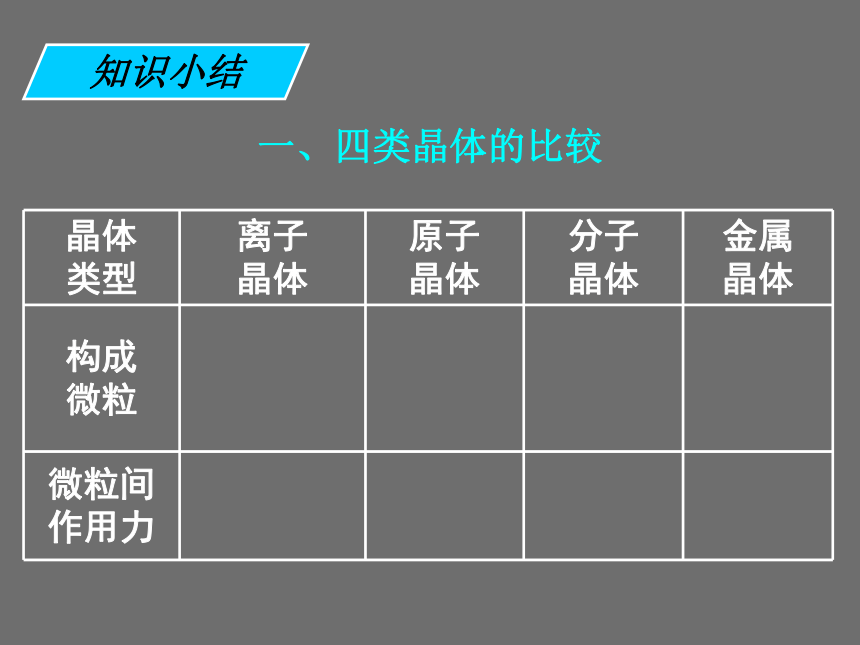
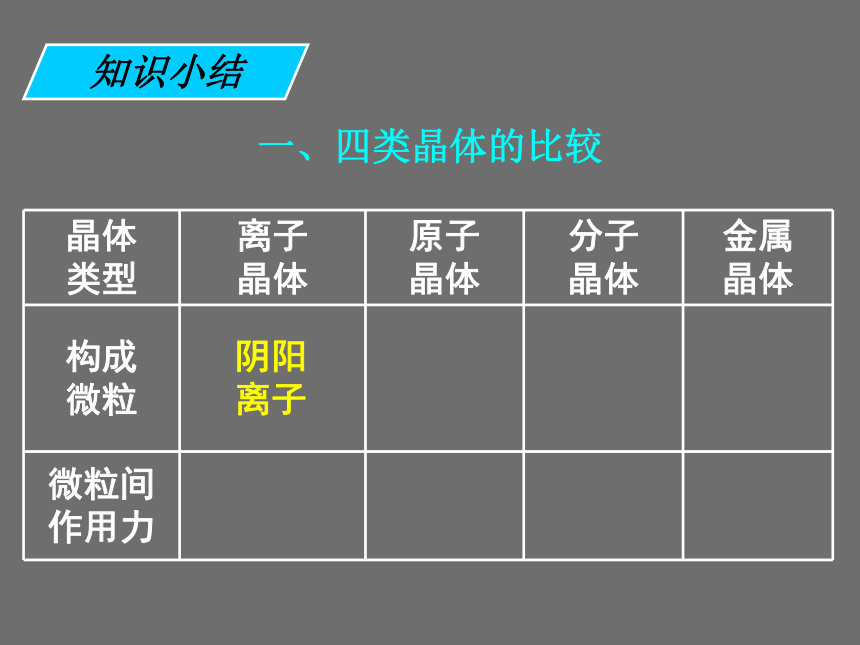
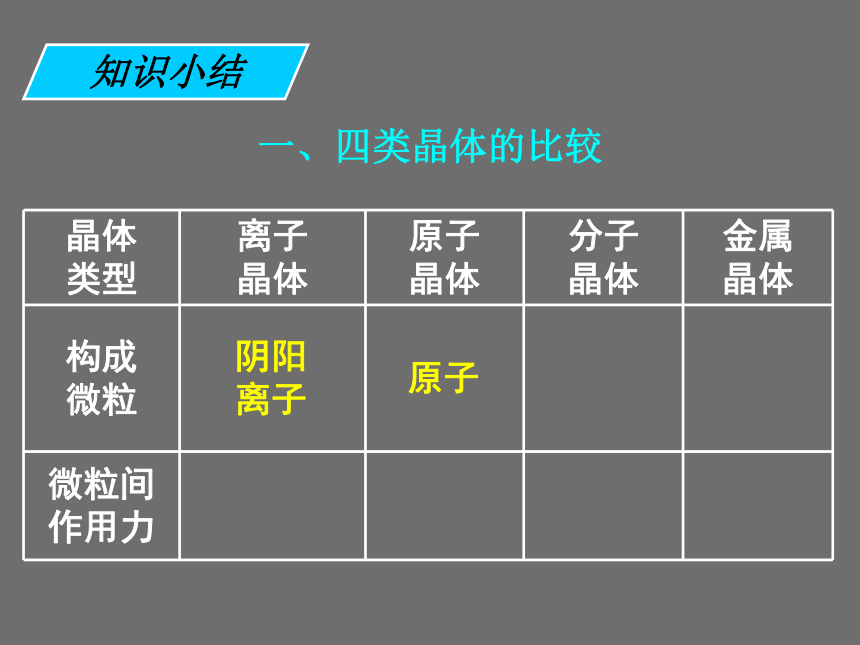
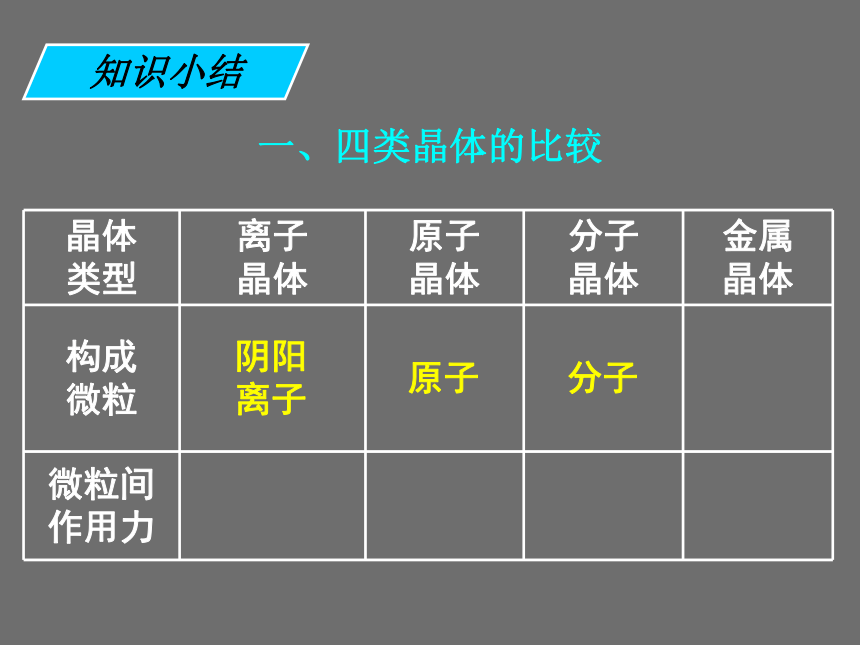
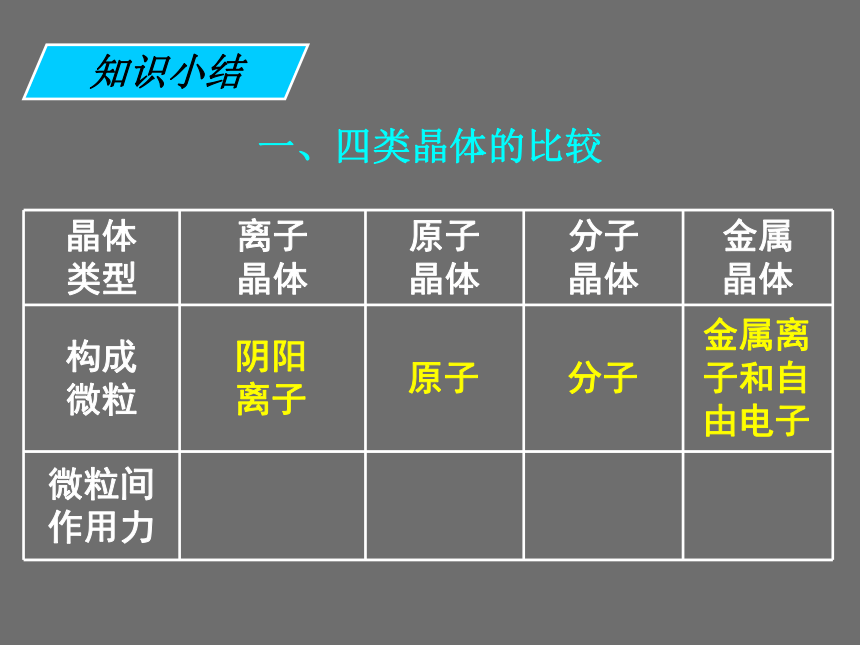
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤④⑥②⑧课前练习一、四类晶体的比较知识小结一、四类晶体的比较阴阳 离子知识小结一、四类晶体的比较阴阳 离子原子知识小结一、四类晶体的比较阴阳 离子原子分子知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键分子间
作用力知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键分子间
作用力金属键知识小结只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差熔化 不导电只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差熔化 不导电导电只有化学式,晶体中只有离子,不存在分子断开 离子键断开 离子键断键断开 离子键断键不断键断开 离子键断键不断键减弱断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC气体、多 数非金属 单质、 酸、多数 有机物断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC气体、多 数非金属 单质、 酸、多数 有机物金属2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧⑤2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧⑤⑦二、熔、沸点、硬度的比较规律1.不同类型:二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体2.同种类型:金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体2.同种类型:粒子间的作用越强,熔、沸点越高,硬度越大。金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律3.原子晶体:3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:由 F=K·Q1·Q2/r2确定3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:由 F=K·Q1·Q2/r2确定 离子电荷数越高,离子半径越小,离子 键越强,熔沸点越高,硬度越大。 (同种晶 型)5.金属晶体:5.金属晶体:由 F=K·Q1·Q2/r2确定5.金属晶体:金属阳离子电荷数越高,离子半径越小, 金属键越强,熔、沸点越高,硬度越大。由 F=K·Q1·Q2/r2确定 6.分子晶体: 6.分子晶体:(1)依据实验事实:固体>液态>气体 6.分子晶体:(1)依据实验事实:固体>液态>气体(2)组成与结构相似的物质(分子晶体,又 无氢键),随着相对分子质量的增大,范德华力增大,其熔沸点升高,硬度增大。 6.分子晶体:(1)依据实验事实:固体>液态>气体如:F2 CF4H2S,HF>HCl,NH3>PH3,
乙醇>乙醚等。 6.分子晶体:(3)一般有氢键的物质可能出现反常的
现象,如H2O>H2S,HF>HCl,NH3>PH3,
乙醇>乙醚等。 6.分子晶体:(4)同分异构体(式量相同):(3)一般有氢键的物质可能出现反常的
现象,如H2O>H2S,HF>HCl,NH3>PH3,
乙醇>乙醚等。 6.分子晶体:(4)同分异构体(式量相同):
①碳干异构:支链越多,熔沸点越低 如:正丁烷>异丁烷 (3)一般有氢键的物质可能出现反常的 现象,如H2O>H2S,HF>HCl,NH3>PH3, 乙醇>乙醚等。 6.分子晶体:(4)同分异构体(式量相同):
①碳干异构:支链越多,熔沸点越低 如:正丁烷>异丁烷 ②官能团异构:极性越强,分子间作 用力越大。如:乙醛>丙烷。 1.C3N4晶体很可能具有比金刚石更大的硬 度,原子间均以单键结合,下列关于C3N4晶体 的说法正确的是( )
A.是分子晶体
B.粒子间通过离子键结合
C.C—N键的键长大于金刚石中 C—C键的键长
D.每个C原子与4个N原子连接,
每个N原子与3个C原子连接巩固练习1.C3N4晶体很可能具有比金刚石更大的硬 度,原子间均以单键结合,下列关于C3N4晶体 的说法正确的是( )
A.是分子晶体
B.粒子间通过离子键结合
C.C—N键的键长大于金刚石中 C—C键的键长
D.每个C原子与4个N原子连接,
每个N原子与3个C原子连接D巩固练习2.下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服 分子间作用力
C.金属晶体通常具有导电、导热和 良好的延展性
D.离子晶体在熔化状态下能导电2.下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服 分子间作用力
C.金属晶体通常具有导电、导热和 良好的延展性
D.离子晶体在熔化状态下能导电A3.下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、 D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子 形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl 的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比 为1:1、电子总数为38的化合物,含有共价键 的离子型化合物3.下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、 D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子 形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl 的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比 为1:1、电子总数为38的化合物,含有共价键 的离子型化合物 D4.下列叙述正确的是( )
A.同主族金属的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱分子晶体的熔点越低
D.同周期元素原子半径越小越易失去电子4.下列叙述正确的是( )
A.同主族金属的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱分子晶体的熔点越低
D.同周期元素原子半径越小越易失去电子BC 5.下列说法中①元素的原子都由质子、中子、电子构成,②具有相同核外电子数的微粒 为同一种元素,③最外层电子数是2的原子, 一定属于ⅡA族元素的原子,④固态离子化合 物为离子晶体,⑤含有共价键的物质,固态时 可能是分子晶体,也可能是原子晶体或离子晶 体,⑥原子晶体的熔沸点比其他类型晶体的熔 沸点都高。正确的说法是( )
A.只有①②③ B.只有④⑤⑥
C.只有④⑤ D.只有⑥C 5.下列说法中①元素的原子都由质子、中子、电子构成,②具有相同核外电子数的微粒 为同一种元素,③最外层电子数是2的原子, 一定属于ⅡA族元素的原子,④固态离子化合 物为离子晶体,⑤含有共价键的物质,固态时 可能是分子晶体,也可能是原子晶体或离子晶 体,⑥原子晶体的熔沸点比其他类型晶体的熔 沸点都高。正确的说法是( )
A.只有①②③ B.只有④⑤⑥
C.只有④⑤ D.只有⑥几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6Na+三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6Na+12三、晶体空间结构 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 8 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 88 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 886 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。4 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。42 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。426 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。42612二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。4n(3)干冰(3)干冰原子间为共价键,分子间为分子间作用力
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤④⑥课前练习1.在以下过程中,未发生化学键破坏的是 _____,
仅发生离子键破坏的是_____,
仅发生共价键破坏的是_____,
既发生离子键破坏又发生共价键破坏的是 ______。 ①碘升华 ②氯化铵受热分解 ③烧碱熔化 ④石英熔化 ⑤氯化钠溶于水 ⑥氯化氢溶于水 ⑦溴溶于四氯化碳 ⑧氧化钠溶于水①⑦③⑤④⑥②⑧课前练习一、四类晶体的比较知识小结一、四类晶体的比较阴阳 离子知识小结一、四类晶体的比较阴阳 离子原子知识小结一、四类晶体的比较阴阳 离子原子分子知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键分子间
作用力知识小结一、四类晶体的比较阴阳 离子原子分子金属离子和自由电子离子键共价键分子间
作用力金属键知识小结只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差熔化 不导电只有化学式,晶体中只有离子,不存在分子无分子、 是巨大网 状结构有分子无熔化时或水溶液导电无或差熔化 不导电导电只有化学式,晶体中只有离子,不存在分子断开 离子键断开 离子键断键断开 离子键断键不断键断开 离子键断键不断键减弱断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC气体、多 数非金属 单质、 酸、多数 有机物断开 离子键断键不断键减弱大多数盐、强碱、活 泼金属 氧化物金刚石、Si、SiO2、SiC气体、多 数非金属 单质、 酸、多数 有机物金属2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧⑤2.现有八种物质: ①干冰 ②金刚石 ③晶体硫 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氖。 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;
(2)固态时属于分子晶体的是________;
(3)属于分子晶体,且分子为直线型结构的是 ______;
(4)由原子构成的分子晶体是______;
(5)含有非极性键的离子化合物是_____;
(6)含有离子键、共价键、配位键的化合物是 ______。②④①③⑧①⑧⑤⑦二、熔、沸点、硬度的比较规律1.不同类型:二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体2.同种类型:金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律1.不同类型:通常:原子晶体>离子晶体>分子晶体2.同种类型:粒子间的作用越强,熔、沸点越高,硬度越大。金属晶体高低相差太大,要视具体情况而定。 (记住W:3410℃,Hg:常温下为液态)二、熔、沸点、硬度的比较规律3.原子晶体:3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:由 F=K·Q1·Q2/r2确定3.原子晶体:原子半径越小,共价键键长越短,键能 越大, 熔、沸点越高,硬度越大。
金刚石 >SiC > 晶体Si4.离子晶体:由 F=K·Q1·Q2/r2确定 离子电荷数越高,离子半径越小,离子 键越强,熔沸点越高,硬度越大。 (同种晶 型)5.金属晶体:5.金属晶体:由 F=K·Q1·Q2/r2确定5.金属晶体:金属阳离子电荷数越高,离子半径越小, 金属键越强,熔、沸点越高,硬度越大。由 F=K·Q1·Q2/r2确定 6.分子晶体: 6.分子晶体:(1)依据实验事实:固体>液态>气体 6.分子晶体:(1)依据实验事实:固体>液态>气体(2)组成与结构相似的物质(分子晶体,又 无氢键),随着相对分子质量的增大,范德华力增大,其熔沸点升高,硬度增大。 6.分子晶体:(1)依据实验事实:固体>液态>气体如:F2
①碳干异构:支链越多,熔沸点越低 如:正丁烷>异丁烷 (3)一般有氢键的物质可能出现反常的 现象,如H2O>H2S,HF>HCl,NH3>PH3, 乙醇>乙醚等。 6.分子晶体:(4)同分异构体(式量相同):
①碳干异构:支链越多,熔沸点越低 如:正丁烷>异丁烷 ②官能团异构:极性越强,分子间作 用力越大。如:乙醛>丙烷。 1.C3N4晶体很可能具有比金刚石更大的硬 度,原子间均以单键结合,下列关于C3N4晶体 的说法正确的是( )
A.是分子晶体
B.粒子间通过离子键结合
C.C—N键的键长大于金刚石中 C—C键的键长
D.每个C原子与4个N原子连接,
每个N原子与3个C原子连接巩固练习1.C3N4晶体很可能具有比金刚石更大的硬 度,原子间均以单键结合,下列关于C3N4晶体 的说法正确的是( )
A.是分子晶体
B.粒子间通过离子键结合
C.C—N键的键长大于金刚石中 C—C键的键长
D.每个C原子与4个N原子连接,
每个N原子与3个C原子连接D巩固练习2.下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服 分子间作用力
C.金属晶体通常具有导电、导热和 良好的延展性
D.离子晶体在熔化状态下能导电2.下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服 分子间作用力
C.金属晶体通常具有导电、导热和 良好的延展性
D.离子晶体在熔化状态下能导电A3.下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、 D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子 形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl 的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比 为1:1、电子总数为38的化合物,含有共价键 的离子型化合物3.下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、 D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子 形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl 的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比 为1:1、电子总数为38的化合物,含有共价键 的离子型化合物 D4.下列叙述正确的是( )
A.同主族金属的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱分子晶体的熔点越低
D.同周期元素原子半径越小越易失去电子4.下列叙述正确的是( )
A.同主族金属的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越高
C.分子间作用力越弱分子晶体的熔点越低
D.同周期元素原子半径越小越易失去电子BC 5.下列说法中①元素的原子都由质子、中子、电子构成,②具有相同核外电子数的微粒 为同一种元素,③最外层电子数是2的原子, 一定属于ⅡA族元素的原子,④固态离子化合 物为离子晶体,⑤含有共价键的物质,固态时 可能是分子晶体,也可能是原子晶体或离子晶 体,⑥原子晶体的熔沸点比其他类型晶体的熔 沸点都高。正确的说法是( )
A.只有①②③ B.只有④⑤⑥
C.只有④⑤ D.只有⑥C 5.下列说法中①元素的原子都由质子、中子、电子构成,②具有相同核外电子数的微粒 为同一种元素,③最外层电子数是2的原子, 一定属于ⅡA族元素的原子,④固态离子化合 物为离子晶体,⑤含有共价键的物质,固态时 可能是分子晶体,也可能是原子晶体或离子晶 体,⑥原子晶体的熔沸点比其他类型晶体的熔 沸点都高。正确的说法是( )
A.只有①②③ B.只有④⑤⑥
C.只有④⑤ D.只有⑥几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6Na+三、晶体空间结构几种典型晶体组成的参数:
氯化钠——每个Na+紧邻__个Cl-,每个Cl-紧 邻6个____,每个Na+与___个Na+等距离相邻。 6Na+12三、晶体空间结构 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 8 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 88 氯化铯——每个Cs+紧邻___个Cl-,
每个Cl-紧邻___个Cs+。每个Cs+与___个
Cs+等距离相邻。 886 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。4 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。42 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。426 金刚石——每个C
原子与____个C原子紧邻,平均每个正四面体 中含______个C原子,
由共价键构成最小环状 结构中有____个C原子。 每个C原子可以形成___ 个六元环。42612二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。二氧化硅——每个Si与4个O原子紧邻,每个 O与2个Si原子紧邻。每n mol SiO2晶体中,Si-O 键为______ mol。4n(3)干冰(3)干冰原子间为共价键,分子间为分子间作用力
