2017-2018年苏教版高中化学选修三:4.2.2《配合物的形成和应用》——配合物的结构和性质 课件 (共26张PPT)
文档属性
| 名称 | 2017-2018年苏教版高中化学选修三:4.2.2《配合物的形成和应用》——配合物的结构和性质 课件 (共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 492.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-24 15:23:29 | ||
图片预览








文档简介
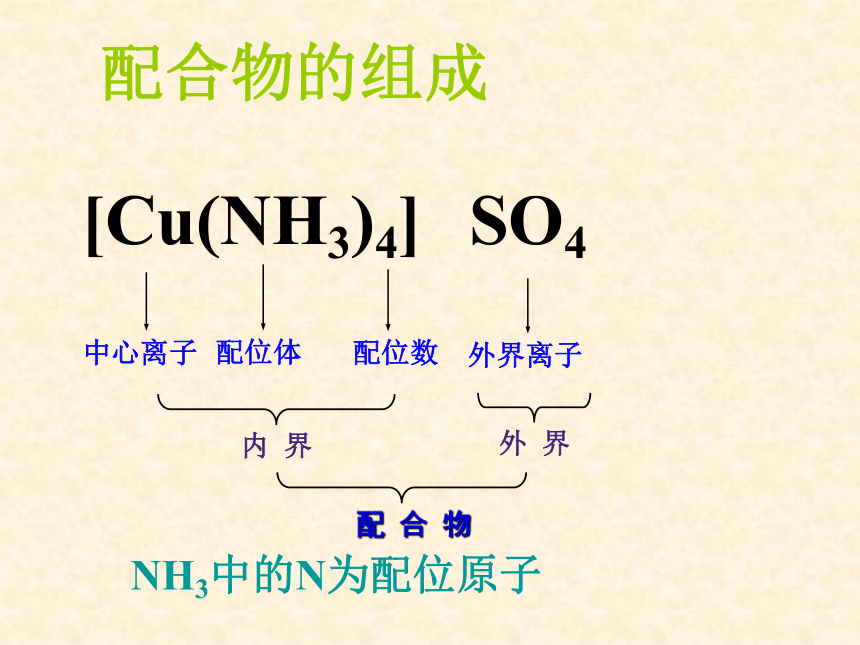
课件26张PPT。第二单元 配合物的形成和应用配合物的结构和性质专题4 分子空间结构与物质性质一、什么叫配合物 由提供孤电子对的配体与接受孤电子对的中心原子以配位键结合形成的化合物称为配合物。 请思考NH4Cl是否是配合物?配合物的组成[Cu(NH3)4] SO4NH3中的N为配位原子分析下列配合物的组成[Ag(NH3)2]OH
[Co(NH3)6]Cl3
K4[Fe(CN)6]
K[Pt(NH3)Cl3]
[Co(NH3)5Cl]( NO3)2
[Cr(H2O)5Cl]Cl2·H2O 配合物中心原子(离子)价态的判断[Ag(NH3)2]OH
[Co(NH3)6]Cl3
K4[Fe(CN)6]
K[Pt(NH3)Cl3]
[Co(NH3)5Cl]( NO3)2
[Cr(H2O)5Cl]Cl2·H2O 二、配合物的结构和性质 原子在形成分子时,为了增强成键能力,使分子的稳定性增加,趋向于将不同类型的原子轨道重新组合成能量、形状和方向与原来不同的新原子轨道。这种重新组合称为杂化;杂化后的原子轨道称为杂化轨道。 [Ag(NH3)2]+的成键情况 Ag+空的5s轨道和5p轨道形成sp杂化轨道,接受2个NH3分子提供的孤电子对,形成直线形的[Ag(NH3)2]+ 。[Zn(NH3)4]2+的成键情况和空间结构 Zn2+形成sp3杂化轨道,接受4个NH3分子提供的孤电子对形成4个配位键,得到正四面体型的[Zn(NH3)4]2+ 。[Cu(NH3)4]2+的成键情况和空间结构 Cu2+形成dsp2杂化轨道,接受4个NH3分子提供的孤电子对,形成平面正方形的[Cu(NH3)4]2+ 。[Pt(NH3)2Cl2]的成键情况和空间结构 Pt2+形成dsp2杂化轨道,接受2个NH3 和2个Cl-离子提供的孤电子对,形成平面正方形的[Pt(NH3)2Cl2] 。练习题1 向AgNO3溶液中滴加氨水至沉淀溶解可形成[Ag(NH3)2]+配离子。Ag+空的 轨道和 轨道可以形成 杂化轨道。NH3分子中N原子有 对孤电子对,N原子上的孤电子对进入Ag+空的 杂化轨道形成配位键。Ag+有 个空的 杂化轨道,可以接受2个NH3分子提供的孤电子对,形成 型的[Ag(NH3)2]+。 5s 5p sp 1sp2sp直线练习题2 [Zn(NH3)4]SO4中,Zn2+与NH3以 相结合,形成配合物的内界 ,
为配合物的外界。Zn2+接受4个NH3分子中氮原子提供的孤电子对,形成 个配位键,Zn2+提供4个空 杂化轨道接受孤电子对是 ,NH3分子中氮原子提供孤电子对,是配位原子,NH3分子是 ,[Zn(NH3)4]2+中,Zn2+的配位数是 。配位键 [Zn(NH3)4]2+SO42-4sp3中心原子(离子)配位体4 ①中结构对称,分子无极性;②的分子有极性,据相似相溶规则可知,前者溶解度小而后者大。 含有两种或两种以上配位体的配合物,若配合物在空间排列方式不同,就能形成不同几何构型的配合物。 什么叫同分异构体?请举2例。
什么叫手性异构体?什么叫手性碳原子?
什么叫顺反异构体?反式 顺式 思考题:
顺式Pt (NH3)2Cl2和反式Pt (NH3)2Cl2属于手性异构体吗?思考题:
向下列配合物的水溶液中加入AgNO3溶液,不能生成白色沉淀的是
A、[Co(NH3)4Cl2]Cl
B、[Co(NH3)3Cl3]
C、[Co(NH3)6]Cl3
D、[Co(NH3)5Cl]Cl2答案:B 思考题:
向银氨溶液中加入NaCl溶液,无白色沉淀产生,说明银氨溶液中 (填离子符号)离子浓度很小。若加入 KI溶液有黄色沉淀产生,说明 很小。若向银氨溶液中加入盐酸立即产生白色沉淀,写出此反应的离子方程式 。 Ag+AgI的溶解度[Ag(NH3)2]++2H++Cl-==AgCl↓+2NH4+ [Ag(NH3)2]++OH-+3H++Cl-==
AgCl↓+H2O+2NH4+ 思考题:
硝酸银溶液中分别滴加NaOH溶液,氯化铵溶液,都会立即产生沉淀。请分别写出反应的离子方程式。如果把它们三者以一定的浓度比混合,得到的却是澄清透明的溶液,请加以解释,并写出相关的反应方程式。 Ag++OH-=AgOH↓ 2AgOH=Ag2O↓+H2O Ag++Cl-=AgCl↓ AgNO3+2NH4Cl+2NaOH =
[Ag(NH3)2]Cl +NaNO3+NaCl+2H2O 三、同分异构体什么叫同分异构体?
配合物是否存在同分异构体?
配合物的同分异构体的性质是否有区别?思考题:
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O答案:B 思考题:
写出[Ag(NH3)2]OH的中心离子、配位原子、配位数并写出它电离的离子方程式。 中心离子:Ag+
配位原子:NH3分子中的N原子
配位数:2 [Ag(NH3)2]OH=[Ag(NH3)2]++OH-四、配合物的稳定性配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。(1)中心离子的影响
简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响
配位原子的电负性越大,配合物越稳定;配位原子电负性越小,配合物越不稳定。
(3)配位体碱性越强,配合物越稳定。 下列各配合物的稳定性,判断不正确的是
A、[Fe(CN)6]3->[Fe(SCN)6]3- B、[Co(NH3)6]2+>[Co(NH3)6]3+
C、[AlF6]3->[AlBr6]3-
D、[Cu(NH3)4]2+>[Zn(NH3)4]2+
(Cu2+的半径小于Zn2+的半径)答案:B思考题:
向CoCl2溶液中滴加氨水,使生成的Co(OH)2沉淀溶解生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6):
_________________,此配合物中Co的化合价为______。 [Co(NH3)5Cl]Cl2+3
[Co(NH3)6]Cl3
K4[Fe(CN)6]
K[Pt(NH3)Cl3]
[Co(NH3)5Cl]( NO3)2
[Cr(H2O)5Cl]Cl2·H2O 配合物中心原子(离子)价态的判断[Ag(NH3)2]OH
[Co(NH3)6]Cl3
K4[Fe(CN)6]
K[Pt(NH3)Cl3]
[Co(NH3)5Cl]( NO3)2
[Cr(H2O)5Cl]Cl2·H2O 二、配合物的结构和性质 原子在形成分子时,为了增强成键能力,使分子的稳定性增加,趋向于将不同类型的原子轨道重新组合成能量、形状和方向与原来不同的新原子轨道。这种重新组合称为杂化;杂化后的原子轨道称为杂化轨道。 [Ag(NH3)2]+的成键情况 Ag+空的5s轨道和5p轨道形成sp杂化轨道,接受2个NH3分子提供的孤电子对,形成直线形的[Ag(NH3)2]+ 。[Zn(NH3)4]2+的成键情况和空间结构 Zn2+形成sp3杂化轨道,接受4个NH3分子提供的孤电子对形成4个配位键,得到正四面体型的[Zn(NH3)4]2+ 。[Cu(NH3)4]2+的成键情况和空间结构 Cu2+形成dsp2杂化轨道,接受4个NH3分子提供的孤电子对,形成平面正方形的[Cu(NH3)4]2+ 。[Pt(NH3)2Cl2]的成键情况和空间结构 Pt2+形成dsp2杂化轨道,接受2个NH3 和2个Cl-离子提供的孤电子对,形成平面正方形的[Pt(NH3)2Cl2] 。练习题1 向AgNO3溶液中滴加氨水至沉淀溶解可形成[Ag(NH3)2]+配离子。Ag+空的 轨道和 轨道可以形成 杂化轨道。NH3分子中N原子有 对孤电子对,N原子上的孤电子对进入Ag+空的 杂化轨道形成配位键。Ag+有 个空的 杂化轨道,可以接受2个NH3分子提供的孤电子对,形成 型的[Ag(NH3)2]+。 5s 5p sp 1sp2sp直线练习题2 [Zn(NH3)4]SO4中,Zn2+与NH3以 相结合,形成配合物的内界 ,
为配合物的外界。Zn2+接受4个NH3分子中氮原子提供的孤电子对,形成 个配位键,Zn2+提供4个空 杂化轨道接受孤电子对是 ,NH3分子中氮原子提供孤电子对,是配位原子,NH3分子是 ,[Zn(NH3)4]2+中,Zn2+的配位数是 。配位键 [Zn(NH3)4]2+SO42-4sp3中心原子(离子)配位体4 ①中结构对称,分子无极性;②的分子有极性,据相似相溶规则可知,前者溶解度小而后者大。 含有两种或两种以上配位体的配合物,若配合物在空间排列方式不同,就能形成不同几何构型的配合物。 什么叫同分异构体?请举2例。
什么叫手性异构体?什么叫手性碳原子?
什么叫顺反异构体?反式 顺式 思考题:
顺式Pt (NH3)2Cl2和反式Pt (NH3)2Cl2属于手性异构体吗?思考题:
向下列配合物的水溶液中加入AgNO3溶液,不能生成白色沉淀的是
A、[Co(NH3)4Cl2]Cl
B、[Co(NH3)3Cl3]
C、[Co(NH3)6]Cl3
D、[Co(NH3)5Cl]Cl2答案:B 思考题:
向银氨溶液中加入NaCl溶液,无白色沉淀产生,说明银氨溶液中 (填离子符号)离子浓度很小。若加入 KI溶液有黄色沉淀产生,说明 很小。若向银氨溶液中加入盐酸立即产生白色沉淀,写出此反应的离子方程式 。 Ag+AgI的溶解度[Ag(NH3)2]++2H++Cl-==AgCl↓+2NH4+ [Ag(NH3)2]++OH-+3H++Cl-==
AgCl↓+H2O+2NH4+ 思考题:
硝酸银溶液中分别滴加NaOH溶液,氯化铵溶液,都会立即产生沉淀。请分别写出反应的离子方程式。如果把它们三者以一定的浓度比混合,得到的却是澄清透明的溶液,请加以解释,并写出相关的反应方程式。 Ag++OH-=AgOH↓ 2AgOH=Ag2O↓+H2O Ag++Cl-=AgCl↓ AgNO3+2NH4Cl+2NaOH =
[Ag(NH3)2]Cl +NaNO3+NaCl+2H2O 三、同分异构体什么叫同分异构体?
配合物是否存在同分异构体?
配合物的同分异构体的性质是否有区别?思考题:
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O答案:B 思考题:
写出[Ag(NH3)2]OH的中心离子、配位原子、配位数并写出它电离的离子方程式。 中心离子:Ag+
配位原子:NH3分子中的N原子
配位数:2 [Ag(NH3)2]OH=[Ag(NH3)2]++OH-四、配合物的稳定性配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。(1)中心离子的影响
简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响
配位原子的电负性越大,配合物越稳定;配位原子电负性越小,配合物越不稳定。
(3)配位体碱性越强,配合物越稳定。 下列各配合物的稳定性,判断不正确的是
A、[Fe(CN)6]3->[Fe(SCN)6]3- B、[Co(NH3)6]2+>[Co(NH3)6]3+
C、[AlF6]3->[AlBr6]3-
D、[Cu(NH3)4]2+>[Zn(NH3)4]2+
(Cu2+的半径小于Zn2+的半径)答案:B思考题:
向CoCl2溶液中滴加氨水,使生成的Co(OH)2沉淀溶解生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6):
_________________,此配合物中Co的化合价为______。 [Co(NH3)5Cl]Cl2+3
