2017-2018年苏教版高中化学选修三课件4.1.1分子空间构型 (共30张PPT)
文档属性
| 名称 | 2017-2018年苏教版高中化学选修三课件4.1.1分子空间构型 (共30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-24 15:38:30 | ||
图片预览





文档简介
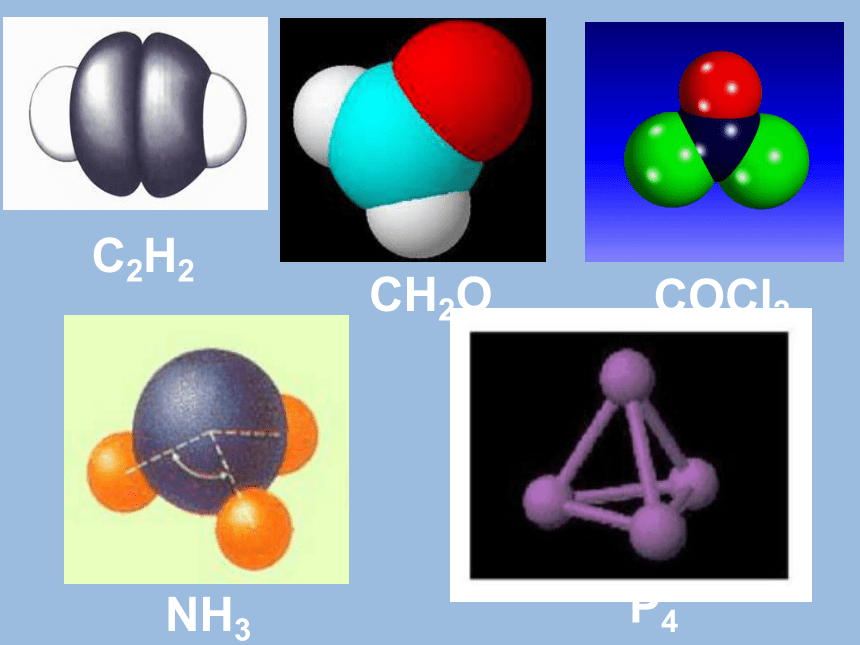
课件30张PPT。高三化学第一轮复习 分子立体结构专题C2H2CH2OCOCl2NH3P4 分子的立体结构: 用实验的方法
(红外光谱. X衍射核磁共振等)
有关化学理论
能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型
了解共价键的主要类型σ键和π键,能用键能、键长、键角等数据说明简单分子的某些性质。
了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用。
有的放矢鲍林 Linus Pouling 美国化学家。
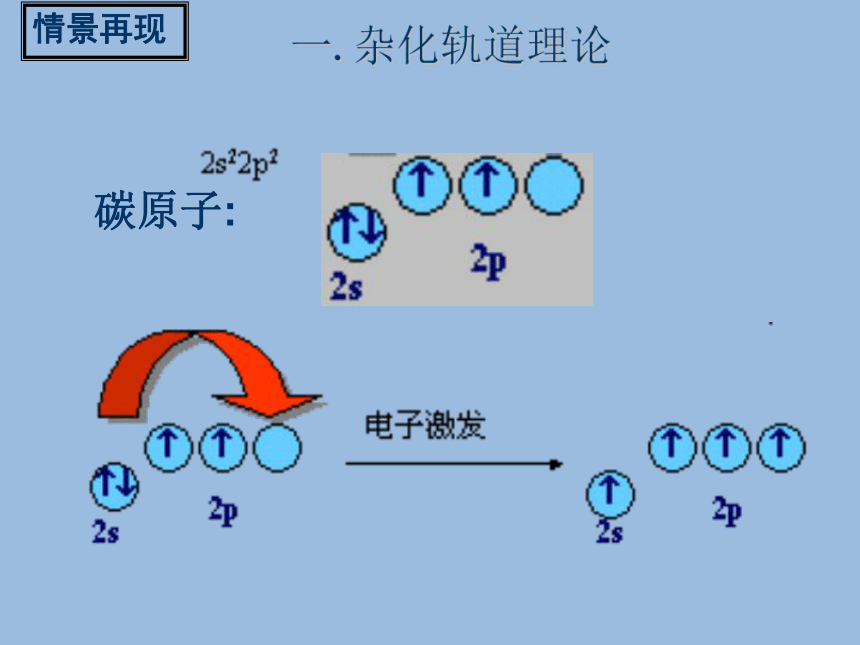
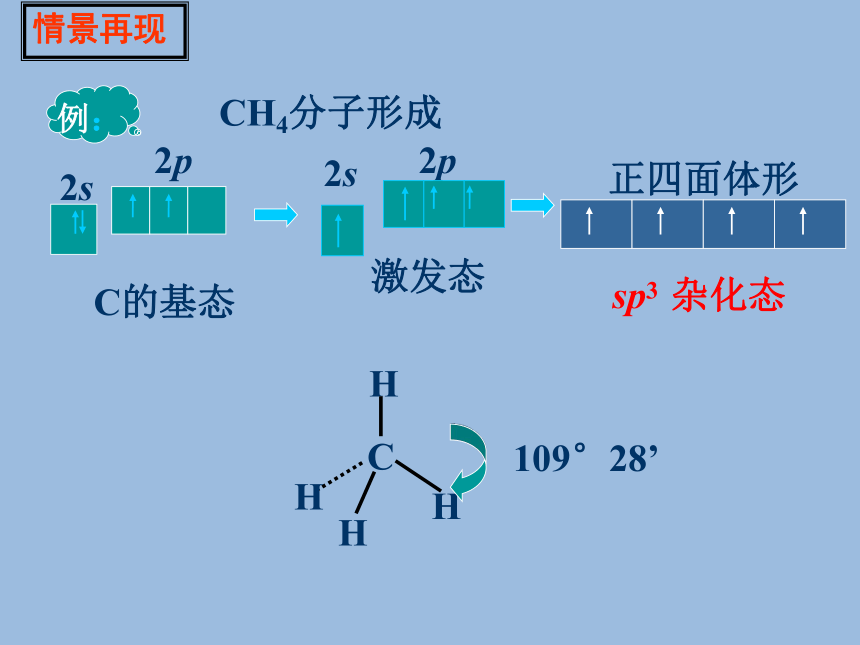
系统地研究了化学物质的组成.结构.性质三者的关系,于1931年提出了杂化轨道理论. 1954年获得诺贝尔化学奖.科学史话碳原子:情景再现一.杂化轨道理论C的基态例:CH4分子形成2s2p2s2p激发态情景再现一. 杂化轨道理论杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3
未杂化杂化轨道: 保持原来形状垂直与杂化轨道
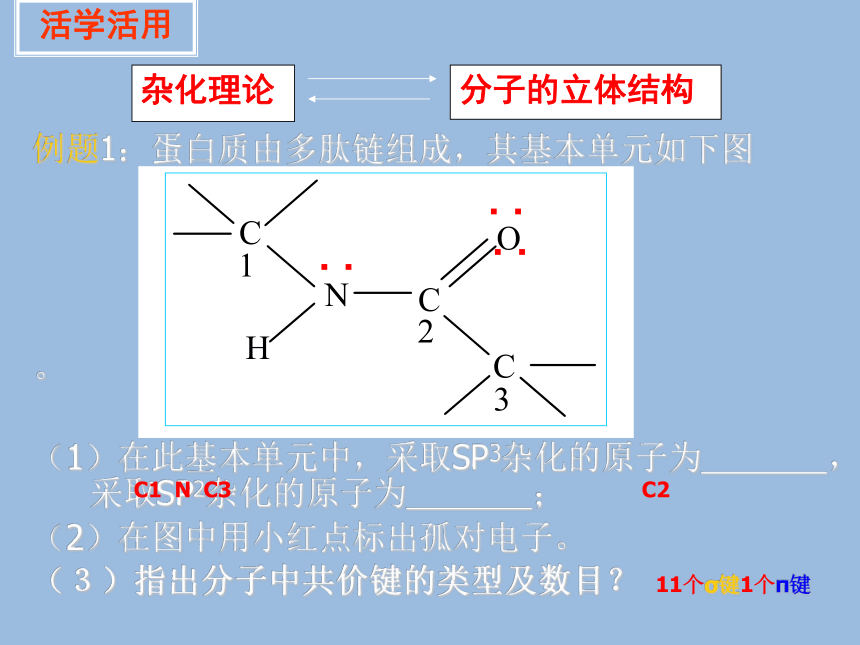
知识回顾例题1:蛋白质由多肽链组成,其基本单元如下图
。
(1)在此基本单元中,采取SP3杂化的原子为 ,采取SP2杂化的原子为 ;
(2)在图中用小红点标出孤对电子。
(3)指出分子中共价键的类型及数目?
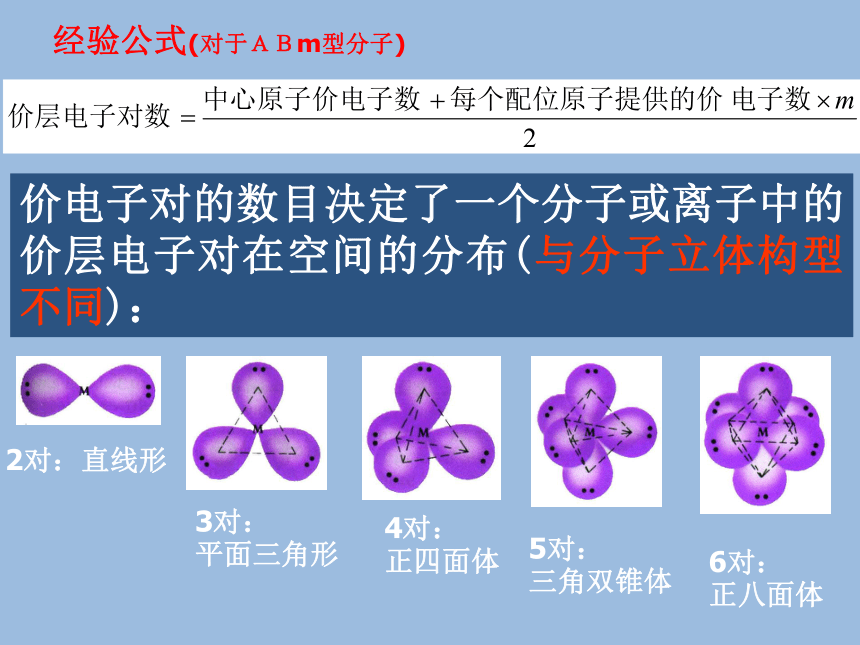
活学活用杂化理论分子的立体结构 ‥C1 N C3C211个σ键1个π键 ‥ ‥价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):经验公式(对于ABm型分子)2对:直线形3对:
平面三角形4对:
正四面体5对:
三角双锥体6对:
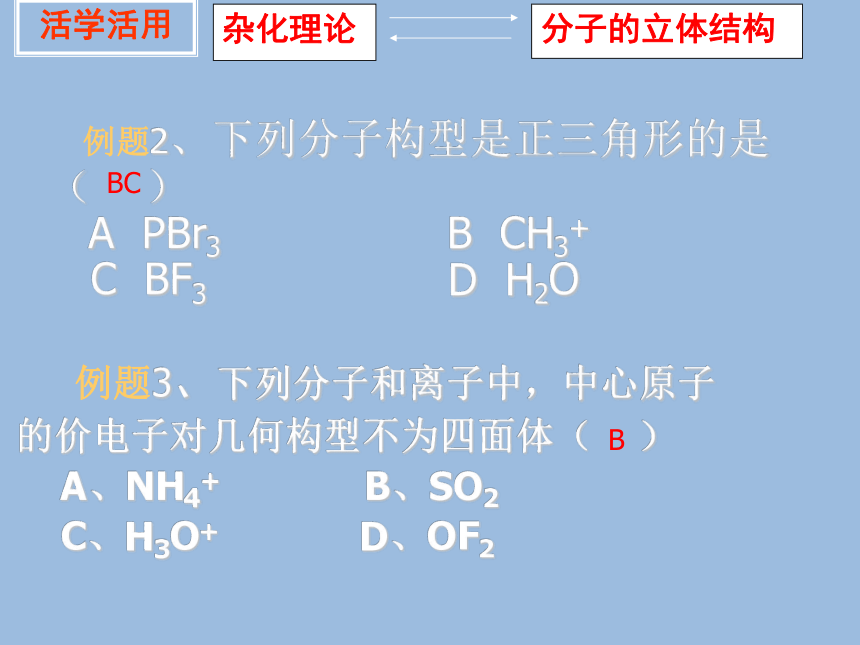
正八面体 例题2、下列分子构型是正三角形的是( ) A PBr3 B CH3+ C BF3 D H2O
例题3、下列分子和离子中,中心原子
的价电子对几何构型不为四面体( )
A、NH4+ B、SO2
C、H3O+ D、OF2
活学活用BCB杂化理论分子的立体结构
有人认为由SO3 SO3 2-仅仅相当于得到电子,杂化类型不会变,立体结构也不变,你认为呢?
讨论判断 如果是错误的,那你从这个变化得到什么启示?①分子的空间构型与成建原子的价电子有关,
②可以用价层电子对互斥模型来预测分子立体结构spBeCl2SO22+02+00直线直线sp23+12+1大π键三角形VSO3sp23+13+0 大π键三角形正三角形 SO32-sp34+0 3+10四面体 三角锥形二.VSEPR模型(价层电子对互斥模型)总论:
杂化轨道只用于:
未杂化的轨道决定:
杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数,形成σ键或者用来容纳孤电子对 共价单键是 键;而共价双键中有 个σ键,
共价三键中有 个σ键,其余为π键。σ.π键的存在
π键或大π键的存在σ11σ例题4:下列说法正确的是( ) A. 两个原子之间形成共价键最多只有一个σ键 B. 气体单质中,一定有σ键,可能有π键 C. HCN 中共有3个σ键1个π键 D. 含σ键或π键的一定是共价化合物A典型例题例题5:在乙烯分子中有5个σ键、一个π键,下列判断正确是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间形成的是S-Pσ键,C-C之间有P-Pσ键,
D.C-C之间形成的全是σ键,C-H之间是未参加杂化的2p轨道形成的π键AC典型例题例题6、ClO-、ClO2-、ClO3-、ClO 4-中Cl都是以 杂化轨道与O原子成键的,指出里面共价键的类型,并推测下列微粒的立体结构
典型例题问题 : N2O O3 CO它们的立体构型是如何确定呢?例题7:“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,由此可知它 (填“含有”或“不含”)非极性键。含有交流讨论电子总数或价电子总数相同原子总数相同分子或离子之间△、等电子体理论用来判断分子构型。互为等
电子体的物质结构相似 .其 (填“物理”
或“化学”,下同)性质相近,而 性质
差异较大。
三、等电子体原理物理化学例题8.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如右图:呈V型,键角116.5o。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:
找出它的等电子体
那么O3分子有 对孤对电子 5能力提升SO2 价层电子互斥模型杂化轨道理论分子的立体结构等电子体原理1.随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:考题预测(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
C≡O 1s2 2s2 2p6 3s 23p6 3d6 4s2 N2、CN- 分子晶体 CH4和CH3OH CH3OH形成分子间氢键感谢各位专家指导
谢谢同学们配合二、探究物质的性质 那么结构的特点会影响物质哪些的性质?
例题4:以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子不属极性分子的是 ( )
A、 H2O B、 SO2
C、 SO3 D、 NH3探究过程C结论四: 配位原子与中心原子所成价键轨道(σπ键)是否对称性分布,即正.负电荷重心是否重合是决定分子有无极性的前提 如SO2极性 SO3非极性探究过程{交流讨论}: 你能举出反映σ键π键强弱的反应吗 探究过程结论五 :随着有机加成反应的发生中心原子的杂化也发生了改变, π键 σ键分子活泼性降低.解决了由单纯 “电子配对法”无法解释的分子稳定性问题.
探究过程由此我们发现分子的空间构型 分子极性
分子中共价键类型 分子活泼性探究过程
(红外光谱. X衍射核磁共振等)
有关化学理论
能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型
了解共价键的主要类型σ键和π键,能用键能、键长、键角等数据说明简单分子的某些性质。
了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用。
有的放矢鲍林 Linus Pouling 美国化学家。
系统地研究了化学物质的组成.结构.性质三者的关系,于1931年提出了杂化轨道理论. 1954年获得诺贝尔化学奖.科学史话碳原子:情景再现一.杂化轨道理论C的基态例:CH4分子形成2s2p2s2p激发态情景再现一. 杂化轨道理论杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3
未杂化杂化轨道: 保持原来形状垂直与杂化轨道
知识回顾例题1:蛋白质由多肽链组成,其基本单元如下图
。
(1)在此基本单元中,采取SP3杂化的原子为 ,采取SP2杂化的原子为 ;
(2)在图中用小红点标出孤对电子。
(3)指出分子中共价键的类型及数目?
活学活用杂化理论分子的立体结构 ‥C1 N C3C211个σ键1个π键 ‥ ‥价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):经验公式(对于ABm型分子)2对:直线形3对:
平面三角形4对:
正四面体5对:
三角双锥体6对:
正八面体 例题2、下列分子构型是正三角形的是( ) A PBr3 B CH3+ C BF3 D H2O
例题3、下列分子和离子中,中心原子
的价电子对几何构型不为四面体( )
A、NH4+ B、SO2
C、H3O+ D、OF2
活学活用BCB杂化理论分子的立体结构
有人认为由SO3 SO3 2-仅仅相当于得到电子,杂化类型不会变,立体结构也不变,你认为呢?
讨论判断 如果是错误的,那你从这个变化得到什么启示?①分子的空间构型与成建原子的价电子有关,
②可以用价层电子对互斥模型来预测分子立体结构spBeCl2SO22+02+00直线直线sp23+12+1大π键三角形VSO3sp23+13+0 大π键三角形正三角形 SO32-sp34+0 3+10四面体 三角锥形二.VSEPR模型(价层电子对互斥模型)总论:
杂化轨道只用于:
未杂化的轨道决定:
杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数,形成σ键或者用来容纳孤电子对 共价单键是 键;而共价双键中有 个σ键,
共价三键中有 个σ键,其余为π键。σ.π键的存在
π键或大π键的存在σ11σ例题4:下列说法正确的是( ) A. 两个原子之间形成共价键最多只有一个σ键 B. 气体单质中,一定有σ键,可能有π键 C. HCN 中共有3个σ键1个π键 D. 含σ键或π键的一定是共价化合物A典型例题例题5:在乙烯分子中有5个σ键、一个π键,下列判断正确是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间形成的是S-Pσ键,C-C之间有P-Pσ键,
D.C-C之间形成的全是σ键,C-H之间是未参加杂化的2p轨道形成的π键AC典型例题例题6、ClO-、ClO2-、ClO3-、ClO 4-中Cl都是以 杂化轨道与O原子成键的,指出里面共价键的类型,并推测下列微粒的立体结构
典型例题问题 : N2O O3 CO它们的立体构型是如何确定呢?例题7:“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,由此可知它 (填“含有”或“不含”)非极性键。含有交流讨论电子总数或价电子总数相同原子总数相同分子或离子之间△、等电子体理论用来判断分子构型。互为等
电子体的物质结构相似 .其 (填“物理”
或“化学”,下同)性质相近,而 性质
差异较大。
三、等电子体原理物理化学例题8.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如右图:呈V型,键角116.5o。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等地享有这4个电子。请回答:
找出它的等电子体
那么O3分子有 对孤对电子 5能力提升SO2 价层电子互斥模型杂化轨道理论分子的立体结构等电子体原理1.随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:考题预测(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
C≡O 1s2 2s2 2p6 3s 23p6 3d6 4s2 N2、CN- 分子晶体 CH4和CH3OH CH3OH形成分子间氢键感谢各位专家指导
谢谢同学们配合二、探究物质的性质 那么结构的特点会影响物质哪些的性质?
例题4:以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子不属极性分子的是 ( )
A、 H2O B、 SO2
C、 SO3 D、 NH3探究过程C结论四: 配位原子与中心原子所成价键轨道(σπ键)是否对称性分布,即正.负电荷重心是否重合是决定分子有无极性的前提 如SO2极性 SO3非极性探究过程{交流讨论}: 你能举出反映σ键π键强弱的反应吗 探究过程结论五 :随着有机加成反应的发生中心原子的杂化也发生了改变, π键 σ键分子活泼性降低.解决了由单纯 “电子配对法”无法解释的分子稳定性问题.
探究过程由此我们发现分子的空间构型 分子极性
分子中共价键类型 分子活泼性探究过程
