2017-2018年苏教版高中化学选修三课件4.2.1配合物的形成 (共18张PPT)
文档属性
| 名称 | 2017-2018年苏教版高中化学选修三课件4.2.1配合物的形成 (共18张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 537.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-24 15:26:38 | ||
图片预览







文档简介
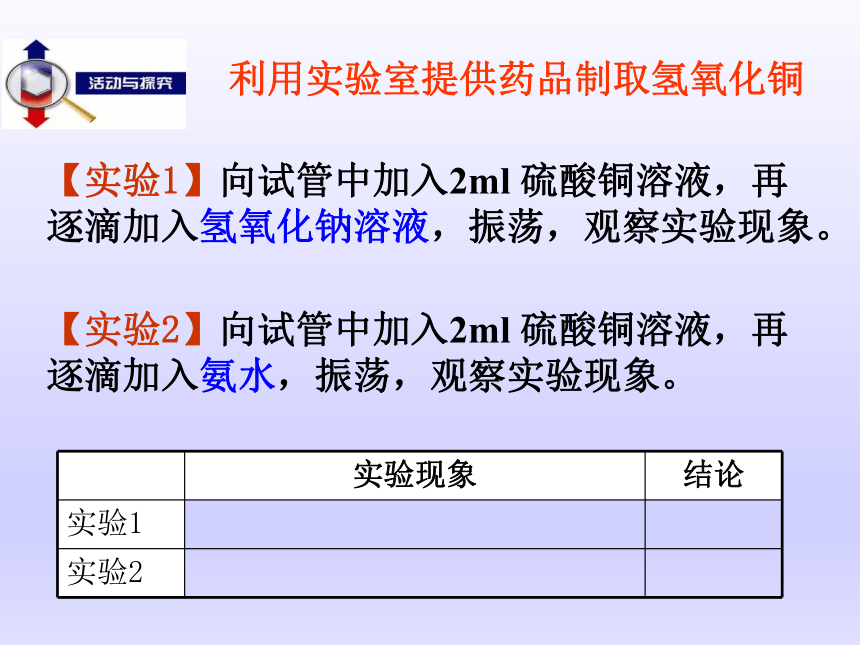
课件18张PPT。【实验1】向试管中加入2ml 硫酸铜溶液,再逐滴加入氢氧化钠溶液,振荡,观察实验现象。【实验2】向试管中加入2ml 硫酸铜溶液,再逐滴加入氨水,振荡,观察实验现象。利用实验室提供药品制取氢氧化铜研究表明:过量的氨水与CuSO4反应生成了一种组成较为复杂的物质,
其化学式为:[Cu(NH3)4]SO4
使溶液呈深蓝色的是 [Cu(NH3)4]2+
总反应:CuSO4+4NH3·H2O==[Cu(NH3)4]SO4+4H2O
配合物硫酸四氨合铜四氨合铜离子专题4 分子空间构型与物质性质
第二单元 配合物的形成和应用 第一课时 配合物的形成 比较 H+ + NH3 = NH4+
Cu2+ + 4NH3 = [Cu(NH3)4]2+
在水溶液中,Cu2+和NH3 是怎样结合成[Cu(NH3)4]2+的呢?提出Cu2+与NH3分子结合生成[Cu(NH3)4]2+的设想。 [Cu(NH3)4]2+是一种深蓝色的复杂离子。在[Cu(NH3)4]2+ 中,Cu2+位于[Cu(NH3)4]2+的中心,4个NH3分子位于Cu2+的四周。模仿NH4+的结构式,书写[Cu(NH3)4]2+的结构简式 问题?请根据[Cu(NH3)4]2+的形成,
总结配位键的形成条件。如:[Cu(NH3)4] SO4、 [Ag(NH3)2]OH 、Fe(SCN)3 、 Na3[AlF6] 等2.定义:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键结合形成的化合物称为配位化合物,简称配合物。一、配合物的概念提供孤电子对接受孤电子对1.配位键的形成条件学生活动:
阅读p77“信息提示”,
认识配合物的组成二、配合物的组成: [Cu(NH3)4] SO4中心
原子 配位体 配位原子 配位数 内界 外界 中心原子(离子):
能够接受孤电子对的离子或原子,
多数为过渡金属元素的离子或原子。
如:Cu2+,Ag+,Fe3+,Zn2+ ,Fe,Ni
配位体:
提供孤电子对的分子或离子;
如:NH3 , H2O, CO, X-, SCN-,OH-
配位原子:
配位体中提供孤电子对的原子,
如:N、 O、 C 、 X 、 S
练一练 按要求填表: [AlF6]3- [Ag(NH3)2]+ [Co(NH3)6]3+ [Co(NH3)5Cl]2+ Fe(CO)5 Na+ OH- Cl- Cl- 无 Al3+ Ag+ Co3+ Co3+ Fe F- NH3 NH3 NH3、
Cl- CO 6 2 6 6 5 对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难电离;内外界之间以离子键结合,在水溶液中较易电离。
写出 [Cu(NH3)4]SO4 、 [Ag(NH3)2] OH 、Fe(SCN)3 的电离方程式。 [Cu(NH3)4]SO4 = [Cu(NH3)4]2++SO42- [Ag(NH3)2] OH = [Ag(NH3)2]++OH-练一练 向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A、[Co(NH3)4Cl2]Cl B、[Co(NH3)3Cl3]
C、[Co(NH3)6]Cl3 D、[Co(NH3)5Cl]Cl2维尔纳与配合物
19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。为了解释上述情况,化学家曾提出各种假说,但都未能成功。直到1893年,瑞士化学家维尔纳(A.Werner)在总结前人研究的基础上,首次提出了配合物等概念,并成功解释了很多配合物的性质 ,维尔纳也被称为“配位化学之父”,并因此获得了1913年的诺贝尔化学奖。 现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开来。提示:先写出两者的电离方程式进行比较。实验方案:
1、称取相同质量的两种晶体,分别配成溶液。
2、向两种溶液中加入足量的AgNO3溶液。
3、静置,过滤。
4、洗涤沉淀,干燥
5、称量。
结论:所得固体质量多的即为[Co(NH3)6]Cl3,
所得固体质量少的即为[Co(NH3)5Cl]Cl2 。[Co(NH3)6]Cl3 = [Co(NH3)6]3++3Cl-
[Co(NH3)5Cl]Cl2 = [Co(NH3)5Cl]2++2Cl-
课堂总结学完本节课你应该掌握:
1、能说出什么是配合物,能进行辨认
2、能够举例说明配合物中的中心原子(或离子)和配位体是如何结合的
3、能够指出配合物中的各个组成部分
4、能书写有关配合物的化学用语
巩固练习1. 已知:冰晶石——Na3[AlF6] 是配合物,
明矾——KAl(SO4)2·12H2O是不是配合物?为什么?
其化学式为:[Cu(NH3)4]SO4
使溶液呈深蓝色的是 [Cu(NH3)4]2+
总反应:CuSO4+4NH3·H2O==[Cu(NH3)4]SO4+4H2O
配合物硫酸四氨合铜四氨合铜离子专题4 分子空间构型与物质性质
第二单元 配合物的形成和应用 第一课时 配合物的形成 比较 H+ + NH3 = NH4+
Cu2+ + 4NH3 = [Cu(NH3)4]2+
在水溶液中,Cu2+和NH3 是怎样结合成[Cu(NH3)4]2+的呢?提出Cu2+与NH3分子结合生成[Cu(NH3)4]2+的设想。 [Cu(NH3)4]2+是一种深蓝色的复杂离子。在[Cu(NH3)4]2+ 中,Cu2+位于[Cu(NH3)4]2+的中心,4个NH3分子位于Cu2+的四周。模仿NH4+的结构式,书写[Cu(NH3)4]2+的结构简式 问题?请根据[Cu(NH3)4]2+的形成,
总结配位键的形成条件。如:[Cu(NH3)4] SO4、 [Ag(NH3)2]OH 、Fe(SCN)3 、 Na3[AlF6] 等2.定义:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键结合形成的化合物称为配位化合物,简称配合物。一、配合物的概念提供孤电子对接受孤电子对1.配位键的形成条件学生活动:
阅读p77“信息提示”,
认识配合物的组成二、配合物的组成: [Cu(NH3)4] SO4中心
原子 配位体 配位原子 配位数 内界 外界 中心原子(离子):
能够接受孤电子对的离子或原子,
多数为过渡金属元素的离子或原子。
如:Cu2+,Ag+,Fe3+,Zn2+ ,Fe,Ni
配位体:
提供孤电子对的分子或离子;
如:NH3 , H2O, CO, X-, SCN-,OH-
配位原子:
配位体中提供孤电子对的原子,
如:N、 O、 C 、 X 、 S
练一练 按要求填表: [AlF6]3- [Ag(NH3)2]+ [Co(NH3)6]3+ [Co(NH3)5Cl]2+ Fe(CO)5 Na+ OH- Cl- Cl- 无 Al3+ Ag+ Co3+ Co3+ Fe F- NH3 NH3 NH3、
Cl- CO 6 2 6 6 5 对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难电离;内外界之间以离子键结合,在水溶液中较易电离。
写出 [Cu(NH3)4]SO4 、 [Ag(NH3)2] OH 、Fe(SCN)3 的电离方程式。 [Cu(NH3)4]SO4 = [Cu(NH3)4]2++SO42- [Ag(NH3)2] OH = [Ag(NH3)2]++OH-练一练 向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A、[Co(NH3)4Cl2]Cl B、[Co(NH3)3Cl3]
C、[Co(NH3)6]Cl3 D、[Co(NH3)5Cl]Cl2维尔纳与配合物
19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。为了解释上述情况,化学家曾提出各种假说,但都未能成功。直到1893年,瑞士化学家维尔纳(A.Werner)在总结前人研究的基础上,首次提出了配合物等概念,并成功解释了很多配合物的性质 ,维尔纳也被称为“配位化学之父”,并因此获得了1913年的诺贝尔化学奖。 现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开来。提示:先写出两者的电离方程式进行比较。实验方案:
1、称取相同质量的两种晶体,分别配成溶液。
2、向两种溶液中加入足量的AgNO3溶液。
3、静置,过滤。
4、洗涤沉淀,干燥
5、称量。
结论:所得固体质量多的即为[Co(NH3)6]Cl3,
所得固体质量少的即为[Co(NH3)5Cl]Cl2 。[Co(NH3)6]Cl3 = [Co(NH3)6]3++3Cl-
[Co(NH3)5Cl]Cl2 = [Co(NH3)5Cl]2++2Cl-
课堂总结学完本节课你应该掌握:
1、能说出什么是配合物,能进行辨认
2、能够举例说明配合物中的中心原子(或离子)和配位体是如何结合的
3、能够指出配合物中的各个组成部分
4、能书写有关配合物的化学用语
巩固练习1. 已知:冰晶石——Na3[AlF6] 是配合物,
明矾——KAl(SO4)2·12H2O是不是配合物?为什么?
