人教版高中化学必修一2.2离子反应课件2(第2课时)(共35张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.2离子反应课件2(第2课时)(共35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 132.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 11:48:06 | ||
图片预览











文档简介
课件35张PPT。§2.2 离子反应
第2课时
离子反应及其发生的条件
1、离子反应
(1)定义:有离子参加的反应叫做离子反应。
【说明】电解质溶于水后电离成为离子,所以电解质在水溶液中的反应属于离子反应。
[实验2-1] 请同学们按要求做实验,并填写下表:无现象
白色沉淀
思考:为什么BaCl2溶液能与Na2SO4溶液发生反应,而KCl溶液却不能呢?
(2)实质:离子反应的实质是某些离子之间结合生成新物质,使离子浓度发生变化。2、离子方程式:(1)定义:
用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式。
(2)离子方程式的书写步骤:
以硫酸钠与氯化钡反应为例:
①写:写出正确的化学方程式。
Na2SO4+BaCl2=BaSO4↓+2NaCl
②拆:将易溶且易电离的物质拆成离子形式,而难溶、难电离及气体等仍用化学式表示。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删:删去方程式两边不参加反应的离子。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
即:Ba2++SO42-=BaSO4↓
④查:检查方程式两边各元素原子的个数和电荷总数是否守恒。
*离子方程式的书写步骤:写、拆、删、查[明辨是非]拆还是不拆? ①必须拆成离子形式的物质: 在反应中以离子形式存在的“易溶于水且易电离的物质”。
a、强 酸:HCl、H2SO4、HNO3等;
b、强 碱:KOH、NaOH、Ba(OH)2;
c、可溶盐:NaCl、Na2SO4、KNO3等。 ②不能拆成离子,仍用化学式表示的物质: 在反应时不是以离子形式存在的物质。
a、难溶物质:Cu(OH)2、BaSO4、AgCl 等。
b、难电离物质:CH3COOH、NH3·H2O、水。
c、气体:H2、H2S、CO2、SO2等。
d、单质和氧化物:H2、Na、Na2O、Fe2O3等。 ③可拆可不拆的物质:微溶物的强电解质在离子方程式中的形式根据具体情况决定。
若微溶物为澄清溶液,则拆成离子形式,若微溶物为浑浊,则不拆,仍写成化学式。
例如,澄清的石灰水与其它物质反应时Ca(OH)2应拆开,而浑浊的石灰水(或石灰乳)与其它物质反应时Ca(OH)2不能拆开。[思考与交流] 若将铜与硝酸银反应的离子方程式写成“ Cu+Ag+ = Cu2+ +Ag ”这一离子方程式正确吗?为什么?
分析:不正确,虽然是原子守恒,但不满足电荷守恒。
特别强调:书写四步中,“写”是基础,“拆” 是关键,“删”是途径,“查”是保证,每一步都必不可少。 [学以致用]1、写出下列反应的离子方程式:
①Ba(NO3)2+CuSO4=
离子方程式:
②Ba(OH)2+Na2SO4=
离子方程式:
③BaCl2+H2SO4=
离子方程式:
④Na2CO3+HCl=
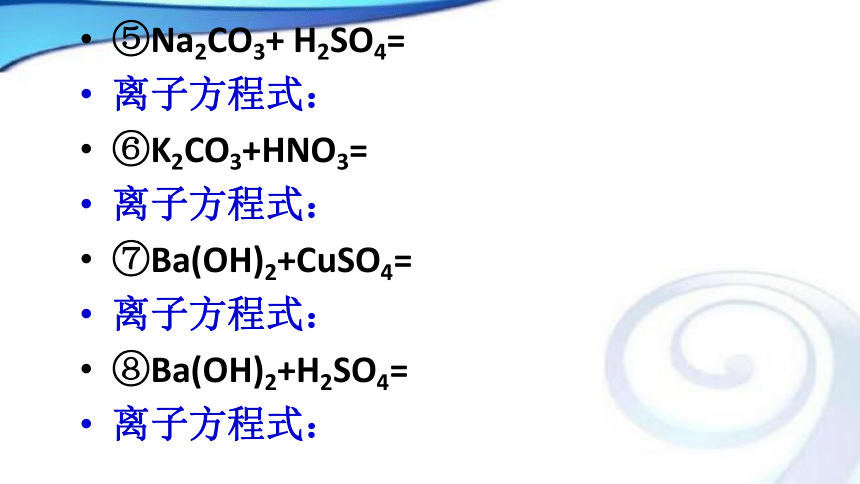
离子方程式:⑤Na2CO3+ H2SO4=
离子方程式:
⑥K2CO3+HNO3=
离子方程式:
⑦Ba(OH)2+CuSO4=
离子方程式:
⑧Ba(OH)2+H2SO4=
离子方程式:
2、请同学们写出几个符合离子方程式:H++OH-=H2O 的化学方程式。
(3)离子反应方程式的意义:
①离子反应方程式揭示了离子反应的实质。
②离子反应方程式不仅表示一个具体的离子反应,而且也表示所有同一类型的离子反应。 [思考与交流] 1、中和反应是一种常见的复分解反应,以NaOH溶液与盐酸的反应的离子方程式为例,分析中和反应的实质。为什么以上反应的有些化学反应的化学方程式不同,但是离子方程式却相同?
2、请同学们分析Ba(OH)2与H2SO4反应的离子反应方程式是否是:H+ +OH-=H2O?为什么?对你有什么启示?[课堂练习] 1、写出离子方程式:
①铁屑放入硫酸铜溶液
②氧化铜粉末加入稀硫酸
③在氢氧化钙溶液中滴加碳酸钠溶液
2、请同学们写符合Cu2+ + 2OH-= Cu(OH)2↓ 的两个化学方程式。
3、离子反应发生条件蓝色沉淀
红色变无色
产生气体 [探索与发现]
复分解反应发生的条件是什么?由此你可以探索离子反应发生的条件是什么?
复分解型离子反应发生的条件:
反应生成沉淀、气体或难电离的物质(弱酸、弱碱、水等)。
1.铁与稀盐酸反应:2Fe+6H+ =2Fe3++3H2↑3.铝与稀盐酸反应:Al+3H+ = Al3++H2↑【学与用】2.碳酸钙和醋酸反应:CO32-+2H+ =H2O+CO2↑4.Cu与氯化铁反应:Cu + Fe3+=Cu2++ Fe2+6.Ba(OH)2溶液和稀硫酸反应:Ba2++SO42- =BaSO4↓5.氢氧化钡和硫酸铜反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O判断下列离子方程式是否正确× 更正:2Fe+6H+ ==2Fe3++3H2↑
× 更正:CaCO3 + 2CH3COOH= Ca2+ +2CH3COO- +CO2 ↑+H2O
× 更正:2Al + 6H+ = 2Al3+ + 3H2 ↑
× 更正: Cu + 2Fe3+=Cu2++ 2Fe2+
× 更正:Ba2++Cu2+ +2OH-+SO42- =BaSO4↓+Cu(OH)2 ↓
× 更正:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
▲1.离子方程式正误判断依据
(1)客观事实 (2)拆分原则 (3)质量守恒
(4)电荷守恒 (5)漏掉反应 (6)阴阳离子配比①检查反应物和生成物是否正确。
②检查原子是否守恒。
③检查电荷是否守恒。
④检查各物质改写是否正确。
⑤检查阴阳离子配比是否符合化学方程式。判断离子方程式正确与否的方法: 【学以致用】1、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应:
CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉:
Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:
2Fe+6H+=2Fe3++3H2↑ B
2、下列离子方程式正确的是( )
A、氢氧化铝与盐酸反应:H++OH-=H2O
B、锌片与稀盐酸反应:Zn+2H+=Zn2++H2↑
C、硫酸与氢氧化钡溶液反应:
H++SO42-+OH-+Ba2+=Ba(OH)2↓+ H2O
D、二氧化碳与过量氢氧化钠溶液反应:
CO2+2OH-=CO32-+H2OB D 例题:下列离子方程式正确的是( )
A.铁和稀盐酸反应:
2Fe+6H+ =2Fe3++3H2↑
B.少量二氧化碳和足量NaOH溶液反应:
CO2+OH-= HCO3-
C.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
D.Ba(OH)2和CuSO4溶液反应:
Ba2++ SO42-= BaSO4↓
E、稀HCl和NH3·H2O反应:H++OH-= H2O
F、Ba(OH)2和H2SO4溶液反应:
Ba2++ OH- +H++ SO42-= BaSO4↓+ H2O
G、CaCO3和HCl 溶液反应:
CaCO3 +2H+=H2O+CO2↑+ Ca2+G四、离子共存问题【思考与交流】
两种离子在什么情况下可以大量共存?什么情况下不能大量共存?
【结论】离子之间不反应,就可以大量共存。只要离子间发生反应,就不能大量共存。
判断离子是否共存的依据:离子间是否反应。
【口诀】:不反应者能共存,能反应者不共存。
〖讨论〗 请同学们通过根据离子反应发生的条件,归纳总结离子在哪些具体反应时不能大量共存?【归纳与总结】 离子间不能共存的几种情况:
①生成难溶物质,如生成Cu(OH)2、BaSO4、AgCl 等;
②生成难电离物质,如生成CH3COOH、NH3·H2O、水等;
③生成易挥发物质,如生成H2S、CO2、SO2等;
④发生氧化还原反应,如具有氧化性的离子NO3—、MnO4— (有H+离子存在)、Fe3+和具有还原性的离子I-、Br-、 S2- 、SO32-,不能共存。【注意】附加条件: (1)题目中是否说明溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-。
(2)题目中是否说明溶液的颜色,如无色时可排除Fe3+、Cu2+、MnO4-、Fe2+等有色离子的存在。
(3)题目中是否说明反应类型及特殊反应。 例1、在无色透明强酸性溶液中,能大量
共存的离子组是( )
A、K+、Cu2+、NO3-、SO42-
B、K+、Na+、Cl-、CO32-
C、Ba2+、NH4+、NO3-、Cl-
D、K+、Na+、MnO4-、SO42-
分析:解答本题时,除了要抓住离子间不可能发生反应在外,还要注意两个隐含条件,强酸性溶液、且无色透明。所谓强酸性溶液,就是溶液中含有大量H+,离子组中应不含与H+反应的离子,(B)项中有CO32-,它能与H+反应;A、D两项中Cu2+和MnO4-在溶液中显色,则A、B、D不能符合,只有C组符合题意。
C 例2.下列各组离子在pH=1和pH=13的条件下,都能大量共存的是( )
A.Al3+ Mg2+ Cl- SO42-
B.K+ Na+ Cl- HCO3-
C.Fe2+ K+ NO3- SO42-
D.K+ Ba2+ NO3- Cl-
D 【思考与交流】对于涉及到定量的反应,怎样书写离子方程式?
基本方法:首先根据反应物间量的关系写出正确的化学方程式,然后改写为离子方程式。
简便方法:利用“少定多变”原则书写。五、与量有关的离子方程式的书写方法 例题1:(97年高考题)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液至中性,反应的离子方程式为:______。在以上中性溶液中,继续滴加氢氧化钡溶液,反应的离子方程式为:______。 例题2、请写出下列反应的
离子方程式:
(1)Ba(HCO3)2溶液与过量NaOH溶液反应:
(2)NaOH溶液与过量Ba(HCO3)2溶液反应:
(3)Ba(OH)2溶液与过量NaHCO3溶液反应:
(4)NaHCO3溶液与过量Ba(OH)2溶液反应:
(5)Ba(OH)2溶液与过量NaHSO4溶液反应:
(6)Ba(OH)2溶液与少量NaHSO4溶液反应: 小 结(1)离子反应和离子方程式的概念。
(2)离子方程式的书写
(3)判断离子方程式正确与否的方法。
(4)离子共存问题。活学活用 1.下列各溶液中的离子,因氧化还原反应
而不能大量共存的是
A.Na+ HCO3- K+ OH-
B.Fe3+ SCN- NH4+ Cl-
C.Na+ H+ SO42- S2O32-
D.AlO2- OH- Na+ NH4+
2.某无色溶液中加入铝粉产生氢气,则下列离子组合中,可能大量共存的是( )
A.K+ NH4+ Cl- NO3-
B.K+ Na+ Cl- HCO3-
C.K+ NH4+ Cl- SO42-
D.K+ CO32- Cl- SO32-3.下列离子方程式不正确的是( )
A.碳酸氢钙溶液跟盐酸反应: Ca(HCO3)2+2H+==Ca2++2H2O+2CO2↑
B.碘化钾溶液跟适量溴水反应:
2I-+Br2==I2+2Br-
C.将金属钠放入水中:
Na+2H2O==Na++2OH-+H2↑
D.将氯气通入氯化亚铁溶液中:
2Fe2++C12==2Fe3++ 2Cl-
4.分别写出FeBr2与:①少量Cl2;②足量Cl2;③等量Cl2反应的离子方程式。
5.写出二氧化碳与氢氧化钙以物质的量比为3∶2在溶液中进行反应的离子方程式。
6.写出硫酸铝与氢氧化钡以物质的量比为1∶4在溶液中进行反应的离子方程式。
4.下列离子方程式书写正确的是( )
A.溴化亚铁与足量氯气反应:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.二氧化锰和浓盐酸反应:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
C.亚硫酸钠与稀硫酸反应:
SO32-+2H+=H2O+SO2↑
D.硫化亚铁与稀硫酸反应:
2H++S2-=H2S↑B、C常见的几种物质的溶解性
第2课时
离子反应及其发生的条件
1、离子反应
(1)定义:有离子参加的反应叫做离子反应。
【说明】电解质溶于水后电离成为离子,所以电解质在水溶液中的反应属于离子反应。
[实验2-1] 请同学们按要求做实验,并填写下表:无现象
白色沉淀
思考:为什么BaCl2溶液能与Na2SO4溶液发生反应,而KCl溶液却不能呢?
(2)实质:离子反应的实质是某些离子之间结合生成新物质,使离子浓度发生变化。2、离子方程式:(1)定义:
用实际参加反应的离子的符号来表示离子反应的式子叫做离子方程式。
(2)离子方程式的书写步骤:
以硫酸钠与氯化钡反应为例:
①写:写出正确的化学方程式。
Na2SO4+BaCl2=BaSO4↓+2NaCl
②拆:将易溶且易电离的物质拆成离子形式,而难溶、难电离及气体等仍用化学式表示。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删:删去方程式两边不参加反应的离子。
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
即:Ba2++SO42-=BaSO4↓
④查:检查方程式两边各元素原子的个数和电荷总数是否守恒。
*离子方程式的书写步骤:写、拆、删、查[明辨是非]拆还是不拆? ①必须拆成离子形式的物质: 在反应中以离子形式存在的“易溶于水且易电离的物质”。
a、强 酸:HCl、H2SO4、HNO3等;
b、强 碱:KOH、NaOH、Ba(OH)2;
c、可溶盐:NaCl、Na2SO4、KNO3等。 ②不能拆成离子,仍用化学式表示的物质: 在反应时不是以离子形式存在的物质。
a、难溶物质:Cu(OH)2、BaSO4、AgCl 等。
b、难电离物质:CH3COOH、NH3·H2O、水。
c、气体:H2、H2S、CO2、SO2等。
d、单质和氧化物:H2、Na、Na2O、Fe2O3等。 ③可拆可不拆的物质:微溶物的强电解质在离子方程式中的形式根据具体情况决定。
若微溶物为澄清溶液,则拆成离子形式,若微溶物为浑浊,则不拆,仍写成化学式。
例如,澄清的石灰水与其它物质反应时Ca(OH)2应拆开,而浑浊的石灰水(或石灰乳)与其它物质反应时Ca(OH)2不能拆开。[思考与交流] 若将铜与硝酸银反应的离子方程式写成“ Cu+Ag+ = Cu2+ +Ag ”这一离子方程式正确吗?为什么?
分析:不正确,虽然是原子守恒,但不满足电荷守恒。
特别强调:书写四步中,“写”是基础,“拆” 是关键,“删”是途径,“查”是保证,每一步都必不可少。 [学以致用]1、写出下列反应的离子方程式:
①Ba(NO3)2+CuSO4=
离子方程式:
②Ba(OH)2+Na2SO4=
离子方程式:
③BaCl2+H2SO4=
离子方程式:
④Na2CO3+HCl=
离子方程式:⑤Na2CO3+ H2SO4=
离子方程式:
⑥K2CO3+HNO3=
离子方程式:
⑦Ba(OH)2+CuSO4=
离子方程式:
⑧Ba(OH)2+H2SO4=
离子方程式:
2、请同学们写出几个符合离子方程式:H++OH-=H2O 的化学方程式。
(3)离子反应方程式的意义:
①离子反应方程式揭示了离子反应的实质。
②离子反应方程式不仅表示一个具体的离子反应,而且也表示所有同一类型的离子反应。 [思考与交流] 1、中和反应是一种常见的复分解反应,以NaOH溶液与盐酸的反应的离子方程式为例,分析中和反应的实质。为什么以上反应的有些化学反应的化学方程式不同,但是离子方程式却相同?
2、请同学们分析Ba(OH)2与H2SO4反应的离子反应方程式是否是:H+ +OH-=H2O?为什么?对你有什么启示?[课堂练习] 1、写出离子方程式:
①铁屑放入硫酸铜溶液
②氧化铜粉末加入稀硫酸
③在氢氧化钙溶液中滴加碳酸钠溶液
2、请同学们写符合Cu2+ + 2OH-= Cu(OH)2↓ 的两个化学方程式。
3、离子反应发生条件蓝色沉淀
红色变无色
产生气体 [探索与发现]
复分解反应发生的条件是什么?由此你可以探索离子反应发生的条件是什么?
复分解型离子反应发生的条件:
反应生成沉淀、气体或难电离的物质(弱酸、弱碱、水等)。
1.铁与稀盐酸反应:2Fe+6H+ =2Fe3++3H2↑3.铝与稀盐酸反应:Al+3H+ = Al3++H2↑【学与用】2.碳酸钙和醋酸反应:CO32-+2H+ =H2O+CO2↑4.Cu与氯化铁反应:Cu + Fe3+=Cu2++ Fe2+6.Ba(OH)2溶液和稀硫酸反应:Ba2++SO42- =BaSO4↓5.氢氧化钡和硫酸铜反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O判断下列离子方程式是否正确× 更正:2Fe+6H+ ==2Fe3++3H2↑
× 更正:CaCO3 + 2CH3COOH= Ca2+ +2CH3COO- +CO2 ↑+H2O
× 更正:2Al + 6H+ = 2Al3+ + 3H2 ↑
× 更正: Cu + 2Fe3+=Cu2++ 2Fe2+
× 更正:Ba2++Cu2+ +2OH-+SO42- =BaSO4↓+Cu(OH)2 ↓
× 更正:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
▲1.离子方程式正误判断依据
(1)客观事实 (2)拆分原则 (3)质量守恒
(4)电荷守恒 (5)漏掉反应 (6)阴阳离子配比①检查反应物和生成物是否正确。
②检查原子是否守恒。
③检查电荷是否守恒。
④检查各物质改写是否正确。
⑤检查阴阳离子配比是否符合化学方程式。判断离子方程式正确与否的方法: 【学以致用】1、下列离子方程式,书写正确的是( )
A、盐酸与碳酸钡反应:
CO32-+2H+=CO2↑+H2O
B、硫酸铜溶液与氢氧化钡溶液:
Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
C、硝酸银溶液中加入铜粉:
Ag++Cu=Cu2++Ag
D、铁与稀盐酸反应:
2Fe+6H+=2Fe3++3H2↑ B
2、下列离子方程式正确的是( )
A、氢氧化铝与盐酸反应:H++OH-=H2O
B、锌片与稀盐酸反应:Zn+2H+=Zn2++H2↑
C、硫酸与氢氧化钡溶液反应:
H++SO42-+OH-+Ba2+=Ba(OH)2↓+ H2O
D、二氧化碳与过量氢氧化钠溶液反应:
CO2+2OH-=CO32-+H2OB D 例题:下列离子方程式正确的是( )
A.铁和稀盐酸反应:
2Fe+6H+ =2Fe3++3H2↑
B.少量二氧化碳和足量NaOH溶液反应:
CO2+OH-= HCO3-
C.Na2CO3和醋酸反应:2H+ +CO32-=H2O+CO2↑
D.Ba(OH)2和CuSO4溶液反应:
Ba2++ SO42-= BaSO4↓
E、稀HCl和NH3·H2O反应:H++OH-= H2O
F、Ba(OH)2和H2SO4溶液反应:
Ba2++ OH- +H++ SO42-= BaSO4↓+ H2O
G、CaCO3和HCl 溶液反应:
CaCO3 +2H+=H2O+CO2↑+ Ca2+G四、离子共存问题【思考与交流】
两种离子在什么情况下可以大量共存?什么情况下不能大量共存?
【结论】离子之间不反应,就可以大量共存。只要离子间发生反应,就不能大量共存。
判断离子是否共存的依据:离子间是否反应。
【口诀】:不反应者能共存,能反应者不共存。
〖讨论〗 请同学们通过根据离子反应发生的条件,归纳总结离子在哪些具体反应时不能大量共存?【归纳与总结】 离子间不能共存的几种情况:
①生成难溶物质,如生成Cu(OH)2、BaSO4、AgCl 等;
②生成难电离物质,如生成CH3COOH、NH3·H2O、水等;
③生成易挥发物质,如生成H2S、CO2、SO2等;
④发生氧化还原反应,如具有氧化性的离子NO3—、MnO4— (有H+离子存在)、Fe3+和具有还原性的离子I-、Br-、 S2- 、SO32-,不能共存。【注意】附加条件: (1)题目中是否说明溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-。
(2)题目中是否说明溶液的颜色,如无色时可排除Fe3+、Cu2+、MnO4-、Fe2+等有色离子的存在。
(3)题目中是否说明反应类型及特殊反应。 例1、在无色透明强酸性溶液中,能大量
共存的离子组是( )
A、K+、Cu2+、NO3-、SO42-
B、K+、Na+、Cl-、CO32-
C、Ba2+、NH4+、NO3-、Cl-
D、K+、Na+、MnO4-、SO42-
分析:解答本题时,除了要抓住离子间不可能发生反应在外,还要注意两个隐含条件,强酸性溶液、且无色透明。所谓强酸性溶液,就是溶液中含有大量H+,离子组中应不含与H+反应的离子,(B)项中有CO32-,它能与H+反应;A、D两项中Cu2+和MnO4-在溶液中显色,则A、B、D不能符合,只有C组符合题意。
C 例2.下列各组离子在pH=1和pH=13的条件下,都能大量共存的是( )
A.Al3+ Mg2+ Cl- SO42-
B.K+ Na+ Cl- HCO3-
C.Fe2+ K+ NO3- SO42-
D.K+ Ba2+ NO3- Cl-
D 【思考与交流】对于涉及到定量的反应,怎样书写离子方程式?
基本方法:首先根据反应物间量的关系写出正确的化学方程式,然后改写为离子方程式。
简便方法:利用“少定多变”原则书写。五、与量有关的离子方程式的书写方法 例题1:(97年高考题)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液至中性,反应的离子方程式为:______。在以上中性溶液中,继续滴加氢氧化钡溶液,反应的离子方程式为:______。 例题2、请写出下列反应的
离子方程式:
(1)Ba(HCO3)2溶液与过量NaOH溶液反应:
(2)NaOH溶液与过量Ba(HCO3)2溶液反应:
(3)Ba(OH)2溶液与过量NaHCO3溶液反应:
(4)NaHCO3溶液与过量Ba(OH)2溶液反应:
(5)Ba(OH)2溶液与过量NaHSO4溶液反应:
(6)Ba(OH)2溶液与少量NaHSO4溶液反应: 小 结(1)离子反应和离子方程式的概念。
(2)离子方程式的书写
(3)判断离子方程式正确与否的方法。
(4)离子共存问题。活学活用 1.下列各溶液中的离子,因氧化还原反应
而不能大量共存的是
A.Na+ HCO3- K+ OH-
B.Fe3+ SCN- NH4+ Cl-
C.Na+ H+ SO42- S2O32-
D.AlO2- OH- Na+ NH4+
2.某无色溶液中加入铝粉产生氢气,则下列离子组合中,可能大量共存的是( )
A.K+ NH4+ Cl- NO3-
B.K+ Na+ Cl- HCO3-
C.K+ NH4+ Cl- SO42-
D.K+ CO32- Cl- SO32-3.下列离子方程式不正确的是( )
A.碳酸氢钙溶液跟盐酸反应: Ca(HCO3)2+2H+==Ca2++2H2O+2CO2↑
B.碘化钾溶液跟适量溴水反应:
2I-+Br2==I2+2Br-
C.将金属钠放入水中:
Na+2H2O==Na++2OH-+H2↑
D.将氯气通入氯化亚铁溶液中:
2Fe2++C12==2Fe3++ 2Cl-
4.分别写出FeBr2与:①少量Cl2;②足量Cl2;③等量Cl2反应的离子方程式。
5.写出二氧化碳与氢氧化钙以物质的量比为3∶2在溶液中进行反应的离子方程式。
6.写出硫酸铝与氢氧化钡以物质的量比为1∶4在溶液中进行反应的离子方程式。
4.下列离子方程式书写正确的是( )
A.溴化亚铁与足量氯气反应:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.二氧化锰和浓盐酸反应:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
C.亚硫酸钠与稀硫酸反应:
SO32-+2H+=H2O+SO2↑
D.硫化亚铁与稀硫酸反应:
2H++S2-=H2S↑B、C常见的几种物质的溶解性
