人教版高中化学必修一2.3氧化还原反应(第1课时课件3)(共18张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3氧化还原反应(第1课时课件3)(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 357.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 11:52:48 | ||
图片预览




文档简介
课件18张PPT。氧化还原反应 第三节第1课时【思考与交流1】 铁生锈 (铁与氧气反应) 写出下图变化的化学方程式,并指出其反应类型及其分类标准。 冶炼铜
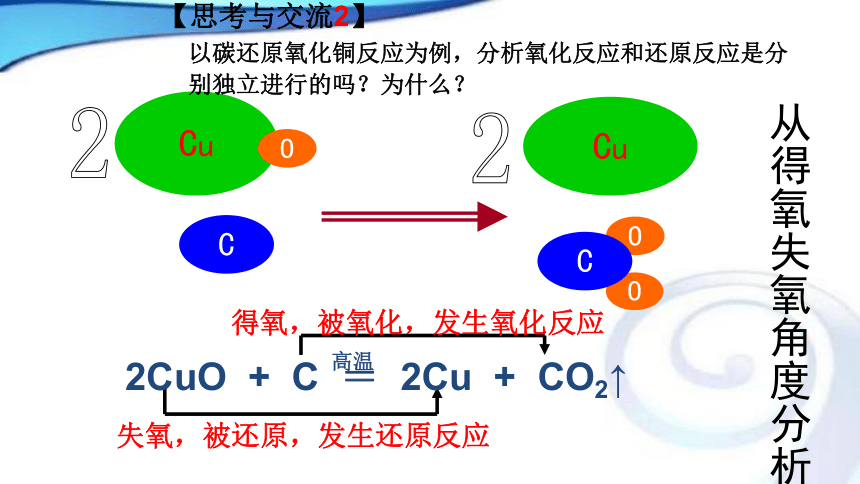
(碳还原氧化铜) 4Fe + 3O2 = 2Fe2O3 (氧化反应) (还原反应) CuOOCuOC【思考与交流2】 以碳还原氧化铜反应为例,分析氧化反应和还原反应是分别独立进行的吗?为什么?C失氧,被还原,发生还原反应得氧,被氧化,发生氧化反应22【思考与交流3】 类似于上述的反应还有:请同学们小结出此类化学反应的分类标准。【结论】一、氧化还原反应:
1、从得失氧的角度分析:
氧化反应:得到氧的反应。
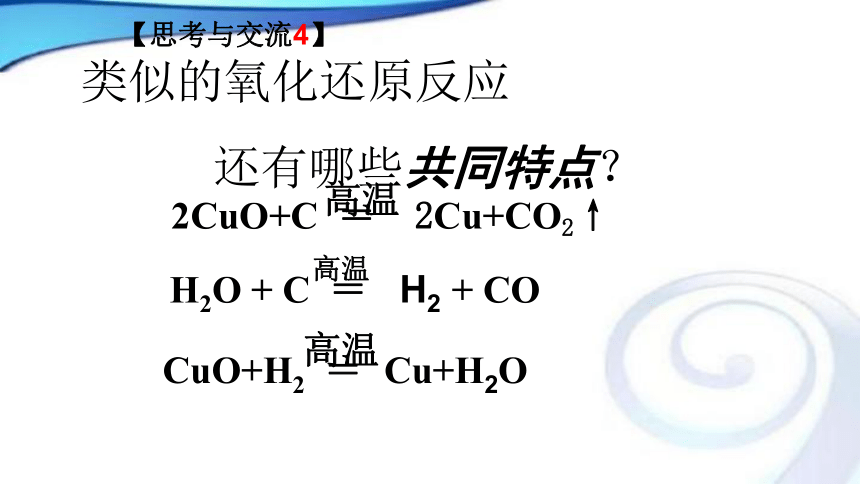
还原反应:失去氧的反应。氧化反应与还原反应:同时发生。【思考与交流4】 类似的氧化还原反应
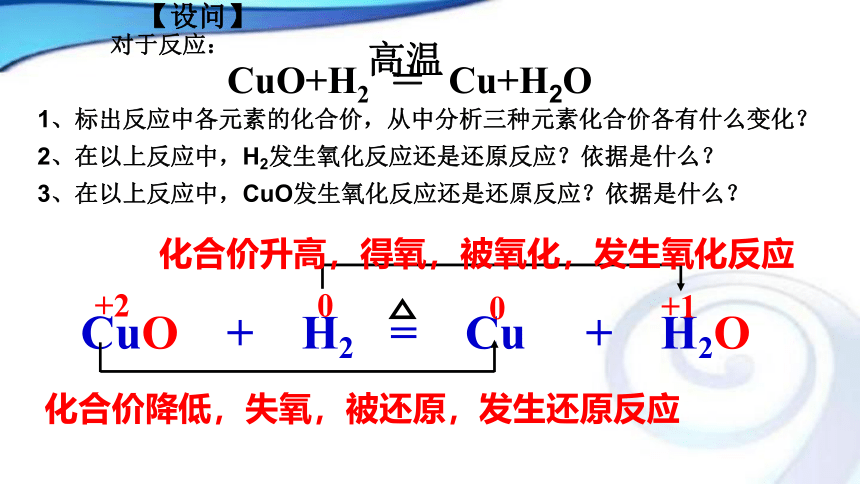
还有哪些共同特点?【设问】 对于反应:
1、标出反应中各元素的化合价,从中分析三种元素化合价各有什么变化?
2、在以上反应中,H2发生氧化反应还是还原反应?依据是什么?
3、在以上反应中,CuO发生氧化反应还是还原反应?依据是什么?化合价升高,得氧,被氧化,发生氧化反应化合价降低,失氧,被还原,发生还原反应+200+1【思考与交流4】 那这些氧化还原反应的共同特点是什么? 有某些元素化合价
的升高与降低。 氧化反应与化合价升降变化有什么关系?
还原反应与化合价升降变化又有什么关系? 【思考与交流5】 【回答】 所含元素的化合价升高的物质发生氧化反应;
所含元素的化合价降低的物质发生还原反应。【思考与交流6】 请大家分析:Fe+CuSO4=Cu+FeSO4
1、标出反应中变价元素的化合价,从中分析元素化合价有什么变化?
2、在以上反应中,Fe发生什么反应?依据是什么?
3、在以上反应中,CuSO4发生什么反应?依据是什么?
4、是否属于氧化还原反应?化合价升高、发生氧化反应化合价降低、发生还原反应0+2+20是否只有得氧、失氧的反应才是氧化还原反应?判断某反应是否是氧化还原反应的依据是什么?【思考与交流7】 2、从化合价升降的角度分析:
凡是有元素化合价升降的化学反应都是氧化还原反应。
所含元素的化合价升高的物质发生氧化反应;
所含元素化合价降低的物质发生还原反应。
【结论】【活动与探究】这两个反应虽没有氧的得失,是否属于氧化还原反应,为什么?
哪种物质发生氧化反应,哪种物质发生还原反应?为什么?以上氧化还原反应的化合价为什么会发生变化?
其变化的本质是什么?【思考与交流8】 【回顾】请同学们写出H、O、Ne、Na、Mg、Cl、Ar原子结构示意图。化合物NaCl的形成过程【思考与交流9】 电子转移 2e- 2e-0+10-1失去得到,化合价升高,被氧化,化合价降低,被还原化合价的升降与电子的转移具体关系如何呢?-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7化合价升高, 电子化合价降低, 电子失去得到【结论】
本质定义:有电子转移(得失或偏移)的化学反
应都是氧化还原反应。化合物 HCl 的形成过程化合价升降的原因:共用电子对的偏移
非金属元素
原子之间反应没有电
子得失,那么它们之
间是怎么反应的呢?【思考与交流10】 氧化还原反应发展历程◆从得氧、失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升、降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子得失角度分析
是氧化还原反应的本质本课小结:1、了解了氧化还原反应的特征
2、熟练判断是否氧化还原反应
3、从电子得失角度分析氧化还原反应的本质【板书设计】
第三节 氧化还原反应
一、氧化还原反应:
1、从得失氧的角度分析:
氧化反应:得到氧的反应。
还原反应:失去氧的反应。
2、从化合价升降的角度分析:
所含元素的化合价升高的物质发生氧化反应;
所含元素化合价降低的物质发生还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应。
二、氧化还原反应的概念
1、氧化反应:指反应物中的某元素失电子、化合价升高的反应过程。
2、还原反应:指反应物中某元素得电子、化合价降低的反应过程。
3、氧化还原反应:凡是有电子转移的反应叫氧化还原反应。
(碳还原氧化铜) 4Fe + 3O2 = 2Fe2O3 (氧化反应) (还原反应) CuOOCuOC【思考与交流2】 以碳还原氧化铜反应为例,分析氧化反应和还原反应是分别独立进行的吗?为什么?C失氧,被还原,发生还原反应得氧,被氧化,发生氧化反应22【思考与交流3】 类似于上述的反应还有:请同学们小结出此类化学反应的分类标准。【结论】一、氧化还原反应:
1、从得失氧的角度分析:
氧化反应:得到氧的反应。
还原反应:失去氧的反应。氧化反应与还原反应:同时发生。【思考与交流4】 类似的氧化还原反应
还有哪些共同特点?【设问】 对于反应:
1、标出反应中各元素的化合价,从中分析三种元素化合价各有什么变化?
2、在以上反应中,H2发生氧化反应还是还原反应?依据是什么?
3、在以上反应中,CuO发生氧化反应还是还原反应?依据是什么?化合价升高,得氧,被氧化,发生氧化反应化合价降低,失氧,被还原,发生还原反应+200+1【思考与交流4】 那这些氧化还原反应的共同特点是什么? 有某些元素化合价
的升高与降低。 氧化反应与化合价升降变化有什么关系?
还原反应与化合价升降变化又有什么关系? 【思考与交流5】 【回答】 所含元素的化合价升高的物质发生氧化反应;
所含元素的化合价降低的物质发生还原反应。【思考与交流6】 请大家分析:Fe+CuSO4=Cu+FeSO4
1、标出反应中变价元素的化合价,从中分析元素化合价有什么变化?
2、在以上反应中,Fe发生什么反应?依据是什么?
3、在以上反应中,CuSO4发生什么反应?依据是什么?
4、是否属于氧化还原反应?化合价升高、发生氧化反应化合价降低、发生还原反应0+2+20是否只有得氧、失氧的反应才是氧化还原反应?判断某反应是否是氧化还原反应的依据是什么?【思考与交流7】 2、从化合价升降的角度分析:
凡是有元素化合价升降的化学反应都是氧化还原反应。
所含元素的化合价升高的物质发生氧化反应;
所含元素化合价降低的物质发生还原反应。
【结论】【活动与探究】这两个反应虽没有氧的得失,是否属于氧化还原反应,为什么?
哪种物质发生氧化反应,哪种物质发生还原反应?为什么?以上氧化还原反应的化合价为什么会发生变化?
其变化的本质是什么?【思考与交流8】 【回顾】请同学们写出H、O、Ne、Na、Mg、Cl、Ar原子结构示意图。化合物NaCl的形成过程【思考与交流9】 电子转移 2e- 2e-0+10-1失去得到,化合价升高,被氧化,化合价降低,被还原化合价的升降与电子的转移具体关系如何呢?-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7化合价升高, 电子化合价降低, 电子失去得到【结论】
本质定义:有电子转移(得失或偏移)的化学反
应都是氧化还原反应。化合物 HCl 的形成过程化合价升降的原因:共用电子对的偏移
非金属元素
原子之间反应没有电
子得失,那么它们之
间是怎么反应的呢?【思考与交流10】 氧化还原反应发展历程◆从得氧、失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升、降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子得失角度分析
是氧化还原反应的本质本课小结:1、了解了氧化还原反应的特征
2、熟练判断是否氧化还原反应
3、从电子得失角度分析氧化还原反应的本质【板书设计】
第三节 氧化还原反应
一、氧化还原反应:
1、从得失氧的角度分析:
氧化反应:得到氧的反应。
还原反应:失去氧的反应。
2、从化合价升降的角度分析:
所含元素的化合价升高的物质发生氧化反应;
所含元素化合价降低的物质发生还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应。
二、氧化还原反应的概念
1、氧化反应:指反应物中的某元素失电子、化合价升高的反应过程。
2、还原反应:指反应物中某元素得电子、化合价降低的反应过程。
3、氧化还原反应:凡是有电子转移的反应叫氧化还原反应。
