人教版高中化学必修一2.3氧化还原反应(第2课时课件1)(共8张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3氧化还原反应(第2课时课件1)(共8张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 107.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 11:53:07 | ||
图片预览



文档简介
课件8张PPT。 组织建设化学 · 必修1 氧化剂和还原剂练一练用双线桥标出以下反应的电子转移情况:(1)Fe + CuSO4 = FeSO4 + Cu(2)2H2 + O2 = 2H2O点燃(4)2KMnO4 = K2MnO4 + MnO2 + O2(3)2H2O2 = 2H2O + O2↑(5)SO2+2H2S = 3 S↓+2H2O(在溶液中)歧化反应
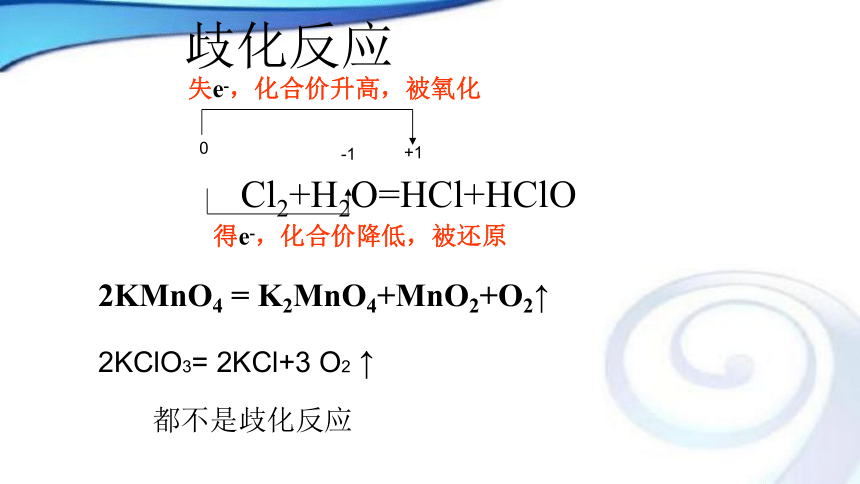
Cl2+H2O=HCl+HClO0+1-1失e-,化合价升高,被氧化得e-,化合价降低,被还原2KMnO4 = K2MnO4+MnO2+O2↑2KClO3= 2KCl+3 O2 ↑都不是歧化反应归中反应SO2+2H2S = 3 S↓+2H2O(在溶液中反应)失4e-,化合价升高,被氧化得4e-,化合价降低,被还原+4-20氧化剂:得电子(或电子对偏向)的 物质
在反应时所含元素的化合价降低
具有氧化性,本身被还原还原剂:失电子(或电子对偏离)的 物质,
在反应时所含元素的化合价升高,
具有还原性,本身被氧化 氧化剂和还原剂(反应物) 氧化产物和还原产物(生成物)氧化产物:氧化反应得到的产物(还原剂得到的产物)还原产物:还原反应得到的产物(氧化剂得到的产物)常见的氧化剂、还原剂⑴氧化剂: 得电子,化合价降低,高价态物质。1)活泼的非金属单质:O2 , Cl2
2)高价的氧化物:CuO , Fe2O3
3)高价的含氧酸及其盐:
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
4)某些阳离子:Fe3+ , H+`⑵还原剂: 失电子,化合价升高,低价态物质 (1)活泼的金属单质:K , Na , Mg , Fe , Al
(2)某些非金属单质:H2 , C
(3)变价元素的低价态物质:CO , Cu+
(4)某些阴离子: I-, S2-
2CuO + C = 2Cu + CO2 化合价降低,得2 ×2e-,被还原,还原反应+200+4化合价升高,失1×4e-,被氧化,氧化反应还原剂氧化剂氧化产物还原产物高---失---氧--- 还(剂) ---氧(产物)
降---得---还---氧(剂) ---还(产物)
Cl2+H2O=HCl+HClO0+1-1失e-,化合价升高,被氧化得e-,化合价降低,被还原2KMnO4 = K2MnO4+MnO2+O2↑2KClO3= 2KCl+3 O2 ↑都不是歧化反应归中反应SO2+2H2S = 3 S↓+2H2O(在溶液中反应)失4e-,化合价升高,被氧化得4e-,化合价降低,被还原+4-20氧化剂:得电子(或电子对偏向)的 物质
在反应时所含元素的化合价降低
具有氧化性,本身被还原还原剂:失电子(或电子对偏离)的 物质,
在反应时所含元素的化合价升高,
具有还原性,本身被氧化 氧化剂和还原剂(反应物) 氧化产物和还原产物(生成物)氧化产物:氧化反应得到的产物(还原剂得到的产物)还原产物:还原反应得到的产物(氧化剂得到的产物)常见的氧化剂、还原剂⑴氧化剂: 得电子,化合价降低,高价态物质。1)活泼的非金属单质:O2 , Cl2
2)高价的氧化物:CuO , Fe2O3
3)高价的含氧酸及其盐:
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
4)某些阳离子:Fe3+ , H+`⑵还原剂: 失电子,化合价升高,低价态物质 (1)活泼的金属单质:K , Na , Mg , Fe , Al
(2)某些非金属单质:H2 , C
(3)变价元素的低价态物质:CO , Cu+
(4)某些阴离子: I-, S2-
2CuO + C = 2Cu + CO2 化合价降低,得2 ×2e-,被还原,还原反应+200+4化合价升高,失1×4e-,被氧化,氧化反应还原剂氧化剂氧化产物还原产物高---失---氧--- 还(剂) ---氧(产物)
降---得---还---氧(剂) ---还(产物)
