人教版高中化学必修一2.3氧化还原反应(第2课时课件2)(共15张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3氧化还原反应(第2课时课件2)(共15张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 156.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 11:55:20 | ||
图片预览





文档简介
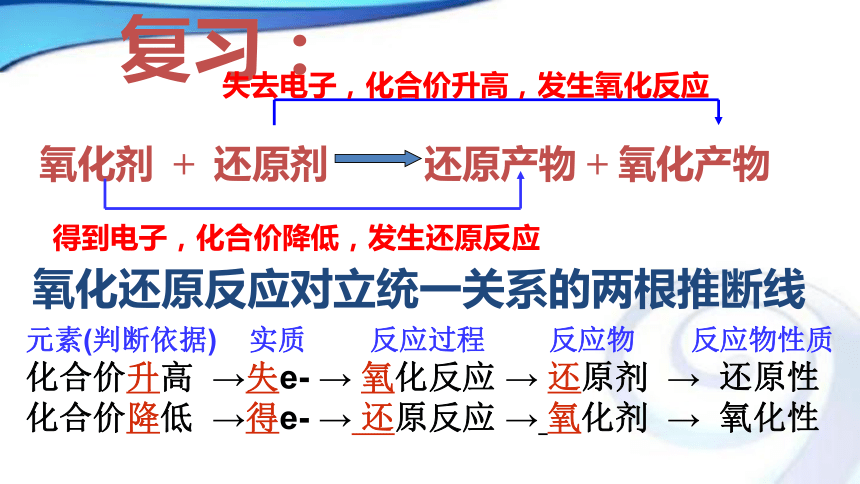
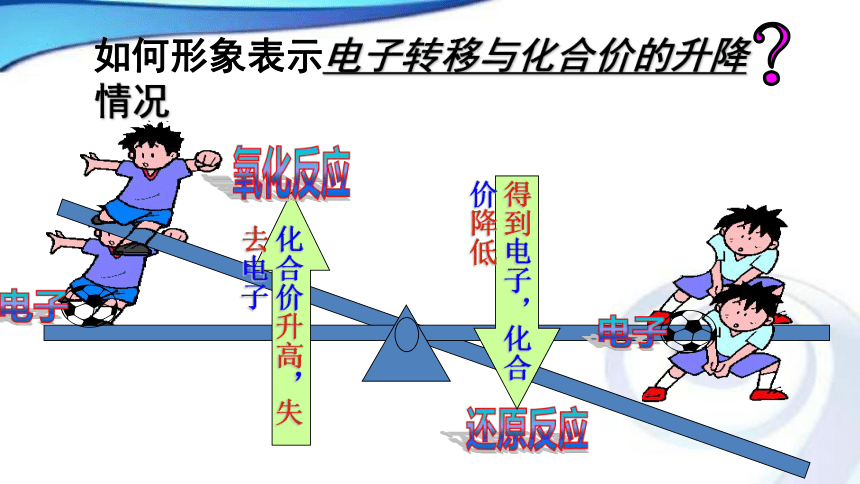
课件15张PPT。2018-10-141普通高中课程标准实验教科书 化学1(必修)第 2 章第 3节 氧化剂还原剂复习:失去电子,化合价升高,发生氧化反应得到电子,化合价降低,发生还原反应元素(判断依据) 实质 反应过程 反应物 反应物性质
化合价升高 →失e- → 氧化反应 → 还原剂 → 还原性
化合价降低 →得e- → 还原反应 → 氧化剂 → 氧化性氧化还原反应对立统一关系的两根推断线练习1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的转移BD2. 根据下列物质变化中化合价的情况,判断属于还原反应
的是( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3A催化剂氧化剂氧化剂还原剂氧化剂、还原剂氧化剂还原产物还原剂练习:
(1)“双线桥”法 +200+1化合价降低,得到2e-,被还原 化合价升高,失去2×e- ,被氧化 B、标得失
(得失电子总数相等)C 、电子转移的数目
m ×n e- 氧化还原反应的表示方法: 注意:失去 6× 2e-得 2×6e-m 反应中实际有多少个原子发生了电子转移
n 1个原子转移的电子数目 +5 -2 -1 0(2)“单线桥”法 (了解)2e-注意:A、箭头由失电子元素指向得电子元素 。B、只须标明电子转移总数。 [演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂+7-1〖交流·探究〗(1)、物质中的元素为最高价时:
一般做氧化剂,显氧化性
(2)、物质中的元素为最低价时:
一般做还原剂,显还原性
(3)、物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂 元素的化合价与物质的氧化性、还原性关系一般规律:
高价氧化低价还,中间价态两边转。练习:学案例3活泼的非金属单质: O2、Cl2等
高价态的含氧酸: HNO3 ,浓H2SO4等
含高价态元素的盐:高锰酸钾,氯化铁,氯酸钾等
KMnO4 FeCl3 KClO3
其他:H2O2,Na2O2,HClO, NaClO等常见的氧化剂和还原剂:氧化剂活泼的金属单质:钾,钠,镁,铝,锌,铁,铜
非金属单质: H2、C
低价态的氧化物和盐:CO,SO2 ; 硫化钠(Na2S),
碘化钾(KI), 亚硫酸钠(Na2SO3), 硫酸亚铁(FeSO4)还原剂1、氧化性、还原性强弱的初步判断氧化性:得电子的难易
还原性:失电子的难易判据K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au单质还原性逐渐减弱,失电子能力逐渐减弱 K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H +) Cu2+ Hg2+ Ag+对应阳离子氧化性逐渐增强,得电子能力逐渐增强氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物(2)在同一反应中:例 Fe + CuSO4 == FeSO4 + Cu (1)氧化还原反应的一般规律:氧化剂 + 还原剂 ==还原产物 + 氧化产物A2:某条件下,有反应:(1)2 A3+ + 3B = 2A + 3B2+
(2)3D2+ + 2A = 2A3+ + 3D
(3) B2+ + C = C2+ + B① 判定 A、B、C、D的还原性由强到弱的顺序( )
A.A >B >C >D B.D >C >B >A
C.C >B >A >D D.B >A >C >D
② 该条件下,反应 B2+ + D = D2+ + B能进行吗?B > AA > D C > B A3+ > B2+ D2+ > A3+B2+ > C2+ C不能2、守恒规律:
电子有得必有失,得电子总数等于失电子总数
化合价有升必有降,化合价升高总数等于化合价降低总数学案: 例题23、先后规律:
在氧化还原反应中,遵循强者为先,即谁的氧化性(或还原性)最强,谁就先发生反应。氧化还原反应的一般规律:4、根据反应的难易比较:
不同的氧化剂与同一种还原剂反应,反应越容易,则氧化剂的氧化性越强;不同的还原剂与同一种氧化剂反应,反应越容易,则还原剂的还原性越强。AKMnO4 > MnO2 > O2
化合价升高 →失e- → 氧化反应 → 还原剂 → 还原性
化合价降低 →得e- → 还原反应 → 氧化剂 → 氧化性氧化还原反应对立统一关系的两根推断线练习1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的转移BD2. 根据下列物质变化中化合价的情况,判断属于还原反应
的是( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3A催化剂氧化剂氧化剂还原剂氧化剂、还原剂氧化剂还原产物还原剂练习:
(1)“双线桥”法 +200+1化合价降低,得到2e-,被还原 化合价升高,失去2×e- ,被氧化 B、标得失
(得失电子总数相等)C 、电子转移的数目
m ×n e- 氧化还原反应的表示方法: 注意:失去 6× 2e-得 2×6e-m 反应中实际有多少个原子发生了电子转移
n 1个原子转移的电子数目 +5 -2 -1 0(2)“单线桥”法 (了解)2e-注意:A、箭头由失电子元素指向得电子元素 。B、只须标明电子转移总数。 [演示实验] KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂+7-1〖交流·探究〗(1)、物质中的元素为最高价时:
一般做氧化剂,显氧化性
(2)、物质中的元素为最低价时:
一般做还原剂,显还原性
(3)、物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂 元素的化合价与物质的氧化性、还原性关系一般规律:
高价氧化低价还,中间价态两边转。练习:学案例3活泼的非金属单质: O2、Cl2等
高价态的含氧酸: HNO3 ,浓H2SO4等
含高价态元素的盐:高锰酸钾,氯化铁,氯酸钾等
KMnO4 FeCl3 KClO3
其他:H2O2,Na2O2,HClO, NaClO等常见的氧化剂和还原剂:氧化剂活泼的金属单质:钾,钠,镁,铝,锌,铁,铜
非金属单质: H2、C
低价态的氧化物和盐:CO,SO2 ; 硫化钠(Na2S),
碘化钾(KI), 亚硫酸钠(Na2SO3), 硫酸亚铁(FeSO4)还原剂1、氧化性、还原性强弱的初步判断氧化性:得电子的难易
还原性:失电子的难易判据K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au单质还原性逐渐减弱,失电子能力逐渐减弱 K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H +) Cu2+ Hg2+ Ag+对应阳离子氧化性逐渐增强,得电子能力逐渐增强氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物(2)在同一反应中:例 Fe + CuSO4 == FeSO4 + Cu (1)氧化还原反应的一般规律:氧化剂 + 还原剂 ==还原产物 + 氧化产物A2:某条件下,有反应:(1)2 A3+ + 3B = 2A + 3B2+
(2)3D2+ + 2A = 2A3+ + 3D
(3) B2+ + C = C2+ + B① 判定 A、B、C、D的还原性由强到弱的顺序( )
A.A >B >C >D B.D >C >B >A
C.C >B >A >D D.B >A >C >D
② 该条件下,反应 B2+ + D = D2+ + B能进行吗?B > AA > D C > B A3+ > B2+ D2+ > A3+B2+ > C2+ C不能2、守恒规律:
电子有得必有失,得电子总数等于失电子总数
化合价有升必有降,化合价升高总数等于化合价降低总数学案: 例题23、先后规律:
在氧化还原反应中,遵循强者为先,即谁的氧化性(或还原性)最强,谁就先发生反应。氧化还原反应的一般规律:4、根据反应的难易比较:
不同的氧化剂与同一种还原剂反应,反应越容易,则氧化剂的氧化性越强;不同的还原剂与同一种氧化剂反应,反应越容易,则还原剂的还原性越强。AKMnO4 > MnO2 > O2
