人教版高中化学必修一2.3氧化还原反应(第1课时课件1)(共14张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3氧化还原反应(第1课时课件1)(共14张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 126.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 00:00:00 | ||
图片预览






文档简介
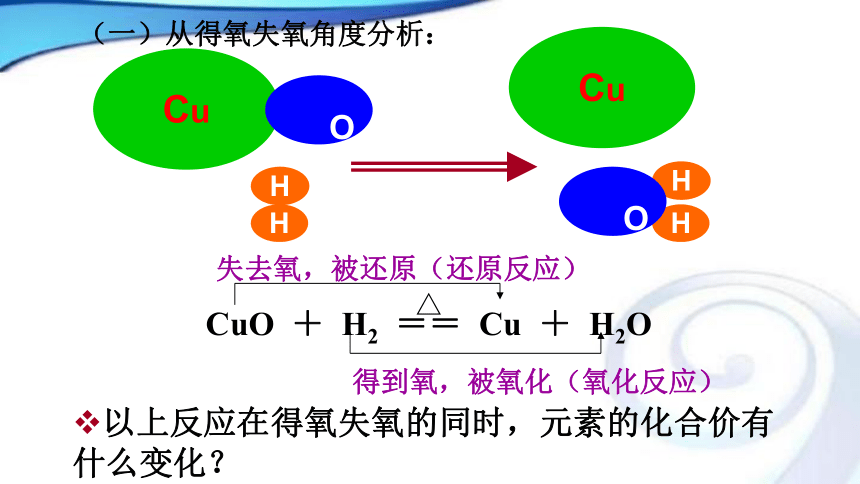
课件14张PPT。氧化还原反应第一课时根据所学的化学反应的分类方法,分析H2 + CuO = H2O + Cu所属的反应类型?△得到氧,被氧化(氧化反应)△CuO + H2 == Cu + H2O 失去氧,被还原(还原反应)Cu
OHHCuHH
O(一)从得氧失氧角度分析:以上反应在得氧失氧的同时,元素的化合价有什么变化?讨论1、从四种基本反应类型角度分析
Fe2O3+3CO=2Fe+3CO2
属于哪种类型的反应?
2、从得氧和失氧的角度分析,上述反应是否仅仅属于还原反应?高温氧化反应和还原反应既对立,又统一,两者同时进行,不可分割。化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O(二)从化合价升降角度分析:化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) H2O + C === H2 + CO[定义]有元素化合价升降的化学反应称为氧化还原反应[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。练习:下列反应中属于氧化还原反应的是( )
A. CaO + H2O == Ca(OH)2
B. 2KMnO4 == K2MnO4 + MnO2 + O2↑
3Fe + 2O2 == Fe3O4
CaCO3 == CaO + CO2
初、高中概念对比课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。下列反应既属于化合反应,又属于氧化还原反应的是( )
A SO3+H2O==H2SO4
B 2FeCl2+Cl2==2FeCl3
C CaO+H2O==Ca(OH)2
D 2Cu+O2+CO2+H2O==Cu2(OH)2CO3B、D化合价升降的原因: 电子的得失(三)从电子得失角度分析:失去e-失去e-后得到e-后Na+[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。化合价升降的原因:共用电子对的偏移H Cl在反应中失去和得到电子的物质如何定义?判断以下反应是否为氧化还原反应,如果是,
请标示出化合价的变化CuSO4+2NaOH==Cu(OH)2+Na2SO4
2FeCl2+Cl2==2FeCl3
Cu+2H2SO4==CuSO4+SO2 ↑ + 2H2O
2KClO3==2KCl+3O2 ↑指出氧化剂和还原剂
OHHCuHH
O(一)从得氧失氧角度分析:以上反应在得氧失氧的同时,元素的化合价有什么变化?讨论1、从四种基本反应类型角度分析
Fe2O3+3CO=2Fe+3CO2
属于哪种类型的反应?
2、从得氧和失氧的角度分析,上述反应是否仅仅属于还原反应?高温氧化反应和还原反应既对立,又统一,两者同时进行,不可分割。化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O(二)从化合价升降角度分析:化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) H2O + C === H2 + CO[定义]有元素化合价升降的化学反应称为氧化还原反应[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。练习:下列反应中属于氧化还原反应的是( )
A. CaO + H2O == Ca(OH)2
B. 2KMnO4 == K2MnO4 + MnO2 + O2↑
3Fe + 2O2 == Fe3O4
CaCO3 == CaO + CO2
初、高中概念对比课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。下列反应既属于化合反应,又属于氧化还原反应的是( )
A SO3+H2O==H2SO4
B 2FeCl2+Cl2==2FeCl3
C CaO+H2O==Ca(OH)2
D 2Cu+O2+CO2+H2O==Cu2(OH)2CO3B、D化合价升降的原因: 电子的得失(三)从电子得失角度分析:失去e-失去e-后得到e-后Na+[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。化合价升降的原因:共用电子对的偏移H Cl在反应中失去和得到电子的物质如何定义?判断以下反应是否为氧化还原反应,如果是,
请标示出化合价的变化CuSO4+2NaOH==Cu(OH)2+Na2SO4
2FeCl2+Cl2==2FeCl3
Cu+2H2SO4==CuSO4+SO2 ↑ + 2H2O
2KClO3==2KCl+3O2 ↑指出氧化剂和还原剂
