人教版高中化学必修一2.3氧化还原反应(第1课时课件2)(共16张PPT)
文档属性
| 名称 | 人教版高中化学必修一2.3氧化还原反应(第1课时课件2)(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 451.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 00:00:00 | ||
图片预览





文档简介
课件16张PPT。【知识回顾】得到氧,被氧化失去氧,被还原一、氧化还原反应1、从得氧、失氧分析 得到氧,被氧化 失去氧,被还原 氧化还原反应:
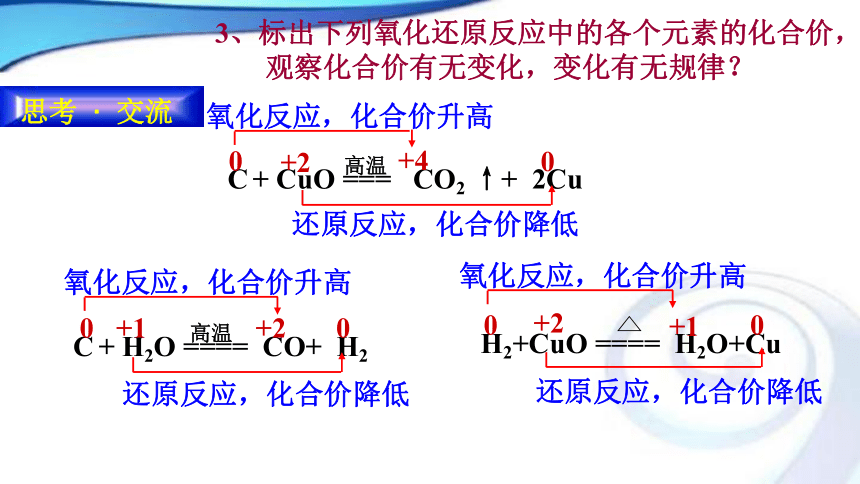
一种物质被氧化,同时另一种物质被还原的反应。 第三节 氧化还原反应3、标出下列氧化还原反应中的各个元素的化合价,
观察化合价有无变化,变化有无规律?4、氧化还原反应是否一定存在得失氧?
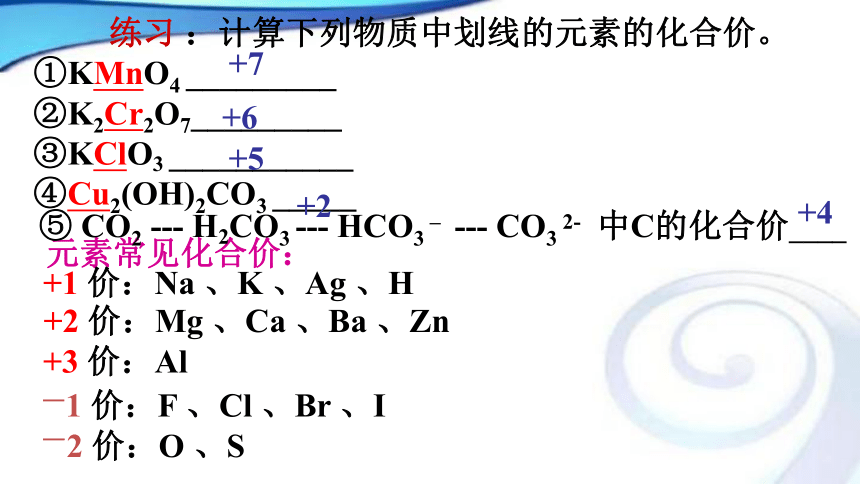
请分析下面的反应。2、从化合价升降分析氧化还原反应:有元素化合价升降的化学反应。 (表观特征)氧化还原反应的判断依据是: 有无化合价的升降 练习 :计算下列物质中划线的元素的化合价。
①KMnO4 _________
②K2Cr2O7_________
③KClO3 ___________
④Cu2(OH)2CO3 _____+7+6+2+5元素常见化合价:+1 价:Na 、K 、Ag 、H+2 价:Mg 、Ca 、Ba 、Zn+3 价:Al⑤ CO2 --- H2CO3 --- HCO3 – --- CO3 2- 中C的化合价____
+4化合反应分解反应化合反应置换反应分解反应复分解反应是是是是答案:A、B、D、H 课堂练习总结:氧化还原反应与四种基本类型反应的关系 注意:有单质参加的化合反应和有单质生成的分解反应
全部属于氧化还原反应。氧化还原反应非氧化还原反应复分解反应置换反应化合反应分解反应表观特征有得氧、失氧的反应有化合价升降的反应 氧化还原反应:? 化合价的升降与什么有关系,氧化还原反应
的实质是什么?0+10-1 化合价变化本质原因的分析: 化合价的升降
——电子的得失 2Na + Cl2======= 2NaCl还原反应(化合价降低)的实质
是原子得到电子的过程。氧化反应(化合价升高)的实质
是原子失去电子的过程。
H2 + Cl2 === 2 H Cl00+1-1氧化反应(化合价升高)的实质
是电子对的偏离。还原反应(化合价降低)的实质
是电子对的偏向。HCl 的形成过程化合价升降的原因:电子的偏移H Cl0+10-1 失去电子,化合价升高,被氧化 得电子,化合价降低,被还原 H2 + Cl2 === 2HCl 点燃0+10-1 电子对偏离,化合价升高,被氧化 电子对偏向,化合价降低,被还原 电子的转移(得失或偏移)是化合价变化的实质,
也是氧化还原反应发生的实质。 3、从电子转移(得失或偏移)分析 氧化还原反应:有电子转移(得失或偏移)的反应。 氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。 实质表观特征有得氧、失氧的反应有化合价升降的反应 有电子转移的反应 氧化还原反应的判据:有无化合价的升降。氧化还原反应的定义:
复习本节学习内容;
《创新设计》P28 第一课时
3. 熟练常见元素的化合价
课后作业课件16张PPT。【知识回顾】得到氧,被氧化失去氧,被还原一、氧化还原反应1、从得氧、失氧分析 得到氧,被氧化 失去氧,被还原 氧化还原反应:
一种物质被氧化,同时另一种物质被还原的反应。 第三节 氧化还原反应3、标出下列氧化还原反应中的各个元素的化合价,
观察化合价有无变化,变化有无规律?4、氧化还原反应是否一定存在得失氧?
请分析下面的反应。2、从化合价升降分析氧化还原反应:有元素化合价升降的化学反应。 (表观特征)氧化还原反应的判断依据是: 有无化合价的升降 练习 :计算下列物质中划线的元素的化合价。
①KMnO4 _________
②K2Cr2O7_________
③KClO3 ___________
④Cu2(OH)2CO3 _____+7+6+2+5元素常见化合价:+1 价:Na 、K 、Ag 、H+2 价:Mg 、Ca 、Ba 、Zn+3 价:Al⑤ CO2 --- H2CO3 --- HCO3 – --- CO3 2- 中C的化合价____
+4化合反应分解反应化合反应置换反应分解反应复分解反应是是是是答案:A、B、D、H 课堂练习总结:氧化还原反应与四种基本类型反应的关系 注意:有单质参加的化合反应和有单质生成的分解反应
全部属于氧化还原反应。氧化还原反应非氧化还原反应复分解反应置换反应化合反应分解反应表观特征有得氧、失氧的反应有化合价升降的反应 氧化还原反应:? 化合价的升降与什么有关系,氧化还原反应
的实质是什么?0+10-1 化合价变化本质原因的分析: 化合价的升降
——电子的得失 2Na + Cl2======= 2NaCl还原反应(化合价降低)的实质
是原子得到电子的过程。氧化反应(化合价升高)的实质
是原子失去电子的过程。
H2 + Cl2 === 2 H Cl00+1-1氧化反应(化合价升高)的实质
是电子对的偏离。还原反应(化合价降低)的实质
是电子对的偏向。HCl 的形成过程化合价升降的原因:电子的偏移H Cl0+10-1 失去电子,化合价升高,被氧化 得电子,化合价降低,被还原 H2 + Cl2 === 2HCl 点燃0+10-1 电子对偏离,化合价升高,被氧化 电子对偏向,化合价降低,被还原 电子的转移(得失或偏移)是化合价变化的实质,
也是氧化还原反应发生的实质。 3、从电子转移(得失或偏移)分析 氧化还原反应:有电子转移(得失或偏移)的反应。 氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。 实质表观特征有得氧、失氧的反应有化合价升降的反应 有电子转移的反应 氧化还原反应的判据:有无化合价的升降。氧化还原反应的定义:
复习本节学习内容;
《创新设计》P28 第一课时
3. 熟练常见元素的化合价
课后作业
一种物质被氧化,同时另一种物质被还原的反应。 第三节 氧化还原反应3、标出下列氧化还原反应中的各个元素的化合价,
观察化合价有无变化,变化有无规律?4、氧化还原反应是否一定存在得失氧?
请分析下面的反应。2、从化合价升降分析氧化还原反应:有元素化合价升降的化学反应。 (表观特征)氧化还原反应的判断依据是: 有无化合价的升降 练习 :计算下列物质中划线的元素的化合价。
①KMnO4 _________
②K2Cr2O7_________
③KClO3 ___________
④Cu2(OH)2CO3 _____+7+6+2+5元素常见化合价:+1 价:Na 、K 、Ag 、H+2 价:Mg 、Ca 、Ba 、Zn+3 价:Al⑤ CO2 --- H2CO3 --- HCO3 – --- CO3 2- 中C的化合价____
+4化合反应分解反应化合反应置换反应分解反应复分解反应是是是是答案:A、B、D、H 课堂练习总结:氧化还原反应与四种基本类型反应的关系 注意:有单质参加的化合反应和有单质生成的分解反应
全部属于氧化还原反应。氧化还原反应非氧化还原反应复分解反应置换反应化合反应分解反应表观特征有得氧、失氧的反应有化合价升降的反应 氧化还原反应:? 化合价的升降与什么有关系,氧化还原反应
的实质是什么?0+10-1 化合价变化本质原因的分析: 化合价的升降
——电子的得失 2Na + Cl2======= 2NaCl还原反应(化合价降低)的实质
是原子得到电子的过程。氧化反应(化合价升高)的实质
是原子失去电子的过程。
H2 + Cl2 === 2 H Cl00+1-1氧化反应(化合价升高)的实质
是电子对的偏离。还原反应(化合价降低)的实质
是电子对的偏向。HCl 的形成过程化合价升降的原因:电子的偏移H Cl0+10-1 失去电子,化合价升高,被氧化 得电子,化合价降低,被还原 H2 + Cl2 === 2HCl 点燃0+10-1 电子对偏离,化合价升高,被氧化 电子对偏向,化合价降低,被还原 电子的转移(得失或偏移)是化合价变化的实质,
也是氧化还原反应发生的实质。 3、从电子转移(得失或偏移)分析 氧化还原反应:有电子转移(得失或偏移)的反应。 氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。 实质表观特征有得氧、失氧的反应有化合价升降的反应 有电子转移的反应 氧化还原反应的判据:有无化合价的升降。氧化还原反应的定义:
复习本节学习内容;
《创新设计》P28 第一课时
3. 熟练常见元素的化合价
课后作业课件16张PPT。【知识回顾】得到氧,被氧化失去氧,被还原一、氧化还原反应1、从得氧、失氧分析 得到氧,被氧化 失去氧,被还原 氧化还原反应:
一种物质被氧化,同时另一种物质被还原的反应。 第三节 氧化还原反应3、标出下列氧化还原反应中的各个元素的化合价,
观察化合价有无变化,变化有无规律?4、氧化还原反应是否一定存在得失氧?
请分析下面的反应。2、从化合价升降分析氧化还原反应:有元素化合价升降的化学反应。 (表观特征)氧化还原反应的判断依据是: 有无化合价的升降 练习 :计算下列物质中划线的元素的化合价。
①KMnO4 _________
②K2Cr2O7_________
③KClO3 ___________
④Cu2(OH)2CO3 _____+7+6+2+5元素常见化合价:+1 价:Na 、K 、Ag 、H+2 价:Mg 、Ca 、Ba 、Zn+3 价:Al⑤ CO2 --- H2CO3 --- HCO3 – --- CO3 2- 中C的化合价____
+4化合反应分解反应化合反应置换反应分解反应复分解反应是是是是答案:A、B、D、H 课堂练习总结:氧化还原反应与四种基本类型反应的关系 注意:有单质参加的化合反应和有单质生成的分解反应
全部属于氧化还原反应。氧化还原反应非氧化还原反应复分解反应置换反应化合反应分解反应表观特征有得氧、失氧的反应有化合价升降的反应 氧化还原反应:? 化合价的升降与什么有关系,氧化还原反应
的实质是什么?0+10-1 化合价变化本质原因的分析: 化合价的升降
——电子的得失 2Na + Cl2======= 2NaCl还原反应(化合价降低)的实质
是原子得到电子的过程。氧化反应(化合价升高)的实质
是原子失去电子的过程。
H2 + Cl2 === 2 H Cl00+1-1氧化反应(化合价升高)的实质
是电子对的偏离。还原反应(化合价降低)的实质
是电子对的偏向。HCl 的形成过程化合价升降的原因:电子的偏移H Cl0+10-1 失去电子,化合价升高,被氧化 得电子,化合价降低,被还原 H2 + Cl2 === 2HCl 点燃0+10-1 电子对偏离,化合价升高,被氧化 电子对偏向,化合价降低,被还原 电子的转移(得失或偏移)是化合价变化的实质,
也是氧化还原反应发生的实质。 3、从电子转移(得失或偏移)分析 氧化还原反应:有电子转移(得失或偏移)的反应。 氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。 实质表观特征有得氧、失氧的反应有化合价升降的反应 有电子转移的反应 氧化还原反应的判据:有无化合价的升降。氧化还原反应的定义:
复习本节学习内容;
《创新设计》P28 第一课时
3. 熟练常见元素的化合价
课后作业
