人教版高中化学选修四3-2-3酸碱中和滴定(课件)(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修四3-2-3酸碱中和滴定(课件)(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 212.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 00:00:00 | ||
图片预览








文档简介
课件23张PPT。第2节 水的电离和溶液的酸碱性
第3课时 酸碱中和滴定第三章 水溶液中的离子平衡【思考】
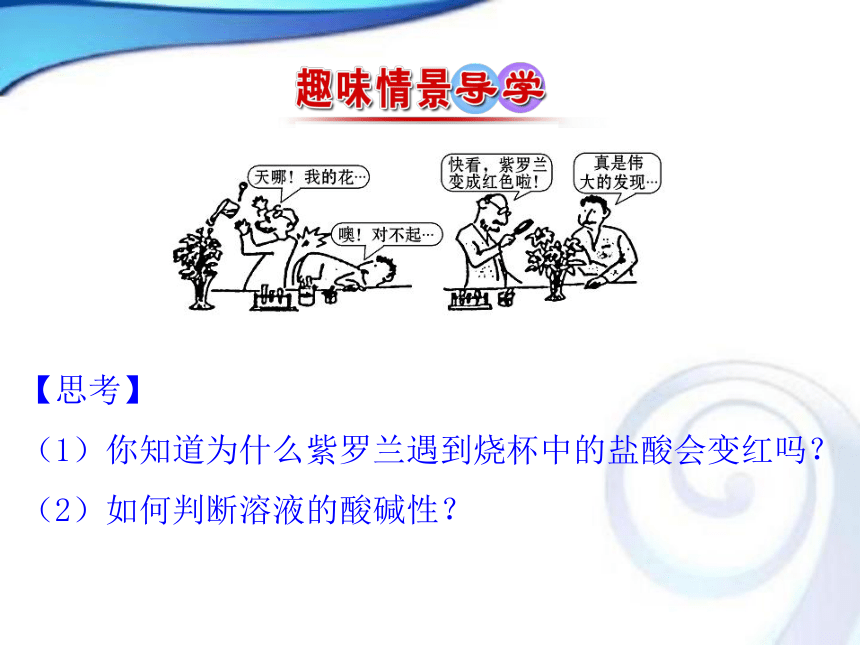
(1)你知道为什么紫罗兰遇到烧杯中的盐酸会变红吗?
(2)如何判断溶液的酸碱性?学习目标1.理解酸碱中和滴定的原理。
2.掌握有关酸碱中和滴定的实验及相关计算。
3.理解滴定分析实验的关键所在及其解决方法学习重点酸碱中和滴定的原理和滴定分析实验的关键所
在及其解决方法学习难点酸碱中和滴定的计算依据及有关计算及误差分析一、酸碱中和滴定1、定义:用已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法 2、原理:在酸碱中和反应中,使用一种已知物质的量浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。 3、公式:4、实验的关键:(1)准确测量参加反应的两种溶液的体积(2)准确判断中和反应是否恰好完全反应c酸v酸=c碱v碱(一元酸和一元碱)5、实验仪器及试剂: 仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、滴定管夹、烧杯、白纸,有时还需要移液管试剂:标准液、待测液、指示剂2、酸碱指示剂:一般是有机弱酸或有机弱碱(定性测定) 对应溶液
的 颜 色变色范围
红3.1橙4.4黄酚酞溶液红5 紫 8蓝
1、原则:1)终点时,指示剂的颜色变化明显2)变色范围越窄越好,对溶液的酸碱性变化较灵敏二、指示剂的选择:(1)甲基橙和酚酞的变色范围较小:4.4-3.1=1.3 10-8=2 对溶液的酸碱性变化较灵敏(2)溶液使指示剂改变颜色,发生的化学变化。指示剂滴加太多比将消耗一部分酸碱溶液(一般为1~2滴)。
(3)操作:用镊子取一小块pH试纸放在洁净的表面皿或玻璃片上,然后用玻璃棒沾取少量待测液点在试纸中央,试纸显色后再与标准比色卡比较,即知溶液的pH值。3、pH试纸(定量测定)(1)成分:含有多种指示剂(2)本身颜色:淡黄色(1)强酸强碱间的滴定:(2)强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,酸性选用甲基橙作指示剂(3)强碱滴定弱酸4、酸碱中和滴定中指示剂的选择: 两者正好完全反应,生成强碱弱酸盐,碱性选用酚酞作指示剂酚酞溶液、甲基橙三、实验步骤 1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;2、洗涤:用水洗净后,各用少量待装液润洗滴定管2-3次;3、装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2-3cm4、赶气泡:酸式滴定管:快速放液碱式滴定管:橡皮管向上翘起5、调液:调节滴定管中液面高度,并记下读数,记做。6、取液:(1)从碱式滴定管中放出25.00ml氢氧化钠溶液于锥形瓶中(2)滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。7、滴定:左手_____________________________,右手
________________________________________________
眼睛_______________________________________
控制酸式滴定管活塞拿住锥形瓶瓶颈,边滴入盐酸,边不断顺时针方向摇动,要始终注视锥形瓶溶液的颜色变化。9、计算:整理数据进行计算。8、记录:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。五、误差分析例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 ( )
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 ( )
3、滴定管尖嘴处有气泡,滴定后气泡消失( )
4、滴定操作时,有少量盐酸滴于锥形瓶外( )
5、滴定前仰视刻度,滴定后俯视刻度( )
偏高偏高偏高偏高偏低交流研讨滴定前仰视,滴定后俯视。分析:V标偏小,导致C测偏小。滴定前俯视,滴定后仰视。分析:V标偏大,导致C测偏大。二、锥形瓶
6、锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗 2-3次,将润洗液倒掉,再装NaOH溶液( )
7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液( )
8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。( )
9、指示剂滴加过多( )
偏高无影响偏低偏低交流研讨三、碱式滴定管
10、碱式滴定管用水洗后,未用待测液润洗 ( )
11、取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液( )
偏低偏低 交流研讨四、含杂质
12、在配制待测氢氧化钠溶液过程中,称取一定质量的氢氧化钠时,内含少量的氢氧化钾,用标准盐酸溶液进行滴定。( )
13、同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何( )
偏低偏低交流研讨1.用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液,下列操作会导致测定结果偏高的是( )
A.用标准的盐酸溶液润洗酸式滴定管2~3次
B.用待测碱液润洗碱式滴定管2~3次
C.用待测碱液润洗锥形瓶2~3次
D.用蒸馏水洗涤锥形瓶2~3次C当堂检测2. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用
0.100 0 mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小B当堂检测3.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调整液面,记下开始读数为V1;
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2。
当堂检测就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写) → → →D→ 。
(2)观察滴定管里液面的高度时应注意:? 。
(3)D步骤的操作中液面应调节到? ,尖嘴部分应 。
(4)该烧碱样品纯度的计算式为? 。
当堂检测答案:(1)C A B E (2)平视凹液面的最低点
(3)“0”或“0”刻度以下某一刻度 充满液体无气泡
(4) ×100%人生的途程是遥远的,只要双脚不息地前行,道路就会向远方延伸。
(1)你知道为什么紫罗兰遇到烧杯中的盐酸会变红吗?
(2)如何判断溶液的酸碱性?学习目标1.理解酸碱中和滴定的原理。
2.掌握有关酸碱中和滴定的实验及相关计算。
3.理解滴定分析实验的关键所在及其解决方法学习重点酸碱中和滴定的原理和滴定分析实验的关键所
在及其解决方法学习难点酸碱中和滴定的计算依据及有关计算及误差分析一、酸碱中和滴定1、定义:用已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法 2、原理:在酸碱中和反应中,使用一种已知物质的量浓度的酸或碱溶液跟未知浓度的碱或酸溶液完全中和,测出二者的体积,根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱或酸的溶液浓度。 3、公式:4、实验的关键:(1)准确测量参加反应的两种溶液的体积(2)准确判断中和反应是否恰好完全反应c酸v酸=c碱v碱(一元酸和一元碱)5、实验仪器及试剂: 仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、滴定管夹、烧杯、白纸,有时还需要移液管试剂:标准液、待测液、指示剂2、酸碱指示剂:一般是有机弱酸或有机弱碱(定性测定) 对应溶液
的 颜 色变色范围
红3.1橙4.4黄酚酞溶液红5 紫 8蓝
1、原则:1)终点时,指示剂的颜色变化明显2)变色范围越窄越好,对溶液的酸碱性变化较灵敏二、指示剂的选择:(1)甲基橙和酚酞的变色范围较小:4.4-3.1=1.3 10-8=2 对溶液的酸碱性变化较灵敏(2)溶液使指示剂改变颜色,发生的化学变化。指示剂滴加太多比将消耗一部分酸碱溶液(一般为1~2滴)。
(3)操作:用镊子取一小块pH试纸放在洁净的表面皿或玻璃片上,然后用玻璃棒沾取少量待测液点在试纸中央,试纸显色后再与标准比色卡比较,即知溶液的pH值。3、pH试纸(定量测定)(1)成分:含有多种指示剂(2)本身颜色:淡黄色(1)强酸强碱间的滴定:(2)强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,酸性选用甲基橙作指示剂(3)强碱滴定弱酸4、酸碱中和滴定中指示剂的选择: 两者正好完全反应,生成强碱弱酸盐,碱性选用酚酞作指示剂酚酞溶液、甲基橙三、实验步骤 1、查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活;2、洗涤:用水洗净后,各用少量待装液润洗滴定管2-3次;3、装液:用倾倒法将盐酸、氢氧化钠溶液注入酸、碱滴定管中,使液面高于刻度2-3cm4、赶气泡:酸式滴定管:快速放液碱式滴定管:橡皮管向上翘起5、调液:调节滴定管中液面高度,并记下读数,记做。6、取液:(1)从碱式滴定管中放出25.00ml氢氧化钠溶液于锥形瓶中(2)滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。7、滴定:左手_____________________________,右手
________________________________________________
眼睛_______________________________________
控制酸式滴定管活塞拿住锥形瓶瓶颈,边滴入盐酸,边不断顺时针方向摇动,要始终注视锥形瓶溶液的颜色变化。9、计算:整理数据进行计算。8、记录:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。五、误差分析例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 ( )
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 ( )
3、滴定管尖嘴处有气泡,滴定后气泡消失( )
4、滴定操作时,有少量盐酸滴于锥形瓶外( )
5、滴定前仰视刻度,滴定后俯视刻度( )
偏高偏高偏高偏高偏低交流研讨滴定前仰视,滴定后俯视。分析:V标偏小,导致C测偏小。滴定前俯视,滴定后仰视。分析:V标偏大,导致C测偏大。二、锥形瓶
6、锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗 2-3次,将润洗液倒掉,再装NaOH溶液( )
7、锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液( )
8、滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分。( )
9、指示剂滴加过多( )
偏高无影响偏低偏低交流研讨三、碱式滴定管
10、碱式滴定管用水洗后,未用待测液润洗 ( )
11、取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液( )
偏低偏低 交流研讨四、含杂质
12、在配制待测氢氧化钠溶液过程中,称取一定质量的氢氧化钠时,内含少量的氢氧化钾,用标准盐酸溶液进行滴定。( )
13、同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何( )
偏低偏低交流研讨1.用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液,下列操作会导致测定结果偏高的是( )
A.用标准的盐酸溶液润洗酸式滴定管2~3次
B.用待测碱液润洗碱式滴定管2~3次
C.用待测碱液润洗锥形瓶2~3次
D.用蒸馏水洗涤锥形瓶2~3次C当堂检测2. 准确移取20.00 mL某待测HCl溶液于锥形瓶中,用
0.100 0 mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小B当堂检测3.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C.在天平上准确称取烧碱样品mg,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调整液面,记下开始读数为V1;
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2。
当堂检测就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写) → → →D→ 。
(2)观察滴定管里液面的高度时应注意:? 。
(3)D步骤的操作中液面应调节到? ,尖嘴部分应 。
(4)该烧碱样品纯度的计算式为? 。
当堂检测答案:(1)C A B E (2)平视凹液面的最低点
(3)“0”或“0”刻度以下某一刻度 充满液体无气泡
(4) ×100%人生的途程是遥远的,只要双脚不息地前行,道路就会向远方延伸。
