人教版高中化学选修四3-3-1盐类水解的实质与规律(课件)(共21张PPT)
文档属性
| 名称 | 人教版高中化学选修四3-3-1盐类水解的实质与规律(课件)(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 290.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-29 14:44:15 | ||
图片预览






文档简介
课件21张PPT。第3节 盐类的水解 第1课时 盐类水解的实质与规律第三章 水溶液中的离子平衡纯碱(Na2CO3)被誉为“无机化工之母”,侯德榜发明的侯氏制碱法对世界制碱工业做出了贡献。为什么纯碱叫碱却是盐呢?纯碱与碱性有何关系?学习目标1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,进一步探究盐溶液呈现不同酸碱性的原因,总结其规律。
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写学习重点盐类水解的实质及规律学习难点盐类水解的实质及规律[实验]用pH试纸检验下列溶液的酸碱性
(1) Na2CO3 (2) NH4Cl
(3) NaCl (4) CH3COONa
(5) Al2(SO4)3 (6)KNO3
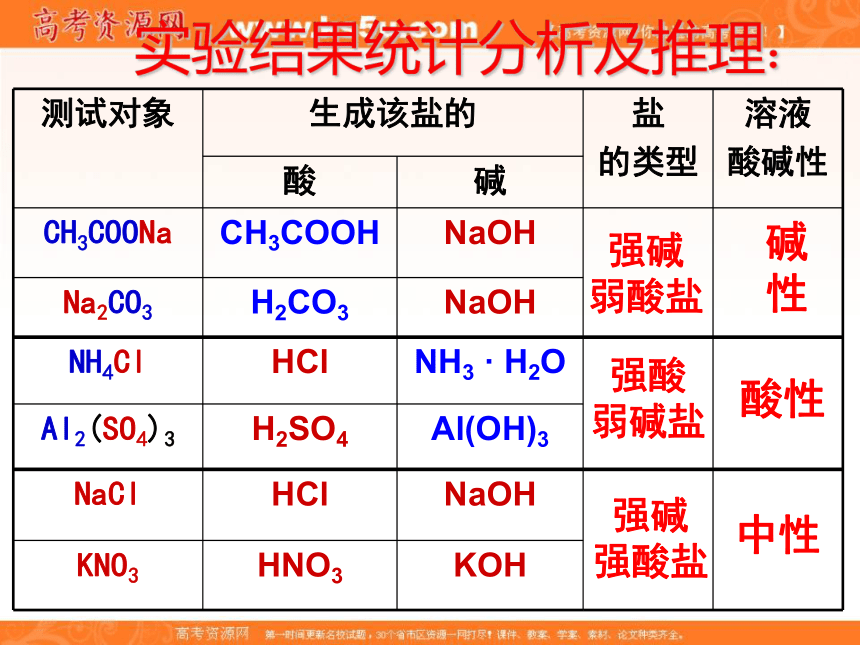
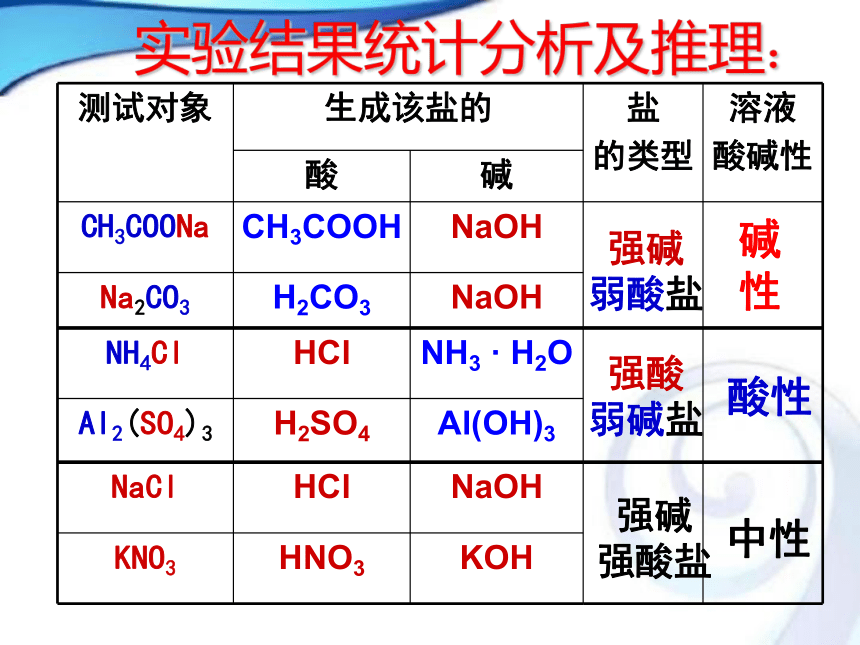
(7) (NH4)2SO4 (8) Na2SO4 一、探究盐溶液的酸碱性NaCl 、KNO3、Na2SO4溶液:实验结果:CH3COONa 、Na2CO3 溶液:NH4Cl 、Al2(SO4)3 溶液:显碱性显酸性显中性强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
强酸盐中性实验结果统计分析及推理:实验结果统计分析及推理:强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
强酸盐中性【问题1】同样为盐溶液,Na2CO3、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系? 【问题2】OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的,即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况呢?
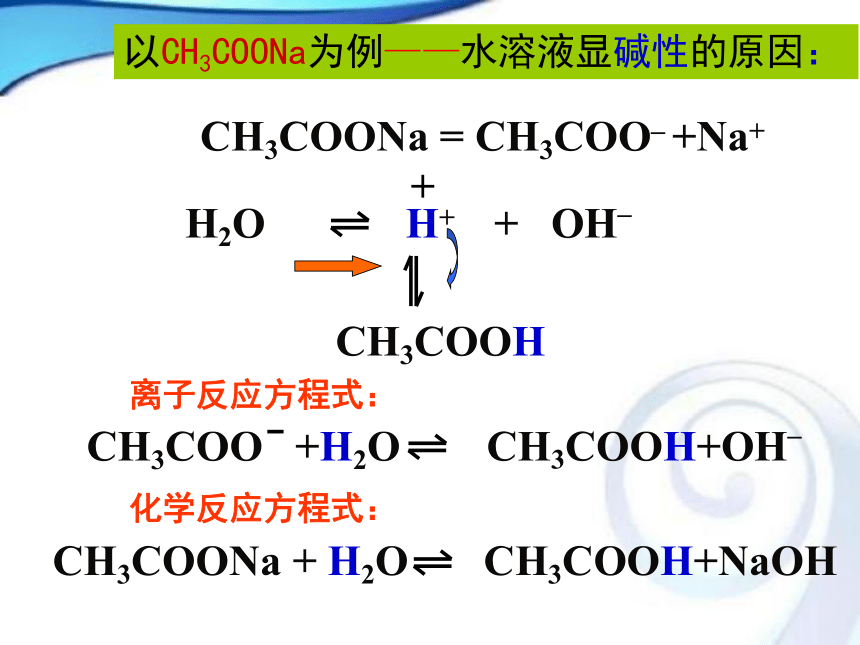
【问题3】溶液中盐的离子是不是都参与了反应?具有什么样条件的离子才能反应,反应造成的结果是什么?二、盐溶液呈现不同酸碱性的原因H2O H+ + OH_
CH3COONa = CH3COO_ +Na+
+ CH3COOH CH3COO +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOH以CH3COONa为例——水溶液显碱性的原因:离子反应方程式:化学反应方程式: NH4Cl = NH4+ + Cl-
+
H2O OH- +H+
NH3.H2O
NH4+ +H2O NH3.H2O + H+
NH4Cl +H2O NH3.H2O + HCl 离子反应方程式:化学反应方程式:以NH4Cl为例——水溶液显酸性的原因:2、水解的实质3、水解反应与中和反应的关系:酸+碱 盐+水中和水解破坏了水的电离平衡(促进水的电离) 有弱才水解,无弱不水解;
谁强显谁性,同强显中性。1、盐类的水解 在溶液中盐电离出来的离子(弱酸根、弱碱根)跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。4、水解的酸碱性规律:1)先找“弱”离子。
2)一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
3)多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。盐 + 水 酸 + 碱弱离子 + 水 弱酸(or弱碱) + OH– ( or H+ ) 5、盐类水解方程式的书写:
1、Na2CO3溶液中存在哪些平衡?存在哪些离子、分子?
2、试分析下列物质溶于水时的酸碱性,写出对应的水解反应方程式(包括离子反应方程式)
FeCl3 :
CH3COONH4:交流研讨盐类水解方程式的书写:(一)一元弱酸强碱盐如:CH3COONa、NaF化学方程式:离子方程式:CH3COONa+H2O CH3COOH + NaOHCH3COO–+ H2O CH3COOH+OH–化学方程式:离子方程式:NaF + H2O HF + NaOHF– + H2O HF + OH–(二)多元弱酸强碱盐如:Na2CO3、 Na3PO4离子方程式:HCO3 – + H2O H2CO3 + OH –CO3 2– + H2O HCO3 – + OH –(主)(次)?(三)弱碱强酸盐水解如:NH4Cl、CuSO4、AlCl3水解的离子方程式:NH4+ + H2O NH3·H2O + H+Cu2+ + 2H2O Cu(OH)2 + 2H+Al 3+ + 3H2O Al(OH)3 + 3H+(四)弱酸弱碱盐水解如:CH3COONH4、(NH4)2CO3
1、写出下列物质的水解反应离子方程式:
Na2S
AlCl3
2、比较pH均为5的硫酸溶液与Fe2(SO4)3溶液中水电离出来的H+、OH—是否相同?
学以致用1.水解的定义和规律: 有弱才水解,越弱越水解,谁强显谁性。
2.水解离子方程式的书写: 一般用“ ”,不用“ ↑、↓” 多元弱酸根离子的水解分步写,一般只写第一步。归纳总结1.下列离子在水溶液中不会发生水解的是( )
A.NH4+ B.SO42_ C.Al3+ D.F_
2.氯化铵溶液中离子浓度从大到小排列正确的是( )
A.NH4+、H+、OH-、Cl_
B.Cl_、NH4+、H+、OH_
C.H+、Cl_、NH4+、OH_
D.Cl_、NH4+、OH-、H+BB当堂检测4.pH=2的醋酸与pH=12的NaOH溶液等体积混合所得溶液呈 性。完全中和后醋酸过量,混合溶液显酸性。酸3.有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的pH依次为9,10,8。则这三种弱酸的酸性由强到弱的顺序是( )
A.HA>HB>HC B.HB>HA>HC
C.HC>HB>HA D.HC>HA>HBD当堂检测5.对CH3COONa溶液分别改变以下条件后,水解平衡移动
的方向分别为:
①升高温度 _____ ②加水稀释 _____
③加CH3COOH ____ ④通入HCl _____
⑤加少量NaOH固体 _______
⑥加少量CH3COONa固体 _______
⑦加少量NH4Cl固体 _______ 逆向逆向正向正向正向正向正向当堂检测要铭记在心:每天都是一生中最美好的日子。
2.熟练掌握盐类水解的表示方法——水解离子方程式的书写学习重点盐类水解的实质及规律学习难点盐类水解的实质及规律[实验]用pH试纸检验下列溶液的酸碱性
(1) Na2CO3 (2) NH4Cl
(3) NaCl (4) CH3COONa
(5) Al2(SO4)3 (6)KNO3
(7) (NH4)2SO4 (8) Na2SO4 一、探究盐溶液的酸碱性NaCl 、KNO3、Na2SO4溶液:实验结果:CH3COONa 、Na2CO3 溶液:NH4Cl 、Al2(SO4)3 溶液:显碱性显酸性显中性强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
强酸盐中性实验结果统计分析及推理:实验结果统计分析及推理:强碱
弱酸盐碱性强酸
弱碱盐酸性强碱
强酸盐中性【问题1】同样为盐溶液,Na2CO3、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系? 【问题2】OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的,即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况呢?
【问题3】溶液中盐的离子是不是都参与了反应?具有什么样条件的离子才能反应,反应造成的结果是什么?二、盐溶液呈现不同酸碱性的原因H2O H+ + OH_
CH3COONa = CH3COO_ +Na+
+ CH3COOH CH3COO +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOH以CH3COONa为例——水溶液显碱性的原因:离子反应方程式:化学反应方程式: NH4Cl = NH4+ + Cl-
+
H2O OH- +H+
NH3.H2O
NH4+ +H2O NH3.H2O + H+
NH4Cl +H2O NH3.H2O + HCl 离子反应方程式:化学反应方程式:以NH4Cl为例——水溶液显酸性的原因:2、水解的实质3、水解反应与中和反应的关系:酸+碱 盐+水中和水解破坏了水的电离平衡(促进水的电离) 有弱才水解,无弱不水解;
谁强显谁性,同强显中性。1、盐类的水解 在溶液中盐电离出来的离子(弱酸根、弱碱根)跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。4、水解的酸碱性规律:1)先找“弱”离子。
2)一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
3)多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐的水解,常写成一步完成。盐 + 水 酸 + 碱弱离子 + 水 弱酸(or弱碱) + OH– ( or H+ ) 5、盐类水解方程式的书写:
1、Na2CO3溶液中存在哪些平衡?存在哪些离子、分子?
2、试分析下列物质溶于水时的酸碱性,写出对应的水解反应方程式(包括离子反应方程式)
FeCl3 :
CH3COONH4:交流研讨盐类水解方程式的书写:(一)一元弱酸强碱盐如:CH3COONa、NaF化学方程式:离子方程式:CH3COONa+H2O CH3COOH + NaOHCH3COO–+ H2O CH3COOH+OH–化学方程式:离子方程式:NaF + H2O HF + NaOHF– + H2O HF + OH–(二)多元弱酸强碱盐如:Na2CO3、 Na3PO4离子方程式:HCO3 – + H2O H2CO3 + OH –CO3 2– + H2O HCO3 – + OH –(主)(次)?(三)弱碱强酸盐水解如:NH4Cl、CuSO4、AlCl3水解的离子方程式:NH4+ + H2O NH3·H2O + H+Cu2+ + 2H2O Cu(OH)2 + 2H+Al 3+ + 3H2O Al(OH)3 + 3H+(四)弱酸弱碱盐水解如:CH3COONH4、(NH4)2CO3
1、写出下列物质的水解反应离子方程式:
Na2S
AlCl3
2、比较pH均为5的硫酸溶液与Fe2(SO4)3溶液中水电离出来的H+、OH—是否相同?
学以致用1.水解的定义和规律: 有弱才水解,越弱越水解,谁强显谁性。
2.水解离子方程式的书写: 一般用“ ”,不用“ ↑、↓” 多元弱酸根离子的水解分步写,一般只写第一步。归纳总结1.下列离子在水溶液中不会发生水解的是( )
A.NH4+ B.SO42_ C.Al3+ D.F_
2.氯化铵溶液中离子浓度从大到小排列正确的是( )
A.NH4+、H+、OH-、Cl_
B.Cl_、NH4+、H+、OH_
C.H+、Cl_、NH4+、OH_
D.Cl_、NH4+、OH-、H+BB当堂检测4.pH=2的醋酸与pH=12的NaOH溶液等体积混合所得溶液呈 性。完全中和后醋酸过量,混合溶液显酸性。酸3.有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的pH依次为9,10,8。则这三种弱酸的酸性由强到弱的顺序是( )
A.HA>HB>HC B.HB>HA>HC
C.HC>HB>HA D.HC>HA>HBD当堂检测5.对CH3COONa溶液分别改变以下条件后,水解平衡移动
的方向分别为:
①升高温度 _____ ②加水稀释 _____
③加CH3COOH ____ ④通入HCl _____
⑤加少量NaOH固体 _______
⑥加少量CH3COONa固体 _______
⑦加少量NH4Cl固体 _______ 逆向逆向正向正向正向正向正向当堂检测要铭记在心:每天都是一生中最美好的日子。
