探索酸的性质[上学期]
图片预览







文档简介
课件38张PPT。第2节 探索酸的性质胃液、食醋、柠檬、葡萄、柑橘等是酸的,其中含有一类特殊物质——酸。说一说:
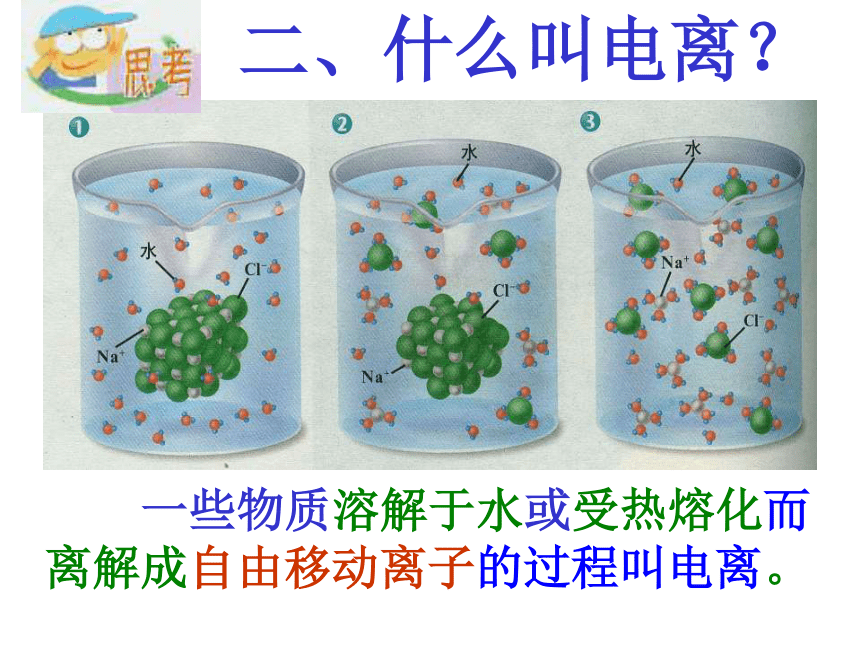
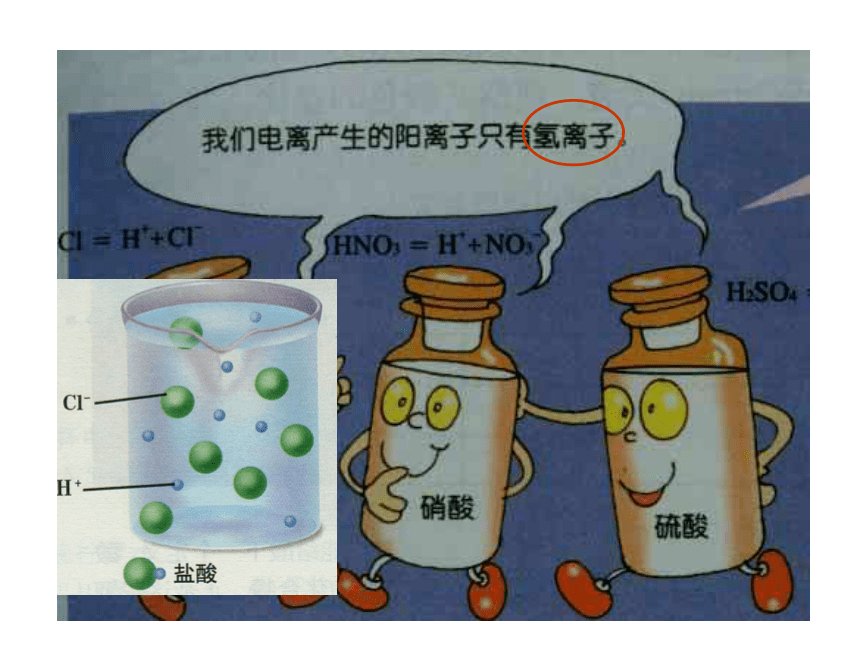
生活中有哪些东西是酸的? 一、什么是酸?二、什么叫电离? 一些物质溶解于水或受热熔化而离解成自由移动离子的过程叫电离。酸的涵义:什么是酸?电离时产生的阳离子
只有氢离子的化合物
盐酸:
硝酸:
硫酸:HCl = H + + Cl-电离方程式:H NO3 = H + + NO3-H2SO4 = 2H + + SO 42-
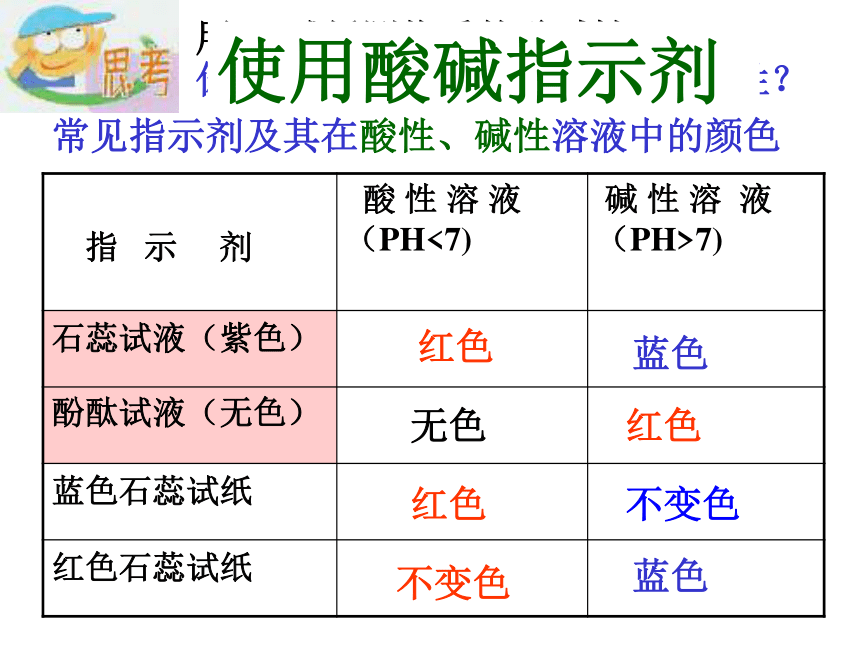
电离通式:酸= H+ + 酸根阴离子酸根离子所带的负电荷的总数等于酸分子电离时生成的氢离子的总数。常见指示剂及其在酸性、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色用pH试纸测物质的酸碱性,
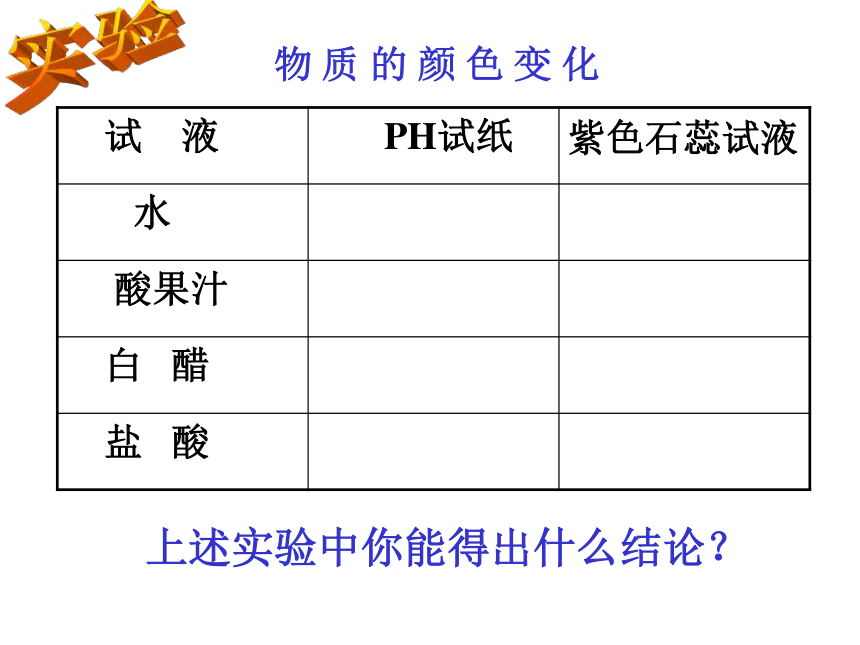
你还有什么方法测定物质的酸碱性?使用酸碱指示剂实验物 质 的 颜 色 变 化上述实验中你能得出什么结论? pH试纸能显示酸性的强弱,而酸碱指示剂则只能指示溶液是否显酸性。结论阅读P8自制酸碱指示剂1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、Hl E、H2S?
2、用简单的方法区别水和硫酸,并写出实验步骤
3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?
B法一:用玻璃棒分别蘸取少许水、硫酸,滴在pH试纸中部,观察试纸颜色不变的是水,会变的是硫酸。
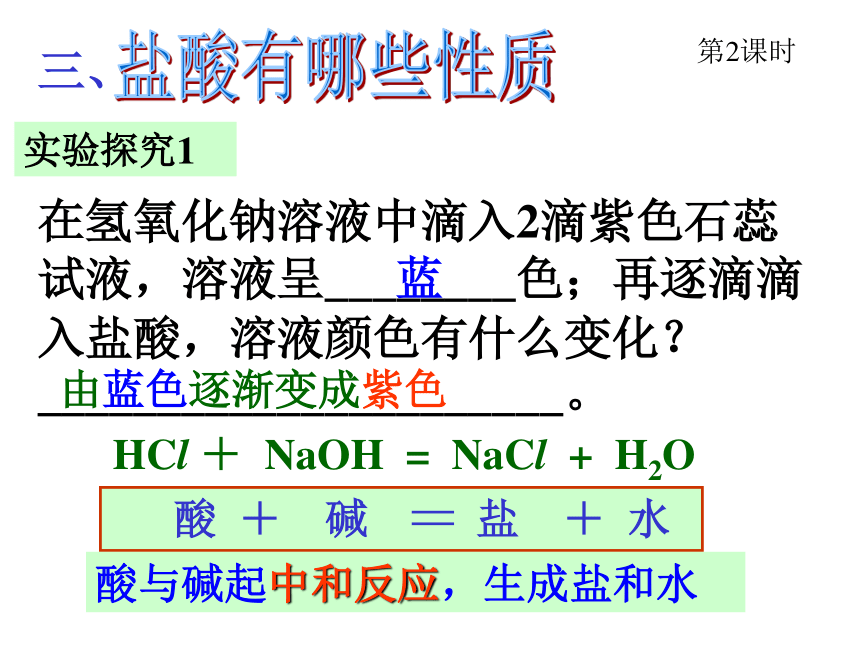
法二:在小试管里分别用胶头滴管滴入几滴水、硫酸,再滴加2-3滴紫色石蕊试液,观察其颜色不变的是水,变红的是硫酸。三、在氢氧化钠溶液中滴入2滴紫色石蕊试液,溶液呈________色;再逐滴滴入盐酸,溶液颜色有什么变化?______________________。蓝由蓝色逐渐变成紫色 HCl + NaOH = NaCl + H2O 酸 + 碱 〓 盐 + 水 实验探究1第2课时盐酸有哪些性质酸与碱起中和反应,生成盐和水思考 胃酸过多的病人常服用一种叫“胃舒平”的药片来治疗,药片的主要成份是氢氧化铝,为什么能用它来治疗胃酸过多呢? 3 HCl + Al(OH)3 〓 AlCl3 + 3H2O 请用化学方程式表示: 酸 + 碱 〓 盐 + 水 实验探究2 a、把鸡蛋壳放入盛有盐酸的试管中,将燃着的火柴伸入试管口,你看到什么现象?
_________________________________.蛋壳表面产生气泡,燃着的木条伸入后会熄灭 2HCl + CaCO3 = CaCl2 + H2O + CO2 ↑ 酸 + 盐 = 新盐 + 新酸b、碳酸钠和盐酸的反应,产生的气体通过澄清石灰水,观察现象?HCl + Na2CO3 = NaCl + H2O + CO2 ↑ 酸 + 盐 = 新盐 + 新酸*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳)
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O在盛有少量稀盐酸的试管里滴几滴硝酸银溶液,发生了什么变化?
____________________________反应的化学方程式为:
HCl+AgNO3=AgCl↓+HNO3
由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
氯化银是不溶于水或酸的白色凝乳状的沉淀。所以硝酸银溶液可以用于检验盐酸或氯离子的存在。
生成白色沉淀。实验探究3 a、向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象?
______________________________________. 铁锈消失,溶液变成黄色 6HCl + Fe2O3 = 2FeCl3+3H2O 盐酸 +金属氧化物= 盐 + 水红棕色 黄色凡能跟酸起反应,生成盐和水的氧化物,叫碱性氧化物。金属氧化物大多是碱性氧化物。b、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCl + CuO = CuCl2 + H2O黑色 蓝色 由金属阳离子和酸根阴离子组成的化合物叫盐。几种盐的电离方程式Na2CO3=2Na+ + CO32-
MgSO4=Mg2+ + SO42-
BaCl2=Ba2+ + 2Cl-
NaCl=Na+ + Cl-电离通式:盐=金属阳离子+酸根阴离子 上述探究实验3中,除了铁锈消失外,还可以观察到什么现象?___________________ 探究实验4 铁钉表面产生气泡提出问题: 气体是否是盐酸和金属铁反应生成的?建立假设:____________________________.实验验证: 由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应,叫置换反应。 2HCl + Fe = FeCl2 + H2 ↑酸 +金属 = 盐 + 氢气谁来归纳一下,盐酸主要有哪些
化学性质,能跟哪些物质反应。小结1、 酸能使紫色的石蕊变红,无色酚酞不变色。2、 酸 + 碱 〓 盐 + 水 3、酸 + 盐 = 新盐 + 新酸4、 盐酸 +金属氧化物= 盐 + 水5、酸 +金属 = 盐 + 氢气三、硫酸有哪些性质?-H2SO4第3课时实验探究5 稀硫酸分别滴入盛有锌、氧化铁、氧化铜、氢氧化铜、氯化钡溶液的试管中,发现 :_____________________________。1、 Zn + H2SO4 = ZnSO4 + H2 ↑2、 Fe2O3 + H2SO4= Fe2(SO4)3+ H2 O3、CuO + H2SO4 =CuSO4+ H2 O4、Cu(OH)2 + H2SO4 = CuSO4 + H2 O5、BaCl2 + H2SO4 = BaSO4 ↓+ 2HCl你能说出硫酸有哪些性质?从盐酸、硫酸的实验中可以看到物质发生反应的证据有哪些?1、溶液颜色变化2、产生气体3、产生沉淀4、性质变化你能归纳出酸的一些共性吗?P12利用酸的性质做些什么?思考用于金属表面除锈,制造某些试剂和药物,如氯化锌、盐酸麻黄素等。人的胃液里含有少量的盐酸,可以帮助消化。硫酸用于生产化肥、农药、染料及冶炼有色金属、精炼石油等。硝酸还用于制造炸药。
1、下列物质中,能除去铁制品表面铁锈的是------( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液 2、写出下列方程式,并写出反应类型
反应类型
(1)Fe+H2SO4 == _____________; _________
(2)CuO+H2SO4==____________;_________
(3)2NaOH+H2SO4== _________;_________
(4)H2SO4+BaCl2== _________ ; _________
(5)HCl+AgNO3== ___________ ;_________ 酸的分类1、强酸: 盐酸 HCl
硝酸 HNO3
硫酸 H2SO4
2、弱酸: 醋酸 CH3COOH四、酸的个性 盐酸的个性2、观察盐酸的颜色和状态。
无色液体。
3、打开浓盐酸的瓶盖,观察瓶口发生的现象,并用手扇动,闻一下气味
瓶口出现白雾,为盐酸小液滴;
具有刺激性气味结论:观 察 浓盐酸具有挥发性盐酸(HCl)是氯化氢气体的水溶液。常用的浓盐酸含氯化氢的质量分数为37%-38%,密度为1.19克/厘米3 硫酸的个性 1、浓硫酸不容易挥发,是一种无色、粘稠、油状的液体。
常用的浓硫酸的质量分数为98%,密度为1.84克/厘米3。由于水的密度较小,水流进浓硫酸时浮在硫酸上面,溶解时放出的热会使立刻沸腾,使硫酸液滴向四周飞溅。物理性质:2、 稀释浓硫酸的实验
稀释浓硫酸时,一定要把浓硫酸沿着玻璃棒慢慢注入水中,并不断搅拌,使产生的热量迅速扩散。切不可把水倒进浓硫酸里!用手触摸烧杯外壁
烧杯壁很热。
结论:硫酸易容于水,溶解时放出大量的热。
3、用玻璃棒蘸取浓硫酸涂在火柴杆和滤纸上,过会儿观察变化火柴杆和滤纸上涂有硫酸部分都变成了黑色结论:浓硫酸具有强烈的脱水性,能使木材、纸张、衣服、皮肤等脱水碳化。如果将一瓶敞开的浓硫酸放置一段时间后,称一称就会发现质量增加了,为什么? 浓硫酸还具有强烈的吸水性,可以用来作氧气、氢气、二氧化碳等气体的干燥剂。如果浓硫酸不慎溅到皮肤上,怎么办?要先用干布拭去,然后用大量水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院2NaHCO3+H2SO4=Na2SO4 +2H2O+2CO2↑硫酸对皮肤或衣服有很强的腐蚀性什么是氧化反应?物质跟氧发生的反应叫氧化反应如:C+2H2SO4(浓) = CO2 ↑ +2SO2 ↑ +2H2O结论:浓硫酸有很强的氧化性?2Fe+ 6H2SO4(浓) =Fe2(SO4)3+3SO2 ↑ +6H2O?BaCl + H2SO4 = BaSO4 ↓+ 2HCl在盛有少量稀硫酸的试管里,滴入几滴氯化钡溶液,可观察到的现象:实 验产生白色沉淀再向试管里滴入几滴稀硝酸,白色沉淀不溶解SO42-的检验:利用上述反应可检验硫酸和其他能电离出SO42-的化合物。稀硝酸的个性:HNO3纯硝酸是无色、易挥发、有刺激性气味, 有强腐蚀性的液体常温下见光容易分解,受热时分解得更快。
4HNO3 = 2H2O+4NO2 ↑ +O2 ↑ 结论:硝酸具有不稳定性常把硝酸浓盛放在棕色玻璃瓶中,贮放在冷暗处光、热表2:碳酸钠与碳酸氢钠的比较再 见
生活中有哪些东西是酸的? 一、什么是酸?二、什么叫电离? 一些物质溶解于水或受热熔化而离解成自由移动离子的过程叫电离。酸的涵义:什么是酸?电离时产生的阳离子
只有氢离子的化合物
盐酸:
硝酸:
硫酸:HCl = H + + Cl-电离方程式:H NO3 = H + + NO3-H2SO4 = 2H + + SO 42-
电离通式:酸= H+ + 酸根阴离子酸根离子所带的负电荷的总数等于酸分子电离时生成的氢离子的总数。常见指示剂及其在酸性、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色用pH试纸测物质的酸碱性,
你还有什么方法测定物质的酸碱性?使用酸碱指示剂实验物 质 的 颜 色 变 化上述实验中你能得出什么结论? pH试纸能显示酸性的强弱,而酸碱指示剂则只能指示溶液是否显酸性。结论阅读P8自制酸碱指示剂1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、Hl E、H2S?
2、用简单的方法区别水和硫酸,并写出实验步骤
3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?
B法一:用玻璃棒分别蘸取少许水、硫酸,滴在pH试纸中部,观察试纸颜色不变的是水,会变的是硫酸。
法二:在小试管里分别用胶头滴管滴入几滴水、硫酸,再滴加2-3滴紫色石蕊试液,观察其颜色不变的是水,变红的是硫酸。三、在氢氧化钠溶液中滴入2滴紫色石蕊试液,溶液呈________色;再逐滴滴入盐酸,溶液颜色有什么变化?______________________。蓝由蓝色逐渐变成紫色 HCl + NaOH = NaCl + H2O 酸 + 碱 〓 盐 + 水 实验探究1第2课时盐酸有哪些性质酸与碱起中和反应,生成盐和水思考 胃酸过多的病人常服用一种叫“胃舒平”的药片来治疗,药片的主要成份是氢氧化铝,为什么能用它来治疗胃酸过多呢? 3 HCl + Al(OH)3 〓 AlCl3 + 3H2O 请用化学方程式表示: 酸 + 碱 〓 盐 + 水 实验探究2 a、把鸡蛋壳放入盛有盐酸的试管中,将燃着的火柴伸入试管口,你看到什么现象?
_________________________________.蛋壳表面产生气泡,燃着的木条伸入后会熄灭 2HCl + CaCO3 = CaCl2 + H2O + CO2 ↑ 酸 + 盐 = 新盐 + 新酸b、碳酸钠和盐酸的反应,产生的气体通过澄清石灰水,观察现象?HCl + Na2CO3 = NaCl + H2O + CO2 ↑ 酸 + 盐 = 新盐 + 新酸*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳)
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O在盛有少量稀盐酸的试管里滴几滴硝酸银溶液,发生了什么变化?
____________________________反应的化学方程式为:
HCl+AgNO3=AgCl↓+HNO3
由两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
氯化银是不溶于水或酸的白色凝乳状的沉淀。所以硝酸银溶液可以用于检验盐酸或氯离子的存在。
生成白色沉淀。实验探究3 a、向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象?
______________________________________. 铁锈消失,溶液变成黄色 6HCl + Fe2O3 = 2FeCl3+3H2O 盐酸 +金属氧化物= 盐 + 水红棕色 黄色凡能跟酸起反应,生成盐和水的氧化物,叫碱性氧化物。金属氧化物大多是碱性氧化物。b、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCl + CuO = CuCl2 + H2O黑色 蓝色 由金属阳离子和酸根阴离子组成的化合物叫盐。几种盐的电离方程式Na2CO3=2Na+ + CO32-
MgSO4=Mg2+ + SO42-
BaCl2=Ba2+ + 2Cl-
NaCl=Na+ + Cl-电离通式:盐=金属阳离子+酸根阴离子 上述探究实验3中,除了铁锈消失外,还可以观察到什么现象?___________________ 探究实验4 铁钉表面产生气泡提出问题: 气体是否是盐酸和金属铁反应生成的?建立假设:____________________________.实验验证: 由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应,叫置换反应。 2HCl + Fe = FeCl2 + H2 ↑酸 +金属 = 盐 + 氢气谁来归纳一下,盐酸主要有哪些
化学性质,能跟哪些物质反应。小结1、 酸能使紫色的石蕊变红,无色酚酞不变色。2、 酸 + 碱 〓 盐 + 水 3、酸 + 盐 = 新盐 + 新酸4、 盐酸 +金属氧化物= 盐 + 水5、酸 +金属 = 盐 + 氢气三、硫酸有哪些性质?-H2SO4第3课时实验探究5 稀硫酸分别滴入盛有锌、氧化铁、氧化铜、氢氧化铜、氯化钡溶液的试管中,发现 :_____________________________。1、 Zn + H2SO4 = ZnSO4 + H2 ↑2、 Fe2O3 + H2SO4= Fe2(SO4)3+ H2 O3、CuO + H2SO4 =CuSO4+ H2 O4、Cu(OH)2 + H2SO4 = CuSO4 + H2 O5、BaCl2 + H2SO4 = BaSO4 ↓+ 2HCl你能说出硫酸有哪些性质?从盐酸、硫酸的实验中可以看到物质发生反应的证据有哪些?1、溶液颜色变化2、产生气体3、产生沉淀4、性质变化你能归纳出酸的一些共性吗?P12利用酸的性质做些什么?思考用于金属表面除锈,制造某些试剂和药物,如氯化锌、盐酸麻黄素等。人的胃液里含有少量的盐酸,可以帮助消化。硫酸用于生产化肥、农药、染料及冶炼有色金属、精炼石油等。硝酸还用于制造炸药。
1、下列物质中,能除去铁制品表面铁锈的是------( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液 2、写出下列方程式,并写出反应类型
反应类型
(1)Fe+H2SO4 == _____________; _________
(2)CuO+H2SO4==____________;_________
(3)2NaOH+H2SO4== _________;_________
(4)H2SO4+BaCl2== _________ ; _________
(5)HCl+AgNO3== ___________ ;_________ 酸的分类1、强酸: 盐酸 HCl
硝酸 HNO3
硫酸 H2SO4
2、弱酸: 醋酸 CH3COOH四、酸的个性 盐酸的个性2、观察盐酸的颜色和状态。
无色液体。
3、打开浓盐酸的瓶盖,观察瓶口发生的现象,并用手扇动,闻一下气味
瓶口出现白雾,为盐酸小液滴;
具有刺激性气味结论:观 察 浓盐酸具有挥发性盐酸(HCl)是氯化氢气体的水溶液。常用的浓盐酸含氯化氢的质量分数为37%-38%,密度为1.19克/厘米3 硫酸的个性 1、浓硫酸不容易挥发,是一种无色、粘稠、油状的液体。
常用的浓硫酸的质量分数为98%,密度为1.84克/厘米3。由于水的密度较小,水流进浓硫酸时浮在硫酸上面,溶解时放出的热会使立刻沸腾,使硫酸液滴向四周飞溅。物理性质:2、 稀释浓硫酸的实验
稀释浓硫酸时,一定要把浓硫酸沿着玻璃棒慢慢注入水中,并不断搅拌,使产生的热量迅速扩散。切不可把水倒进浓硫酸里!用手触摸烧杯外壁
烧杯壁很热。
结论:硫酸易容于水,溶解时放出大量的热。
3、用玻璃棒蘸取浓硫酸涂在火柴杆和滤纸上,过会儿观察变化火柴杆和滤纸上涂有硫酸部分都变成了黑色结论:浓硫酸具有强烈的脱水性,能使木材、纸张、衣服、皮肤等脱水碳化。如果将一瓶敞开的浓硫酸放置一段时间后,称一称就会发现质量增加了,为什么? 浓硫酸还具有强烈的吸水性,可以用来作氧气、氢气、二氧化碳等气体的干燥剂。如果浓硫酸不慎溅到皮肤上,怎么办?要先用干布拭去,然后用大量水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院2NaHCO3+H2SO4=Na2SO4 +2H2O+2CO2↑硫酸对皮肤或衣服有很强的腐蚀性什么是氧化反应?物质跟氧发生的反应叫氧化反应如:C+2H2SO4(浓) = CO2 ↑ +2SO2 ↑ +2H2O结论:浓硫酸有很强的氧化性?2Fe+ 6H2SO4(浓) =Fe2(SO4)3+3SO2 ↑ +6H2O?BaCl + H2SO4 = BaSO4 ↓+ 2HCl在盛有少量稀硫酸的试管里,滴入几滴氯化钡溶液,可观察到的现象:实 验产生白色沉淀再向试管里滴入几滴稀硝酸,白色沉淀不溶解SO42-的检验:利用上述反应可检验硫酸和其他能电离出SO42-的化合物。稀硝酸的个性:HNO3纯硝酸是无色、易挥发、有刺激性气味, 有强腐蚀性的液体常温下见光容易分解,受热时分解得更快。
4HNO3 = 2H2O+4NO2 ↑ +O2 ↑ 结论:硝酸具有不稳定性常把硝酸浓盛放在棕色玻璃瓶中,贮放在冷暗处光、热表2:碳酸钠与碳酸氢钠的比较再 见
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
