几种重要的盐[上学期]
图片预览







文档简介
课件28张PPT。第4节 几种重要的盐一、
什么是盐【考考你】认出酸和碱:
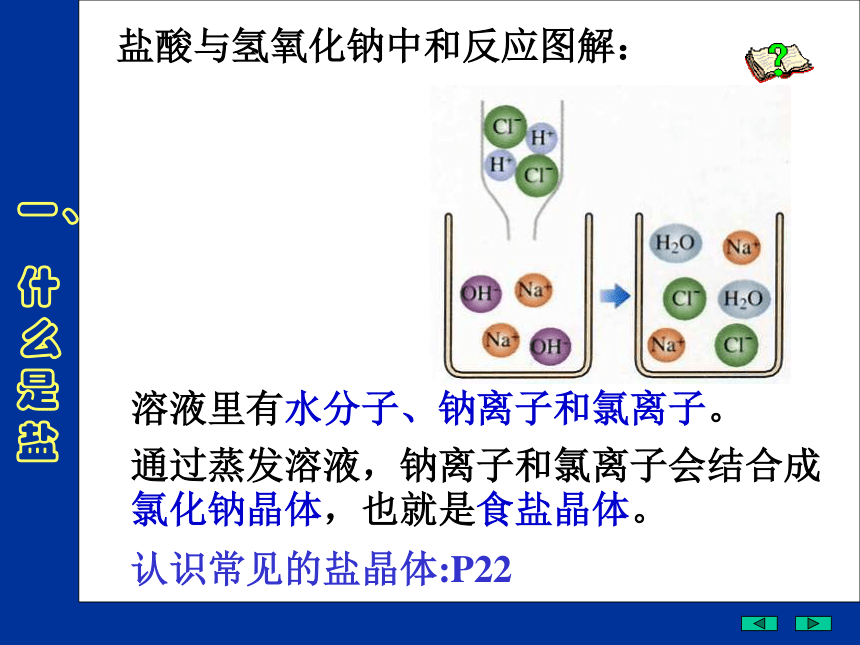
HCl、NaOH、NaCl、HNO3、Ca(OH)2、Na2CO3、H2SO4、Fe(OH)3、CuSO4、Cu(OH)2 、 NH4Cl、剩下的是什么?NaCl是由哪种酸和哪种碱中和的产物?你能写出反应的化学方程式吗? Na2CO3 、CuSO4和NH4Cl呢?盐酸与氢氧化钠中和反应图解:一、
什么是盐溶液里有水分子、钠离子和氯离子。
通过蒸发溶液,钠离子和氯离子会结合成氯化钠晶体,也就是食盐晶体。 认识常见的盐晶体:P22一、
什么是盐1、盐的定义:由金属阳离子(或铵根离子)和酸根阴离子组成的化合物叫做盐。2、常见的盐
CaCO3 、Na2CO3 、NaCl、BaCl2 、 CuSO4、 NH4NO3你能写出它们的电离方程式吗?通过什么方法记住这些盐二、
几种盐的性质1、碳酸钠(Na2CO3 )
俗名:纯碱或苏打
晶体(Na2CO3 ·10H2O)暴露在空气中易风化,失去结晶水成为碳酸钠粉末。二、几种盐的性质风化:结晶水合物在空气里失去结晶水的过程。
结晶水:晶体从溶液中析出时结合的水分子。结晶水合物:含结晶水的化合物溶液变红色。碳酸钠的水溶液呈碱性P23实验: 【拓展】强碱弱酸盐呈碱性,弱碱强酸呈酸性,强碱强酸盐呈中性。表2:碳酸钠与碳酸氢钠的比较2、碳酸钙( CaCO3 ):难溶于水
几种常见的形式:汉白玉、大理石、石灰石、蛋壳、贝壳写出二氧化碳、碳酸与氢氧化钙溶液反应的方程式,并寻找两者相同之处。都生成盐和水CO2+Ca(OH)2=CaCO3↓+H2O H2CO3+Ca(OH)2=CaCO3↓+2H2O 二、
几种盐的性质▲碳酸盐的检验答:取小块岩石,滴加盐酸,观察有无气泡产生,如有气泡产生,则岩石中有碳酸盐存在。思考:怎样证明一块岩石是碳酸盐?二、
几种盐的性质碳酸根离子的鉴别方法;用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
CO2+ Ca(OH) 2= CaCO3↓+H2O 3、食盐(NaCl) 现象:白色沉淀
AgNO3 +NaCl= NaNO3 +AgCl↓二、
几种盐的性质盐酸盐的检验方法井水制盐、海水晒盐。①制生理盐水(0.9%)②杀菌③化工上制氢氧化钠、氯气、盐酸等氯化钠与硝酸银反应。小结:本节课你学到了什么?知识:
1、盐的定义
2、碳酸钠、碳酸钙和氯化钠的性质
方法:
1、盐化学式的书写
2、碳酸盐和盐酸盐的检验方法1、盐的溶解性及应用阅读P192附录2三、
盐的制取溶解性口诀:钾钠钡铵四碱溶
钾钠铵硝盐全溶
盐酸盐,除银盐
硫酸盐,除钡、铅盐
碳酸盐,唯有钾钠铵可溶。 应用于物质的制取、提纯和鉴别等。P25实验:写出反应方程式有白色沉淀产生。
Na2CO3+CaCl2=CaCO3↓+NaCl 分析该反应原理:三、
盐的制取化合物互换成分生成新的化合物。 属于化合反应或分解反应吗?▲复分解反应发生的条件:产物须有沉淀或气体或水生成。 ▲复分解反应P26 复分解反应方法:对于气体或水能否生成可按反应规律来判断,产物是否为沉淀则须根据溶解性表(P192)来判断。 通式:AB+CD=AD+CB▲酸碱盐相互之间的反应是复分解反应。讨论:结合上述的实验,以及酸和碱的通性,能否推断盐有哪些化学性质? 2、盐的性质
⑴酸+盐→新酸+新盐
⑵碱+盐→新碱+新盐
⑶盐+盐→新盐+新盐 三、
盐的制取【练习】
根据上述三个反应规律,请同学们分别写三个反应的化学方程式。(1)盐+酸 →新盐+新酸
(2)盐+碱→ 新碱+新盐
(3)盐+盐→新盐+新盐三、
盐的制取Na2CO3+HCl=NaCl+H2O+CO2 ↑CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4Na2CO3+CaCl2=CaCO3↓+NaCl 都属于复分解反应【练习】①硫酸与硝酸钠溶液
②氢氧化钾溶液与硝酸
③氯化钠溶液与硝酸银溶液
④碳酸钾溶液和盐酸
⑤硫酸铜溶液和氯化钡溶液 写出下列物质能发生反应的化学方程式,不能说明原因:三、
盐的制取4、介绍侯氏制碱(纯碱)法【思考】根据酸的共性和碱的共性,以及盐的有关性质,小结能够获得盐的途径有多少?比一比,谁想的多!三、
盐的制取1、酸与金属氧化物反应生成盐和水
2、酸与金属反应生成盐和氢气
3、酸与碱反应生成盐和水
4、碱与非金属氧化物反应生成盐和水
5、酸与盐反应生成新酸和新盐
6、碱与盐反应生成新碱和新盐
7、盐与盐反应生成新盐和新盐练习活动:为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:
方案1:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液?
方案2:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液?请回答:
(1)该同学设计的两个方案有一个是正确的,该方案是????????;另一个方案是不正确的,原因是??????。
(2)请你再设计一个实验,区别上述两种溶液:小结:本节课你学到了什么?知识:
1、复分解反应定义及反应条件
2、盐的性质
3、盐的溶解性及制取
方法
1、判断复分解反应的方法
2、酸碱盐的区别方法四、盐与化肥四、
盐与化肥【练习活动】P27图1-30:连线。比比谁既快又正确。阅读课本找出什么是化肥?化肥有哪些类型? 写一写:写出只含有N元素、P元素、K元素的盐,写出既含有N元素又含有K元素的盐。化肥之一氮肥(2)工业制取:酸与氨气反应制得如:氨与硫酸、碳酸、盐酸的反应,写出化学方程式,该反应属于何种反应?1、氮肥(铵盐为主,还包括硝酸盐和尿素)(1)作用:能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素 回顾:植物缺氮肥的症状▲铵盐的性质:实验:
(1)铵盐与碱的反应
现象:
化学方程式:
(2)用湿润的红色石蕊试纸检验气体结论:铵盐的检验( NH4的检验)。铵盐的性质产生有刺激性气味的气体(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O红色试纸变蓝色。NH3+H2O=NH3·H2O回答P28思考2、磷肥作用:促进农作物要系发达,增强吸收养份和抗寒抗旱能力,促进作物穗数增多,籽粒饱满等。化肥之二磷肥代表物:过磷酸钙:属于混合物。书写化学式。回顾:植物缺磷肥的症状代表物:硫酸钾、氯化钾、草木灰(成份K2CO3):3、钾肥作用:促进农作物生长旺盛,茎杆粗壮,增强抗病虫害能力,促进糖和淀粉的生成。化肥之三钾肥回顾:植物缺钾肥的症状【拓展与迁移】硝酸钾(KNO3)属于哪种化肥?练习活动:写化学式。 复合肥盐与化肥〖练习与活动〗课本P29练习1-3题施肥原则:以农家肥为主,化肥为辅 使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥)思考:经常使用化肥有哪些利弊?小结:本节课你学到了什么?知识
1、三种化肥制取、性质、代表物及作用
2、使用化肥注意事项
方法
铵盐的检验方法如:C+2H2SO4(浓) = CO2 ↑ +2SO2 ↑ +2H2O结论:浓硫酸有很强的氧化性
什么是盐【考考你】认出酸和碱:
HCl、NaOH、NaCl、HNO3、Ca(OH)2、Na2CO3、H2SO4、Fe(OH)3、CuSO4、Cu(OH)2 、 NH4Cl、剩下的是什么?NaCl是由哪种酸和哪种碱中和的产物?你能写出反应的化学方程式吗? Na2CO3 、CuSO4和NH4Cl呢?盐酸与氢氧化钠中和反应图解:一、
什么是盐溶液里有水分子、钠离子和氯离子。
通过蒸发溶液,钠离子和氯离子会结合成氯化钠晶体,也就是食盐晶体。 认识常见的盐晶体:P22一、
什么是盐1、盐的定义:由金属阳离子(或铵根离子)和酸根阴离子组成的化合物叫做盐。2、常见的盐
CaCO3 、Na2CO3 、NaCl、BaCl2 、 CuSO4、 NH4NO3你能写出它们的电离方程式吗?通过什么方法记住这些盐二、
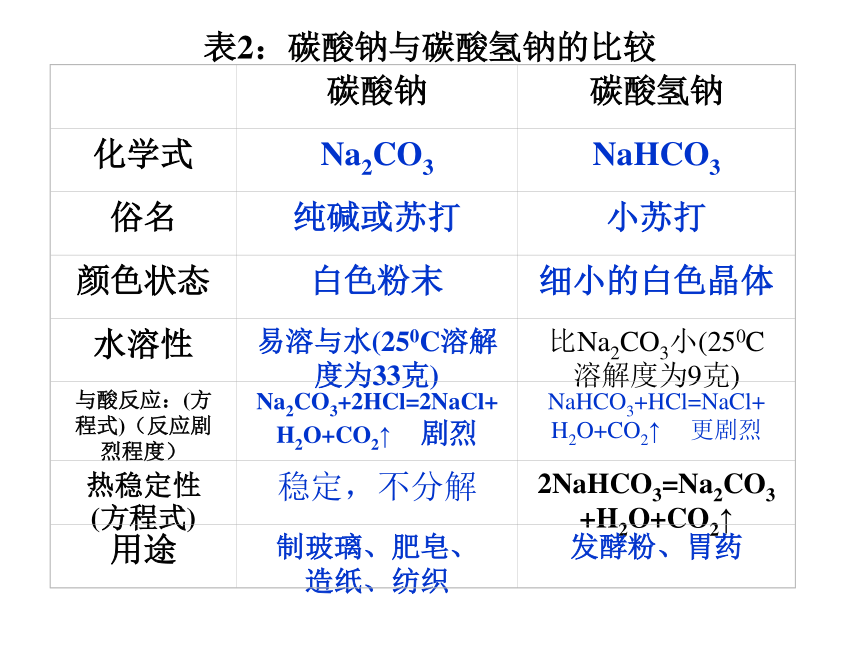
几种盐的性质1、碳酸钠(Na2CO3 )
俗名:纯碱或苏打
晶体(Na2CO3 ·10H2O)暴露在空气中易风化,失去结晶水成为碳酸钠粉末。二、几种盐的性质风化:结晶水合物在空气里失去结晶水的过程。
结晶水:晶体从溶液中析出时结合的水分子。结晶水合物:含结晶水的化合物溶液变红色。碳酸钠的水溶液呈碱性P23实验: 【拓展】强碱弱酸盐呈碱性,弱碱强酸呈酸性,强碱强酸盐呈中性。表2:碳酸钠与碳酸氢钠的比较2、碳酸钙( CaCO3 ):难溶于水
几种常见的形式:汉白玉、大理石、石灰石、蛋壳、贝壳写出二氧化碳、碳酸与氢氧化钙溶液反应的方程式,并寻找两者相同之处。都生成盐和水CO2+Ca(OH)2=CaCO3↓+H2O H2CO3+Ca(OH)2=CaCO3↓+2H2O 二、
几种盐的性质▲碳酸盐的检验答:取小块岩石,滴加盐酸,观察有无气泡产生,如有气泡产生,则岩石中有碳酸盐存在。思考:怎样证明一块岩石是碳酸盐?二、
几种盐的性质碳酸根离子的鉴别方法;用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
CO2+ Ca(OH) 2= CaCO3↓+H2O 3、食盐(NaCl) 现象:白色沉淀
AgNO3 +NaCl= NaNO3 +AgCl↓二、
几种盐的性质盐酸盐的检验方法井水制盐、海水晒盐。①制生理盐水(0.9%)②杀菌③化工上制氢氧化钠、氯气、盐酸等氯化钠与硝酸银反应。小结:本节课你学到了什么?知识:
1、盐的定义
2、碳酸钠、碳酸钙和氯化钠的性质
方法:
1、盐化学式的书写
2、碳酸盐和盐酸盐的检验方法1、盐的溶解性及应用阅读P192附录2三、
盐的制取溶解性口诀:钾钠钡铵四碱溶
钾钠铵硝盐全溶
盐酸盐,除银盐
硫酸盐,除钡、铅盐
碳酸盐,唯有钾钠铵可溶。 应用于物质的制取、提纯和鉴别等。P25实验:写出反应方程式有白色沉淀产生。
Na2CO3+CaCl2=CaCO3↓+NaCl 分析该反应原理:三、
盐的制取化合物互换成分生成新的化合物。 属于化合反应或分解反应吗?▲复分解反应发生的条件:产物须有沉淀或气体或水生成。 ▲复分解反应P26 复分解反应方法:对于气体或水能否生成可按反应规律来判断,产物是否为沉淀则须根据溶解性表(P192)来判断。 通式:AB+CD=AD+CB▲酸碱盐相互之间的反应是复分解反应。讨论:结合上述的实验,以及酸和碱的通性,能否推断盐有哪些化学性质? 2、盐的性质
⑴酸+盐→新酸+新盐
⑵碱+盐→新碱+新盐
⑶盐+盐→新盐+新盐 三、
盐的制取【练习】
根据上述三个反应规律,请同学们分别写三个反应的化学方程式。(1)盐+酸 →新盐+新酸
(2)盐+碱→ 新碱+新盐
(3)盐+盐→新盐+新盐三、
盐的制取Na2CO3+HCl=NaCl+H2O+CO2 ↑CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4Na2CO3+CaCl2=CaCO3↓+NaCl 都属于复分解反应【练习】①硫酸与硝酸钠溶液
②氢氧化钾溶液与硝酸
③氯化钠溶液与硝酸银溶液
④碳酸钾溶液和盐酸
⑤硫酸铜溶液和氯化钡溶液 写出下列物质能发生反应的化学方程式,不能说明原因:三、
盐的制取4、介绍侯氏制碱(纯碱)法【思考】根据酸的共性和碱的共性,以及盐的有关性质,小结能够获得盐的途径有多少?比一比,谁想的多!三、
盐的制取1、酸与金属氧化物反应生成盐和水
2、酸与金属反应生成盐和氢气
3、酸与碱反应生成盐和水
4、碱与非金属氧化物反应生成盐和水
5、酸与盐反应生成新酸和新盐
6、碱与盐反应生成新碱和新盐
7、盐与盐反应生成新盐和新盐练习活动:为区别NaOH和Na2CO3两种无色溶液,某同学设计了以下两种实验方案:
方案1:分别取少许两种溶液,各滴入几滴无色酚酞试液,根据酚酞试液是否变红色判断各是哪种溶液?
方案2:分别取少许两种溶液,各加入少量澄清石灰水,根据是否有白色沉淀生成判断各是哪种溶液?请回答:
(1)该同学设计的两个方案有一个是正确的,该方案是????????;另一个方案是不正确的,原因是??????。
(2)请你再设计一个实验,区别上述两种溶液:小结:本节课你学到了什么?知识:
1、复分解反应定义及反应条件
2、盐的性质
3、盐的溶解性及制取
方法
1、判断复分解反应的方法
2、酸碱盐的区别方法四、盐与化肥四、
盐与化肥【练习活动】P27图1-30:连线。比比谁既快又正确。阅读课本找出什么是化肥?化肥有哪些类型? 写一写:写出只含有N元素、P元素、K元素的盐,写出既含有N元素又含有K元素的盐。化肥之一氮肥(2)工业制取:酸与氨气反应制得如:氨与硫酸、碳酸、盐酸的反应,写出化学方程式,该反应属于何种反应?1、氮肥(铵盐为主,还包括硝酸盐和尿素)(1)作用:能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素 回顾:植物缺氮肥的症状▲铵盐的性质:实验:
(1)铵盐与碱的反应
现象:
化学方程式:
(2)用湿润的红色石蕊试纸检验气体结论:铵盐的检验( NH4的检验)。铵盐的性质产生有刺激性气味的气体(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O红色试纸变蓝色。NH3+H2O=NH3·H2O回答P28思考2、磷肥作用:促进农作物要系发达,增强吸收养份和抗寒抗旱能力,促进作物穗数增多,籽粒饱满等。化肥之二磷肥代表物:过磷酸钙:属于混合物。书写化学式。回顾:植物缺磷肥的症状代表物:硫酸钾、氯化钾、草木灰(成份K2CO3):3、钾肥作用:促进农作物生长旺盛,茎杆粗壮,增强抗病虫害能力,促进糖和淀粉的生成。化肥之三钾肥回顾:植物缺钾肥的症状【拓展与迁移】硝酸钾(KNO3)属于哪种化肥?练习活动:写化学式。 复合肥盐与化肥〖练习与活动〗课本P29练习1-3题施肥原则:以农家肥为主,化肥为辅 使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥)思考:经常使用化肥有哪些利弊?小结:本节课你学到了什么?知识
1、三种化肥制取、性质、代表物及作用
2、使用化肥注意事项
方法
铵盐的检验方法如:C+2H2SO4(浓) = CO2 ↑ +2SO2 ↑ +2H2O结论:浓硫酸有很强的氧化性
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
