探索酸的性质(第一课时)[上学期]
图片预览





文档简介
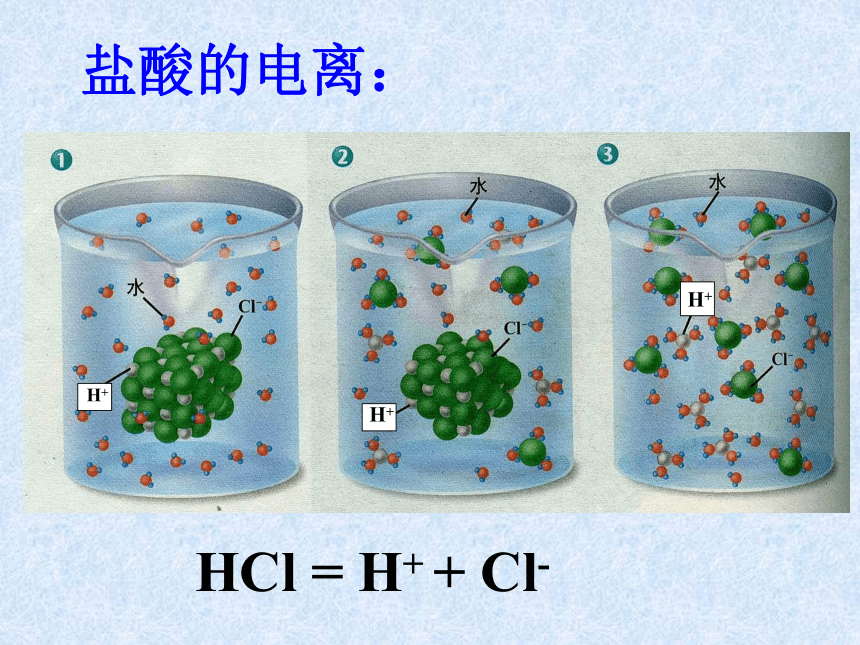
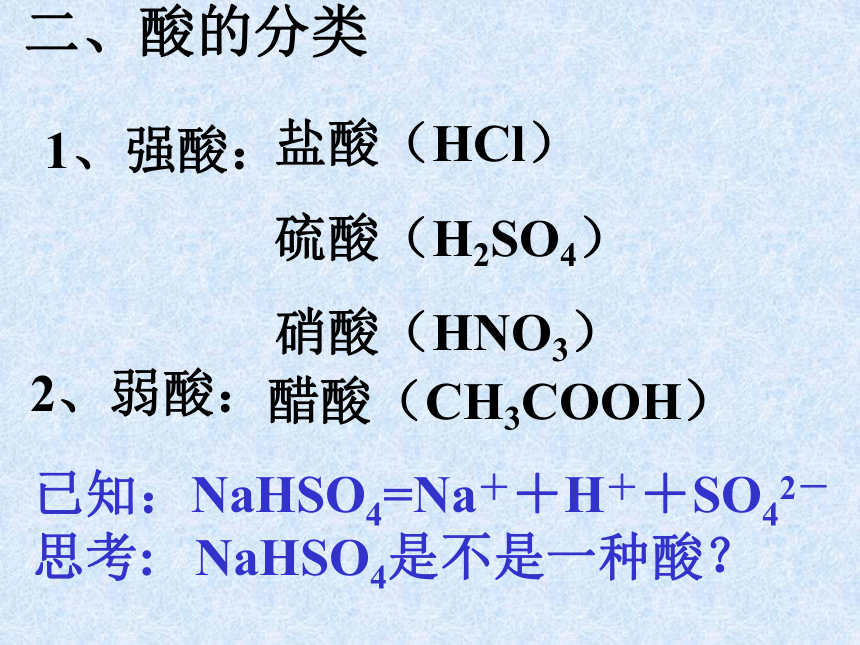
课件18张PPT。第二节 探索酸的性质第一课时酸一、什么是酸 你若有呕吐的经历,你会感受到胃液是酸的。在日常生活中,有酸味的物质还有醋、放置时间过长的面包、杏、苹果、橘子等。我们知道:食醋——醋酸,胃液——盐酸,柠檬、柑橘等水果中含有柠檬酸。 这些物质在水中电离时,生成的阳离子全部都是氢离子(H+)。那么,为什么说这些物质都是酸呢?盐酸的电离:HCl = H+ + Cl-H+H+H+1、强酸:二、酸的分类
2、弱酸:醋酸(CH3COOH)盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)已知:NaHSO4=Na++H++SO42-
思考: NaHSO4是不是一种酸?
pH>7,碱性; pH =7,中性;pH<7,酸性。 那么,你知道还有什么方法可以测定物质的酸碱性?酸碱指示剂石蕊遇酸变红色,酚酞遇酸不变色。 pH试纸和酸碱指示剂有何区别呢? pH试纸能显示酸性的强弱,而指示剂则只能指示溶液是否显酸性 相同点:两者都能辨别酸性物质不同点:1、(1)盐酸和烧碱起反应:
HCl + NaOH = NaCl +H2O
(2)氢氧化铝药物治疗胃酸过多:
3HCl + Al(OH)3 ==== AlCl3 + 3H2O酸的共性NaOH和Al(OH)3都属于哪一类物质呢?结论:酸能与碱发生中和反应,生成盐和水2、(1)氧化铁和稀盐酸反应:
Fe2O3 + 6HCl === 2FeCl3 + 3H2O
(2)氧化铜和稀盐酸反应:
CuO + 2HCl ==== CuCl2 + H2O酸的共性Fe2O3和CuO都属于哪一类物质呢?结论:酸能与碱性氧化物反应,生成 盐和水3、铁和稀盐酸反应:
Fe + 2HCl === FeCl2 + H2 酸的共性Fe属于哪一类物质呢?结论: 酸能与某些活泼金属发生置换
反应,生成相应的盐和氢气4、大理石与稀盐酸反应:
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑酸的共性CaCO3属于哪一类物质呢?结论: 酸能与某些盐发生 复分解
反应,生成新酸和新盐 1、 酸能使指示剂变色(酸能使紫色石蕊试液
变红, 使无色酚酞试液不变色).
2、酸能与碱发生中和反应,生成盐和水
3、酸能与碱性氧化物反应,生成 盐和水
4、能与某些活泼金属发生置换反应,生成相应的盐和氢气.
5、酸能与某些盐发生 复分解反应,生成新酸和新盐 总 结:练 习1、下列物质中,能除去铁制品表面铁
锈的是 ( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液
2、写出下列方程式,并写出反应类型
反应类型
(1)Fe+H2SO4 == ; __________
(2)CuO+H2SO4== ; _________
(3)NaOH+H2SO4== ; _________
(4)H2SO4+BaCl2== ; __________
(5)HCl+AgNO3== ; __________
练 习3、稀硝酸中混有小量的盐酸,为了除去盐
酸,可以加入适量的 ( )
A、Fe B、AgNO3
C、BaCl2 D、KOH
4、实验测得一些食物的近似pH,其中酸性
最强的是 ( )
A.牛奶6.3—6.6 B.苹果2.9—3.3
C.番茄4.0—4.4 D.玉米粥6.8—8.0
练 习5、盐酸在工农业生产和日常生活中用途很
大。下列各项用途是利用盐酸的哪些性质?
试写出有关反应的化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)制革工业中用熟石灰脱毛后,剩余的
熟石灰[Ca(OH)2]用盐酸来除去。
(3)用稀盐酸清除锅炉中的水垢[主要成
分为CaCO3,和Mg(OH)2]。
练 习6、怎样鉴别3瓶分别盛有水、稀盐酸、稀硫
酸的无色液体?
7、向稀盐酸中滴加石蕊试液,溶液显____
色,稀盐酸的PH______7(填<、>、=)
8、鉴定某酸溶液为盐酸时需用试剂是:
______ 、 ______
9、下列各种酸的性质中,不属于酸的通性
的是: ( )
A、盐酸能和锌粒反应 B、碳酸容易分解
C、硫酸能与氢氧化钠反应
D、盐酸能清洗铁锈
2、弱酸:醋酸(CH3COOH)盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)已知:NaHSO4=Na++H++SO42-
思考: NaHSO4是不是一种酸?
pH>7,碱性; pH =7,中性;pH<7,酸性。 那么,你知道还有什么方法可以测定物质的酸碱性?酸碱指示剂石蕊遇酸变红色,酚酞遇酸不变色。 pH试纸和酸碱指示剂有何区别呢? pH试纸能显示酸性的强弱,而指示剂则只能指示溶液是否显酸性 相同点:两者都能辨别酸性物质不同点:1、(1)盐酸和烧碱起反应:
HCl + NaOH = NaCl +H2O
(2)氢氧化铝药物治疗胃酸过多:
3HCl + Al(OH)3 ==== AlCl3 + 3H2O酸的共性NaOH和Al(OH)3都属于哪一类物质呢?结论:酸能与碱发生中和反应,生成盐和水2、(1)氧化铁和稀盐酸反应:
Fe2O3 + 6HCl === 2FeCl3 + 3H2O
(2)氧化铜和稀盐酸反应:
CuO + 2HCl ==== CuCl2 + H2O酸的共性Fe2O3和CuO都属于哪一类物质呢?结论:酸能与碱性氧化物反应,生成 盐和水3、铁和稀盐酸反应:
Fe + 2HCl === FeCl2 + H2 酸的共性Fe属于哪一类物质呢?结论: 酸能与某些活泼金属发生置换
反应,生成相应的盐和氢气4、大理石与稀盐酸反应:
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑酸的共性CaCO3属于哪一类物质呢?结论: 酸能与某些盐发生 复分解
反应,生成新酸和新盐 1、 酸能使指示剂变色(酸能使紫色石蕊试液
变红, 使无色酚酞试液不变色).
2、酸能与碱发生中和反应,生成盐和水
3、酸能与碱性氧化物反应,生成 盐和水
4、能与某些活泼金属发生置换反应,生成相应的盐和氢气.
5、酸能与某些盐发生 复分解反应,生成新酸和新盐 总 结:练 习1、下列物质中,能除去铁制品表面铁
锈的是 ( )
A、稀硫酸 B、水
C、氢氧化钠溶液 D、硫酸铜溶液
2、写出下列方程式,并写出反应类型
反应类型
(1)Fe+H2SO4 == ; __________
(2)CuO+H2SO4== ; _________
(3)NaOH+H2SO4== ; _________
(4)H2SO4+BaCl2== ; __________
(5)HCl+AgNO3== ; __________
练 习3、稀硝酸中混有小量的盐酸,为了除去盐
酸,可以加入适量的 ( )
A、Fe B、AgNO3
C、BaCl2 D、KOH
4、实验测得一些食物的近似pH,其中酸性
最强的是 ( )
A.牛奶6.3—6.6 B.苹果2.9—3.3
C.番茄4.0—4.4 D.玉米粥6.8—8.0
练 习5、盐酸在工农业生产和日常生活中用途很
大。下列各项用途是利用盐酸的哪些性质?
试写出有关反应的化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)制革工业中用熟石灰脱毛后,剩余的
熟石灰[Ca(OH)2]用盐酸来除去。
(3)用稀盐酸清除锅炉中的水垢[主要成
分为CaCO3,和Mg(OH)2]。
练 习6、怎样鉴别3瓶分别盛有水、稀盐酸、稀硫
酸的无色液体?
7、向稀盐酸中滴加石蕊试液,溶液显____
色,稀盐酸的PH______7(填<、>、=)
8、鉴定某酸溶液为盐酸时需用试剂是:
______ 、 ______
9、下列各种酸的性质中,不属于酸的通性
的是: ( )
A、盐酸能和锌粒反应 B、碳酸容易分解
C、硫酸能与氢氧化钠反应
D、盐酸能清洗铁锈
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
