2017-2018学年高一化学人教版(课堂同步系列二)每日一题2017年12月16日周末培优
文档属性
| 名称 | 2017-2018学年高一化学人教版(课堂同步系列二)每日一题2017年12月16日周末培优 |
|
|
| 格式 | zip | ||
| 文件大小 | 359.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-12 00:00:00 | ||
图片预览


文档简介
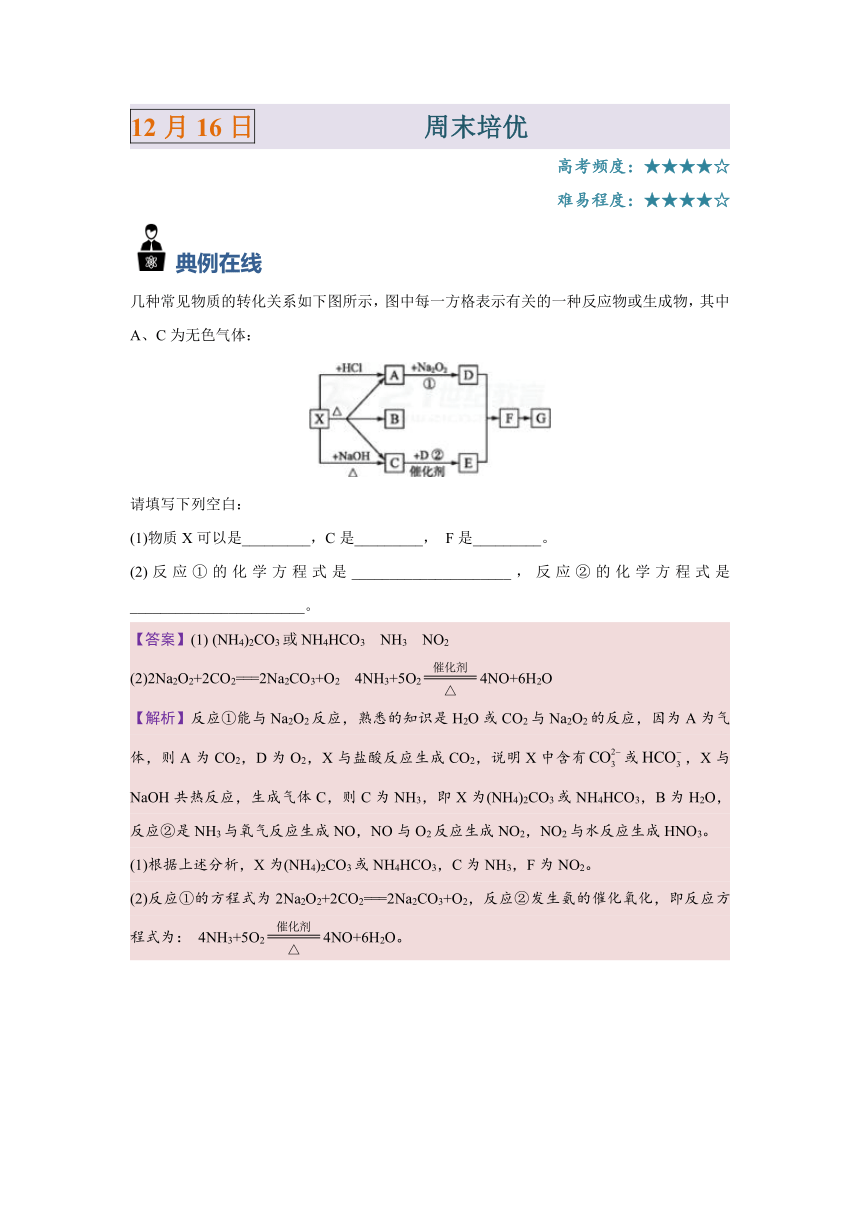
12月16日 周末培优
高考频度:★★★★☆
难易程度:★★★★☆
典例在线
几种常见物质的转化关系如下图所示,图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体:
请填写下列空白:
(1)物质X可以是_________,C是_________, F是_________。?
(2)反应①的化学方程式是_____________________,反应②的化学方程式是_______________________。
【答案】(1) (NH4)2CO3或NH4HCO3 NH3 NO2
(2)2Na2O2+2CO2===2Na2CO3+O2 4NH3+5O24NO+6H2O
【解析】反应①能与Na2O2反应,熟悉的知识是H2O或CO2与Na2O2的反应,因为A为气体,则A为CO2,D为O2,X与盐酸反应生成CO2,说明X中含有或,X与NaOH共热反应,生成气体C,则C为NH3,即X为(NH4)2CO3或NH4HCO3,B为H2O,反应②是NH3与氧气反应生成NO,NO与O2反应生成NO2,NO2与水反应生成HNO3。
(1)根据上述分析,X为(NH4)2CO3或NH4HCO3,C为NH3,F为NO2。
(2)反应①的方程式为2Na2O2+2CO2===2Na2CO3+O2,反应②发生氨的催化氧化,即反应方程式为: 4NH3+5O24NO+6H2O。
解题必备
氮及其化合物的转化关系
部分转化的化学方程式如下:
N2 +O22NO
3Mg+N2Mg3N2
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H22NH3
NH3+H2ONH3·H2O
NH3+H+===
4NH3+5O24NO+6H2O
NH3·H2ONH3↑+H2O
Al3++3NH3·H2O===Al(OH)3↓+3
NH4ClNH3↑+HCl↑
NH4HCO3NH3↑+H2O+CO2↑
NaOH+NH4NO3NH3↑+NaNO3+H2O
【特别提醒】
1.牢记1条转化主线
N2NH3NONO2HNO3NH4NO3
2.掌握铵盐的2种性质
(1)受热易分解;
(2)与碱共热放出氨气——用于制取NH3和的检验。
学霸推荐
1.下列叙述不属于固氮的是
A.工业上合成氨
B.NH3经催化氧化生成NO
C.闪电时,大气中生成NO
D.豆科植物根部的根瘤菌使空气中的氮气转变为铵态氮肥
2.元素及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的各步转化中均可以通过一步反应完成的是
A.N2→NO2→HNO3→NO
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→Al2O3→Al(OH)3→AlCl3
3.依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是
A.X是N2O5
B.可用排水法收集NO、NO2气体
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,NH3可与NO2反应实现
4.A~H均是中学常见物质,它们之间有下图所示转化关系(部分产物已略去)。已知:A为酸式盐,常用作化肥;常温下B、D、E、F、G均为气体,C为无色液体。
回答下列问题:
(1)列举工业上D的一种具体用途_______________________。
(2)反应①的离子方程式为______________________________。
(3)在反应②中,若生成1.6 g E,则转移电子的物质的量为________mol。
(4)反应③的化学方程式为______________________________。
(5)在反应④中,被氧化的物质与被还原的物质的物质的量之比为________。
参考答案
1.【答案】B
2.【答案】B
【解析】A、氮气与氧气化合生成一氧化氮,得不到二氧化氮,不能通过一步反应完成,故A不选;B、
Fe→FeCl2→Fe(OH)2→Fe(OH)3 中反应方程式分别是Fe+2HCl===FeCl2+H2↑、FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3,所以能一步实现,故B选;C、二氧化硅不溶于水,不能与水反应生成硅酸,不能通过一步反应完成,故C不选;D、氧化铝和水不反应,所以不能一步生成氢氧化铝,故D不选;故选B。
3.【答案】B
4.【答案】(1)作制冷剂、生产氮肥、生产硝酸等
(2)++2OH?NH3↑++2H2O
(3)0.1
(4)4NH3+5O24NO+6H2O
(5)2︰1
【解析】因为A为酸式盐,常用作化肥,既能和硫酸反应又能和氢氧化钠反应且均生成气体,结合其受热分解生成两种气体和一种液体,所以可以确定A为碳酸氢铵,B为二氧化碳,C为水,D为氨气。二氧化碳与过氧化钠反应生成氧气,所以E为氧气。氨气经催化氧化为一氧化氮,所以F为NO。NO和氧气反应生成二氧化氮,所以G为二氧化氮。二氧化氮和水反应生成硝酸和NO,所以H为硝酸。
(1)工业上氨气具体用途是作制冷剂、生产氮肥、生产硝酸等。
(2)反应①的离子方程式为++2OH?NH3↑++2H2O。
(3)在反应②中,生成一个氧气分子,电子转移的数目是2e?,所以若生成1.6 g氧气,则转移电子的物质的量为0.1 mol。
(4)反应③的化学方程式为4NH3+5O24NO+6H2O。
(5)在反应④的化学方程式为3NO2+H2O===2HNO3+NO,被氧化的物质是二氧化氮,产物是硝酸;被还原的物质也是二氧化氮,产物为NO,所以被氧化的物质与被还原的物质的的物质的量之比为2︰1。
学霸之路
高考频度:★★★★☆
难易程度:★★★★☆
典例在线
几种常见物质的转化关系如下图所示,图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体:
请填写下列空白:
(1)物质X可以是_________,C是_________, F是_________。?
(2)反应①的化学方程式是_____________________,反应②的化学方程式是_______________________。
【答案】(1) (NH4)2CO3或NH4HCO3 NH3 NO2
(2)2Na2O2+2CO2===2Na2CO3+O2 4NH3+5O24NO+6H2O
【解析】反应①能与Na2O2反应,熟悉的知识是H2O或CO2与Na2O2的反应,因为A为气体,则A为CO2,D为O2,X与盐酸反应生成CO2,说明X中含有或,X与NaOH共热反应,生成气体C,则C为NH3,即X为(NH4)2CO3或NH4HCO3,B为H2O,反应②是NH3与氧气反应生成NO,NO与O2反应生成NO2,NO2与水反应生成HNO3。
(1)根据上述分析,X为(NH4)2CO3或NH4HCO3,C为NH3,F为NO2。
(2)反应①的方程式为2Na2O2+2CO2===2Na2CO3+O2,反应②发生氨的催化氧化,即反应方程式为: 4NH3+5O24NO+6H2O。
解题必备
氮及其化合物的转化关系
部分转化的化学方程式如下:
N2 +O22NO
3Mg+N2Mg3N2
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
N2+3H22NH3
NH3+H2ONH3·H2O
NH3+H+===
4NH3+5O24NO+6H2O
NH3·H2ONH3↑+H2O
Al3++3NH3·H2O===Al(OH)3↓+3
NH4ClNH3↑+HCl↑
NH4HCO3NH3↑+H2O+CO2↑
NaOH+NH4NO3NH3↑+NaNO3+H2O
【特别提醒】
1.牢记1条转化主线
N2NH3NONO2HNO3NH4NO3
2.掌握铵盐的2种性质
(1)受热易分解;
(2)与碱共热放出氨气——用于制取NH3和的检验。
学霸推荐
1.下列叙述不属于固氮的是
A.工业上合成氨
B.NH3经催化氧化生成NO
C.闪电时,大气中生成NO
D.豆科植物根部的根瘤菌使空气中的氮气转变为铵态氮肥
2.元素及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的各步转化中均可以通过一步反应完成的是
A.N2→NO2→HNO3→NO
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→Al2O3→Al(OH)3→AlCl3
3.依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是
A.X是N2O5
B.可用排水法收集NO、NO2气体
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,NH3可与NO2反应实现
4.A~H均是中学常见物质,它们之间有下图所示转化关系(部分产物已略去)。已知:A为酸式盐,常用作化肥;常温下B、D、E、F、G均为气体,C为无色液体。
回答下列问题:
(1)列举工业上D的一种具体用途_______________________。
(2)反应①的离子方程式为______________________________。
(3)在反应②中,若生成1.6 g E,则转移电子的物质的量为________mol。
(4)反应③的化学方程式为______________________________。
(5)在反应④中,被氧化的物质与被还原的物质的物质的量之比为________。
参考答案
1.【答案】B
2.【答案】B
【解析】A、氮气与氧气化合生成一氧化氮,得不到二氧化氮,不能通过一步反应完成,故A不选;B、
Fe→FeCl2→Fe(OH)2→Fe(OH)3 中反应方程式分别是Fe+2HCl===FeCl2+H2↑、FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3,所以能一步实现,故B选;C、二氧化硅不溶于水,不能与水反应生成硅酸,不能通过一步反应完成,故C不选;D、氧化铝和水不反应,所以不能一步生成氢氧化铝,故D不选;故选B。
3.【答案】B
4.【答案】(1)作制冷剂、生产氮肥、生产硝酸等
(2)++2OH?NH3↑++2H2O
(3)0.1
(4)4NH3+5O24NO+6H2O
(5)2︰1
【解析】因为A为酸式盐,常用作化肥,既能和硫酸反应又能和氢氧化钠反应且均生成气体,结合其受热分解生成两种气体和一种液体,所以可以确定A为碳酸氢铵,B为二氧化碳,C为水,D为氨气。二氧化碳与过氧化钠反应生成氧气,所以E为氧气。氨气经催化氧化为一氧化氮,所以F为NO。NO和氧气反应生成二氧化氮,所以G为二氧化氮。二氧化氮和水反应生成硝酸和NO,所以H为硝酸。
(1)工业上氨气具体用途是作制冷剂、生产氮肥、生产硝酸等。
(2)反应①的离子方程式为++2OH?NH3↑++2H2O。
(3)在反应②中,生成一个氧气分子,电子转移的数目是2e?,所以若生成1.6 g氧气,则转移电子的物质的量为0.1 mol。
(4)反应③的化学方程式为4NH3+5O24NO+6H2O。
(5)在反应④的化学方程式为3NO2+H2O===2HNO3+NO,被氧化的物质是二氧化氮,产物是硝酸;被还原的物质也是二氧化氮,产物为NO,所以被氧化的物质与被还原的物质的的物质的量之比为2︰1。
学霸之路
