第9单元-课题2-溶解度(36张PPT)
图片预览











文档简介
课件36张PPT。9.2 溶解度学生练习:
1、下列物质属于溶液的是( )
A、矿泉水 B、油水 C、泥水 D、蒸馏水温故而知新A1、溶液的特征: 、 。均一性 稳定性 2、 分散到液体里形成的混合物叫做乳浊液。
乳浊液 , 能够增强乳浊液的稳定性。 乳化功能小液滴不稳定2、洗涤在生活、生产中不可缺少。下列洗涤方法中利用
了乳化原理的是( )
A、用汽油洗去手上的油污
B、用洗洁精洗去餐具上的油污
C、用酒精洗去试管中的碘
D、用稀盐酸洗去铁制品表面的铁锈B 我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?阅读课本 P33 活动与探究
实验目的是什么?
1、
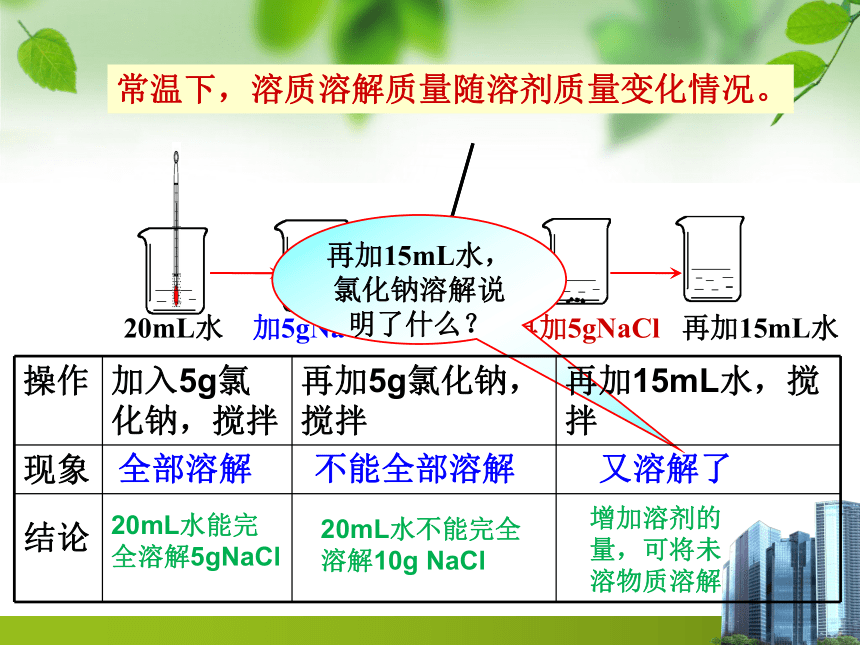
2、溶质在定量溶剂中溶解的质量随温度变化情况。常温下,溶质溶解质量随溶剂质量变化情况。20ml水 加5gNaCl 搅拌 再加5gNaCl 再加15ml水常温下,溶质溶解质量随溶剂质量变化情况。烧杯刻度注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!20ml水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g溶质在定量溶剂中溶解质量随温度变化情况。冷却测温度:T1:20mL水、T2 :加热完全溶解时温度、T3:冷却析出晶体后的温度
注意温度计不能碰到烧杯内壁和烧杯底部,不能用于搅拌!
将实验现象和结论记录在课本P34表格中。
观察冷却后的烧杯中的现象。20mL水 加5gNaCl 搅拌 再加5gNaCl 再加15mL水常温下,溶质溶解质量随溶剂质量变化情况。再加15mL水,氯化钠溶解说明了什么?又溶解了不能全部溶解全部溶解20mL水能完全溶解5gNaCl增加溶剂的量,可将未溶物质溶解20mL水不能完全溶解10g NaCl溶解有固体不溶物固体消失固体又溶解了析出晶体20mL水能完全溶解5g KNO320mL水不能完全溶解10g KNO3温度升高, KNO3溶解能力增强温度升高, KNO3溶解能力增强温度降低, KNO3溶解能力减弱溶质在定量溶剂中溶解质量随温度变化情况。结论:可溶物在一定量的水中不能无限溶解,
不同温度下,物质的溶解能力不同。在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。 不饱和溶液?还能继续溶解的溶液,叫做这种溶质的不饱和溶液。注意:
1、只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。温度或者溶剂量改变,饱和溶液与不饱和溶液可以相互转化。
2、饱和溶液概念中“不能”指的是在一定温度下,一定量溶剂里,溶解该物质的量达到了最大限度。不饱和溶液概念中“能”指的是在一定温度下,一定量溶剂里,溶解该
物质的量还没有达到了最大限度。3、明确“某一物质”的饱和或不饱和溶液。如一定条件下,不能再溶解氯化钠的溶液,可继续溶解蔗糖,此时的溶液是氯化钠的饱和溶液,但是蔗糖的不饱和溶液。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液、硝酸钾饱和溶液。如何验证某溶液已经达到饱和?4、浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。5、饱和溶液和不饱和溶液判断方法在一定温度下,一定量的溶剂中,加少量的原溶质,若能继续溶解则是不饱和溶液,不能继续溶解的是饱和溶液。如:某物质溶于水后,各阶段所得溶液如图……由c、b知,b中物质还在溶解,a、b为不饱和溶液;由d、c知,c中物质不再溶解,c、d为饱和溶液。 思考:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量饱和溶液
不包括未溶解的固体!D思考:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?增加溶质、蒸发溶剂、改变温度加入硝酸钾、蒸发掉一些水、降低温度思考:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些? 增加溶剂、改变温度 再加一些水、升高温度不饱和溶液和饱和溶液之间的转化利用以上原理可以从海水中提取粗盐,同时得到含有大量化工原料的母液,叫做苦卤。
味苦涩,主要含有氯化钾、氯化镁、硫酸镁和溴等。 蒸发溶剂增加溶质降低温度增加溶剂升高温度 注意:
“升温”和“降温”两种方法适合大多数固态溶质的溶液。海水提取食盐流程海水晒盐析出晶体与硝酸钾溶液的结晶析出有什么不同?蒸发结晶
降温结晶(冷却热饱和溶液)①结晶概念:已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫结晶。 ② 方法:为什么采用饱和氯化钠溶液反复冲洗粗盐,可以除去粗盐中的氯化钙、氯化镁等杂质,达到精制食盐的目的?1、指出下列各题的错误之处,并加以改正:
① 不能再溶解某种溶质的溶液叫饱和溶液;
② 装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
③ 使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些;
④ 在同一温度下,同体积的某物质的饱和溶液,
一定会比另一物质的不饱和溶液含有的溶质多;在一定温度下,一定量的溶剂中,不能……。不一定,有可能刚好达到饱和。依然是不饱和溶液。不一定,这两种物质的溶解能力有可能不同。2、室温下向一定质量的氯化钠溶液中加入10g氯化钠固体,
充分搅拌后,尚有部分的固体未溶解,加入10g水后,
固体全部溶解,下列说法正确的是( )
A、加水前一定是饱和溶液 B、加水前可能是饱和溶液
C、加水后一定是饱和溶液 D、加水后一定不是饱和溶液A巩固练习:3、20℃时,将33克食盐放入100克水中,食盐全部溶
解,此时溶液质量为 克,再向此溶液加入3克
食盐又恰好全部溶解,则溶质为 克,现在溶液
恰好饱和,此时溶液的质量为 克,再向此溶液
加入3克食盐,溶液的质量是 克。133361361365、有一瓶蒸馏水和一瓶稀氯化钾溶液,
用什么简单的方法把它们区分开?4、为什么汗水带咸味?被汗水浸湿的衣服晾干后,
为什么常出现白色的斑痕?人分泌的汗水,是氯化钠溶液.因为溶有氯化钠,所以带咸味。凉干,是将水分蒸发,所以有氯化钠析出。把一滴试样滴在玻璃片上,晾干或烘干,有白色痕迹出现的,原试样是氯化钾溶液。蒸馏水是纯水, 晾干后没有痕迹。(加氯化钾、通电等)根据前面氯化钠和硝酸钾的两个溶解实验,可以说明,在一定温度下,在一定量溶剂里溶质的溶解量是有一定限度(溶解的最大值)的。化学上用溶解度表示这种溶解的限度。
那么比较不同物质的溶解能力,应该控制哪些条件?固体溶解度相同温度
等量的同种溶剂
溶解达到饱和状态一定温度下
100克的溶剂里
溶解达到饱和状态时所溶解的最大质量来进行比较:质量大的溶解能力强。P36 溶解度的定义 溶解度的单位?1、定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。克溶解度(一)固体溶解度2、固体溶解度的四要素:一定温度100克溶剂(一般指水)饱和状态质量(克)概括为:(记 着 温 饱)剂、质、温、饱20 ℃,氯化钠的溶解度为36g表示意义是什么?
1、在20 ℃时,100g水里最多能溶解36g氯化钠(溶液达到饱和状态)。
2、在20 ℃时,36g氯化钠加入100g水里刚好饱和。3、固体溶解度的意义:学生练习:判断下列说法是否正确:(1)20克 A 物质溶解在100克水里恰好制成饱和
溶液, A的溶解度是20克。(4)20℃时, 100克水最多可溶解36克氯化钠,
则20℃时氯化钠的溶解度为36。(X) 温度(X) 单位:克(2)20℃时,10克氯化钠溶解在水里制成饱和溶液,
故20℃时氯化钠的溶解度是10克。(X) 100克溶剂(3)20℃时,10克氯化钠可溶解在100克水里,
20℃时氯化钠的溶解度是10克。(X) 饱和4、固体溶解度的相对大小(20℃)难溶是绝对不溶吗?5、影响固体溶解度的因素:溶质的种类溶剂的种类 温 度 溶解度与溶质,溶剂的质量无关注意√6、溶解度的表示方法: P36硝酸钾在不同温度时的溶解度....温度/℃.硝酸钾....① 绘制溶解度曲线温度(t)16015014013012011010090807060504030201019018017010807060504030200硝酸铵硝酸钾硝酸钠氯化铵氯化钠硼酸1、曲线上的点均表示某物质在该温度下的溶解度。同种物质在不同温度下溶解度不同;不同物质在温度相同时溶解度不同。2、曲线交点表示这两种物质在该温度下的溶解度相同。3、曲线越陡该物质溶解度受温度影响越大。查出50 ℃几种物质的溶解度溶解度g② 从绘制的溶解度曲线上,
查出上述几种物质在
25℃和85℃时的溶解度。 溶解度(克)溶解度(克)温度℃36.238.736.052.539.268.539.2185③ 固体物质的溶解度随温度的变化
有什么规律?举例说明。A、大多数固体物质的溶解度随着温
度的升高而增大。如:KNO3B、少数固体物质的溶解度受温
度的影响较小。 如:NaClC、极少数固体物质的溶解度随着温
度的升高而减小。如:Ca(OH)2从溶解度曲线分析得到物质结晶方法1、降温结晶 如:KNO3(又叫冷却热饱和溶液法)2、蒸发溶剂法 如:NaCl3、升温结晶 如:Ca(OH)216015014013012011010090807060504030201019018017010807060504030200硝酸钾氯化钠从溶解度曲线分析结晶情况1、降温结晶
(又叫冷却热饱和溶液法)适用于溶解度随温度变化较大的物质如:KNO32、蒸发溶剂法适用于溶解度随温度变化较小的物质如:NaCl温度(t)溶解度g问:溶解度曲线有哪些应用?1、可以判断固体物质的溶解度受温度影响的变化情况;2、可以比较不同物质在同一温度时溶解度的大小;3、可以查出同一种物质在不同温度时的溶解度。 (二)气体溶解度指该气体的压强为101KPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。1、概念:2、气体溶解度的意义:如:0℃时,氮气的溶解度为0.024在0℃,氮气压强为101kPa时,1体积水最多能溶解0. 024体积氮气 课 题 2 溶 解 度讨论:3、影响气体溶解度的因素:气体溶解度一般随压强增大而增大,压强减小而减小。气体溶解度一般随温度升高而减小,温度降低而增大。1、打开汽水(或某些含有二氧化碳
气体的饮料)瓶盖时,汽水会自
动喷出来。这说明气体在水中的
溶解度与什么有关?2、喝了汽水以后,常常会打嗝。
这说明气体的溶解度还与什
么有关?压强温度解释:天气闷热时,鱼儿为什么总爱在水面上进行呼吸? 如何增加养鱼池水中的含氧量 我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?学完本课题你应该知道1、在一定温度下,向一定量溶剂里加入某种溶质,
当溶质不能继续溶解时,所得的溶液叫做这种溶
质的饱和溶液。2、固体的溶解度表示在一定温度下,某固态物质在
100g溶剂里达到饱和状态时所溶解的质量。3、气体的溶解度通常是指该气体的压强为101kPa和
一定温度时,溶解在1体积水里达到饱和状态时
的气体体积。4、物质的溶解度随温度变化的曲线叫做溶解度曲线。
利用溶解度曲线,可以获得许多有关物质溶解度的
信息。巩固提高:
1、如图是A、B、C三种物质在水中的溶解度曲线,
请回答:
(1)M点的含义是_________________________
(2)当温度为t1oC,三种物质溶解度由小到大依次为
_______,当温度为t3oC时,溶解度最大的是____。
(3)C可能表示哪种物质:____________________Ca(OH)2或CO2等气体2、课本P40 3(在课本中填空)C>A>BAA和C两种物质在t2oC时的溶解度相同3、甲、乙、丙三种固体物质的溶解度曲线如下图所示。
回答下列问题:
① a3℃时,三种物质的溶解度由大到小的顺序
是 ;
② a2℃时, 和 的溶解度大小相等;
③ 三种物质中,
的溶解度受温度的
影响最大,
的溶解度受温度的
影响最小,
的溶解度随温度的
升高而减小。 甲>丙>乙甲 丙甲乙丙4、甲、乙两种物质的溶解度曲线如右图所示。
下列说法中正确的是( )
A、t1℃时甲和乙的饱和溶液,
升温到t2℃时仍是饱和溶液
B、甲和乙的溶解度相等
C、t1℃时,甲和乙各30g分别加
入100g水中,均形成饱和溶液
D、t2℃时,在100克水中加入
60克甲,形成不饱溶液5、将20℃时硝酸钾不饱和溶液转变为饱和
溶液可采用[ ]
A.升高温度 B.加入溶剂
C.加入溶质 D.倒掉一半溶液CC
1、下列物质属于溶液的是( )
A、矿泉水 B、油水 C、泥水 D、蒸馏水温故而知新A1、溶液的特征: 、 。均一性 稳定性 2、 分散到液体里形成的混合物叫做乳浊液。
乳浊液 , 能够增强乳浊液的稳定性。 乳化功能小液滴不稳定2、洗涤在生活、生产中不可缺少。下列洗涤方法中利用
了乳化原理的是( )
A、用汽油洗去手上的油污
B、用洗洁精洗去餐具上的油污
C、用酒精洗去试管中的碘
D、用稀盐酸洗去铁制品表面的铁锈B 我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?阅读课本 P33 活动与探究
实验目的是什么?
1、
2、溶质在定量溶剂中溶解的质量随温度变化情况。常温下,溶质溶解质量随溶剂质量变化情况。20ml水 加5gNaCl 搅拌 再加5gNaCl 再加15ml水常温下,溶质溶解质量随溶剂质量变化情况。烧杯刻度注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!20ml水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g溶质在定量溶剂中溶解质量随温度变化情况。冷却测温度:T1:20mL水、T2 :加热完全溶解时温度、T3:冷却析出晶体后的温度
注意温度计不能碰到烧杯内壁和烧杯底部,不能用于搅拌!
将实验现象和结论记录在课本P34表格中。
观察冷却后的烧杯中的现象。20mL水 加5gNaCl 搅拌 再加5gNaCl 再加15mL水常温下,溶质溶解质量随溶剂质量变化情况。再加15mL水,氯化钠溶解说明了什么?又溶解了不能全部溶解全部溶解20mL水能完全溶解5gNaCl增加溶剂的量,可将未溶物质溶解20mL水不能完全溶解10g NaCl溶解有固体不溶物固体消失固体又溶解了析出晶体20mL水能完全溶解5g KNO320mL水不能完全溶解10g KNO3温度升高, KNO3溶解能力增强温度升高, KNO3溶解能力增强温度降低, KNO3溶解能力减弱溶质在定量溶剂中溶解质量随温度变化情况。结论:可溶物在一定量的水中不能无限溶解,
不同温度下,物质的溶解能力不同。在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。 不饱和溶液?还能继续溶解的溶液,叫做这种溶质的不饱和溶液。注意:
1、只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。温度或者溶剂量改变,饱和溶液与不饱和溶液可以相互转化。
2、饱和溶液概念中“不能”指的是在一定温度下,一定量溶剂里,溶解该物质的量达到了最大限度。不饱和溶液概念中“能”指的是在一定温度下,一定量溶剂里,溶解该
物质的量还没有达到了最大限度。3、明确“某一物质”的饱和或不饱和溶液。如一定条件下,不能再溶解氯化钠的溶液,可继续溶解蔗糖,此时的溶液是氯化钠的饱和溶液,但是蔗糖的不饱和溶液。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液、硝酸钾饱和溶液。如何验证某溶液已经达到饱和?4、浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。5、饱和溶液和不饱和溶液判断方法在一定温度下,一定量的溶剂中,加少量的原溶质,若能继续溶解则是不饱和溶液,不能继续溶解的是饱和溶液。如:某物质溶于水后,各阶段所得溶液如图……由c、b知,b中物质还在溶解,a、b为不饱和溶液;由d、c知,c中物质不再溶解,c、d为饱和溶液。 思考:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量饱和溶液
不包括未溶解的固体!D思考:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?增加溶质、蒸发溶剂、改变温度加入硝酸钾、蒸发掉一些水、降低温度思考:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些? 增加溶剂、改变温度 再加一些水、升高温度不饱和溶液和饱和溶液之间的转化利用以上原理可以从海水中提取粗盐,同时得到含有大量化工原料的母液,叫做苦卤。
味苦涩,主要含有氯化钾、氯化镁、硫酸镁和溴等。 蒸发溶剂增加溶质降低温度增加溶剂升高温度 注意:
“升温”和“降温”两种方法适合大多数固态溶质的溶液。海水提取食盐流程海水晒盐析出晶体与硝酸钾溶液的结晶析出有什么不同?蒸发结晶
降温结晶(冷却热饱和溶液)①结晶概念:已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫结晶。 ② 方法:为什么采用饱和氯化钠溶液反复冲洗粗盐,可以除去粗盐中的氯化钙、氯化镁等杂质,达到精制食盐的目的?1、指出下列各题的错误之处,并加以改正:
① 不能再溶解某种溶质的溶液叫饱和溶液;
② 装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
③ 使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些;
④ 在同一温度下,同体积的某物质的饱和溶液,
一定会比另一物质的不饱和溶液含有的溶质多;在一定温度下,一定量的溶剂中,不能……。不一定,有可能刚好达到饱和。依然是不饱和溶液。不一定,这两种物质的溶解能力有可能不同。2、室温下向一定质量的氯化钠溶液中加入10g氯化钠固体,
充分搅拌后,尚有部分的固体未溶解,加入10g水后,
固体全部溶解,下列说法正确的是( )
A、加水前一定是饱和溶液 B、加水前可能是饱和溶液
C、加水后一定是饱和溶液 D、加水后一定不是饱和溶液A巩固练习:3、20℃时,将33克食盐放入100克水中,食盐全部溶
解,此时溶液质量为 克,再向此溶液加入3克
食盐又恰好全部溶解,则溶质为 克,现在溶液
恰好饱和,此时溶液的质量为 克,再向此溶液
加入3克食盐,溶液的质量是 克。133361361365、有一瓶蒸馏水和一瓶稀氯化钾溶液,
用什么简单的方法把它们区分开?4、为什么汗水带咸味?被汗水浸湿的衣服晾干后,
为什么常出现白色的斑痕?人分泌的汗水,是氯化钠溶液.因为溶有氯化钠,所以带咸味。凉干,是将水分蒸发,所以有氯化钠析出。把一滴试样滴在玻璃片上,晾干或烘干,有白色痕迹出现的,原试样是氯化钾溶液。蒸馏水是纯水, 晾干后没有痕迹。(加氯化钾、通电等)根据前面氯化钠和硝酸钾的两个溶解实验,可以说明,在一定温度下,在一定量溶剂里溶质的溶解量是有一定限度(溶解的最大值)的。化学上用溶解度表示这种溶解的限度。
那么比较不同物质的溶解能力,应该控制哪些条件?固体溶解度相同温度
等量的同种溶剂
溶解达到饱和状态一定温度下
100克的溶剂里
溶解达到饱和状态时所溶解的最大质量来进行比较:质量大的溶解能力强。P36 溶解度的定义 溶解度的单位?1、定义:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。克溶解度(一)固体溶解度2、固体溶解度的四要素:一定温度100克溶剂(一般指水)饱和状态质量(克)概括为:(记 着 温 饱)剂、质、温、饱20 ℃,氯化钠的溶解度为36g表示意义是什么?
1、在20 ℃时,100g水里最多能溶解36g氯化钠(溶液达到饱和状态)。
2、在20 ℃时,36g氯化钠加入100g水里刚好饱和。3、固体溶解度的意义:学生练习:判断下列说法是否正确:(1)20克 A 物质溶解在100克水里恰好制成饱和
溶液, A的溶解度是20克。(4)20℃时, 100克水最多可溶解36克氯化钠,
则20℃时氯化钠的溶解度为36。(X) 温度(X) 单位:克(2)20℃时,10克氯化钠溶解在水里制成饱和溶液,
故20℃时氯化钠的溶解度是10克。(X) 100克溶剂(3)20℃时,10克氯化钠可溶解在100克水里,
20℃时氯化钠的溶解度是10克。(X) 饱和4、固体溶解度的相对大小(20℃)难溶是绝对不溶吗?5、影响固体溶解度的因素:溶质的种类溶剂的种类 温 度 溶解度与溶质,溶剂的质量无关注意√6、溶解度的表示方法: P36硝酸钾在不同温度时的溶解度....温度/℃.硝酸钾....① 绘制溶解度曲线温度(t)16015014013012011010090807060504030201019018017010807060504030200硝酸铵硝酸钾硝酸钠氯化铵氯化钠硼酸1、曲线上的点均表示某物质在该温度下的溶解度。同种物质在不同温度下溶解度不同;不同物质在温度相同时溶解度不同。2、曲线交点表示这两种物质在该温度下的溶解度相同。3、曲线越陡该物质溶解度受温度影响越大。查出50 ℃几种物质的溶解度溶解度g② 从绘制的溶解度曲线上,
查出上述几种物质在
25℃和85℃时的溶解度。 溶解度(克)溶解度(克)温度℃36.238.736.052.539.268.539.2185③ 固体物质的溶解度随温度的变化
有什么规律?举例说明。A、大多数固体物质的溶解度随着温
度的升高而增大。如:KNO3B、少数固体物质的溶解度受温
度的影响较小。 如:NaClC、极少数固体物质的溶解度随着温
度的升高而减小。如:Ca(OH)2从溶解度曲线分析得到物质结晶方法1、降温结晶 如:KNO3(又叫冷却热饱和溶液法)2、蒸发溶剂法 如:NaCl3、升温结晶 如:Ca(OH)216015014013012011010090807060504030201019018017010807060504030200硝酸钾氯化钠从溶解度曲线分析结晶情况1、降温结晶
(又叫冷却热饱和溶液法)适用于溶解度随温度变化较大的物质如:KNO32、蒸发溶剂法适用于溶解度随温度变化较小的物质如:NaCl温度(t)溶解度g问:溶解度曲线有哪些应用?1、可以判断固体物质的溶解度受温度影响的变化情况;2、可以比较不同物质在同一温度时溶解度的大小;3、可以查出同一种物质在不同温度时的溶解度。 (二)气体溶解度指该气体的压强为101KPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。1、概念:2、气体溶解度的意义:如:0℃时,氮气的溶解度为0.024在0℃,氮气压强为101kPa时,1体积水最多能溶解0. 024体积氮气 课 题 2 溶 解 度讨论:3、影响气体溶解度的因素:气体溶解度一般随压强增大而增大,压强减小而减小。气体溶解度一般随温度升高而减小,温度降低而增大。1、打开汽水(或某些含有二氧化碳
气体的饮料)瓶盖时,汽水会自
动喷出来。这说明气体在水中的
溶解度与什么有关?2、喝了汽水以后,常常会打嗝。
这说明气体的溶解度还与什
么有关?压强温度解释:天气闷热时,鱼儿为什么总爱在水面上进行呼吸? 如何增加养鱼池水中的含氧量 我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?学完本课题你应该知道1、在一定温度下,向一定量溶剂里加入某种溶质,
当溶质不能继续溶解时,所得的溶液叫做这种溶
质的饱和溶液。2、固体的溶解度表示在一定温度下,某固态物质在
100g溶剂里达到饱和状态时所溶解的质量。3、气体的溶解度通常是指该气体的压强为101kPa和
一定温度时,溶解在1体积水里达到饱和状态时
的气体体积。4、物质的溶解度随温度变化的曲线叫做溶解度曲线。
利用溶解度曲线,可以获得许多有关物质溶解度的
信息。巩固提高:
1、如图是A、B、C三种物质在水中的溶解度曲线,
请回答:
(1)M点的含义是_________________________
(2)当温度为t1oC,三种物质溶解度由小到大依次为
_______,当温度为t3oC时,溶解度最大的是____。
(3)C可能表示哪种物质:____________________Ca(OH)2或CO2等气体2、课本P40 3(在课本中填空)C>A>BAA和C两种物质在t2oC时的溶解度相同3、甲、乙、丙三种固体物质的溶解度曲线如下图所示。
回答下列问题:
① a3℃时,三种物质的溶解度由大到小的顺序
是 ;
② a2℃时, 和 的溶解度大小相等;
③ 三种物质中,
的溶解度受温度的
影响最大,
的溶解度受温度的
影响最小,
的溶解度随温度的
升高而减小。 甲>丙>乙甲 丙甲乙丙4、甲、乙两种物质的溶解度曲线如右图所示。
下列说法中正确的是( )
A、t1℃时甲和乙的饱和溶液,
升温到t2℃时仍是饱和溶液
B、甲和乙的溶解度相等
C、t1℃时,甲和乙各30g分别加
入100g水中,均形成饱和溶液
D、t2℃时,在100克水中加入
60克甲,形成不饱溶液5、将20℃时硝酸钾不饱和溶液转变为饱和
溶液可采用[ ]
A.升高温度 B.加入溶剂
C.加入溶质 D.倒掉一半溶液CC
同课章节目录
