3.1 构成物质的基本微粒(共55张PPT)
文档属性
| 名称 | 3.1 构成物质的基本微粒(共55张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-17 00:00:00 | ||
图片预览










文档简介
课件55张PPT。第一节 构成物质的基本微粒 第三章 物质构成的奥秘构成物质的基本微粒有三种:
分子、原子、离子
一、微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
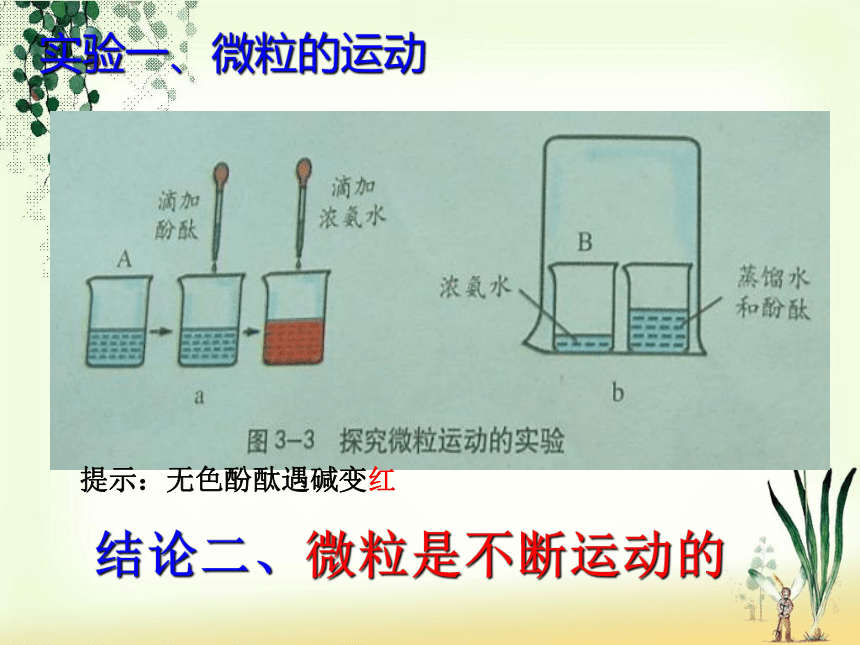
实验一、微粒的运动提示:无色酚酞遇碱变红结论二、微粒是不断运动的{思考}想想装有蒸馏水和酚酞的烧杯为什么会变成红色?{原因}因为从浓氨水中会挥发出氨分子,氨分子运动到了装有蒸馏水和酚酞的烧杯中,与水结合形成了氨水。酚酞遇到了氨水变红。实验二、微粒的运动你还能举出生活中关于微粒运动的例子吗?
日常生活中我们都有这样的体验:在热水中溶解糖要比冷水中溶解快,你知道其中的原因吗?
温度越高,微粒运动速度越快。实验三:微粒之间有间隙 先用胶头滴管向玻璃管中加水,使其充满玻璃管容积的二分之一,再用胶头滴管慢慢滴入酒精,使其充满玻璃管。用手指堵紧开口的一端,颠倒数次。观察体积是否变化。结论三、微粒之间有间隙。{试问} 1+1=2吗?{原因}因为酒精微粒和水微粒分别填补了对方微粒相互之间的空隙,从而使得总体积变小。实验四:空气和水的压缩
取一支针筒,抽取一定量的空气,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
在刚才的这支针筒内抽取相同量的水,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
针筒内的水和空气能否被压缩?你知道原因吗?哪个更易被压缩?
现在你知道原因了吧?
微粒间间隙不同,一般:气>液>固
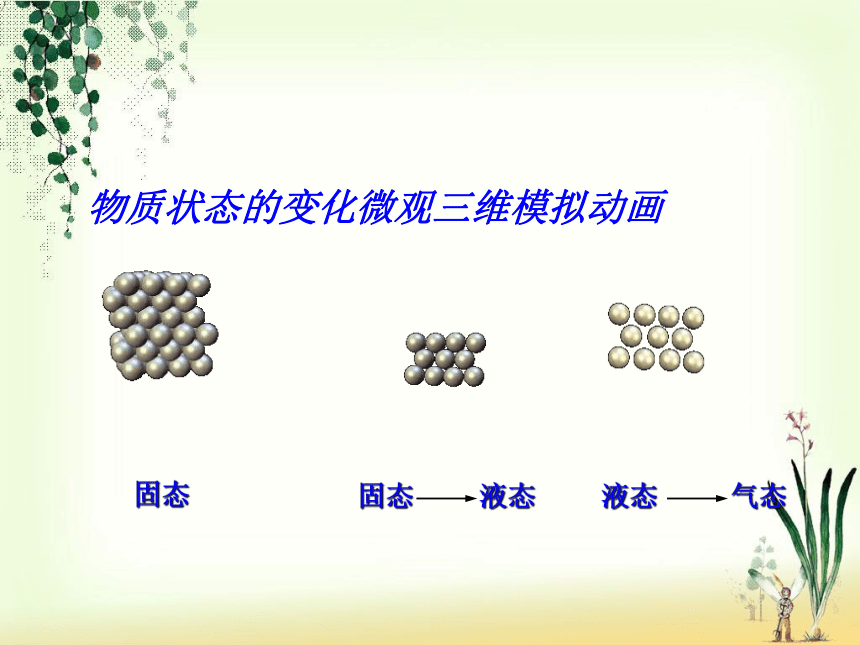
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程。(微粒本身没有变化)通过刚才的分析,你能解释物质“三态”变化的原因吗?固态固态 液态液态 气态物质状态的变化微观三维模拟动画小结: 微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
2、微粒在不停地运动,温度越高,微粒运动速度越快。
3、微粒之间有一定的空隙。1.为什么用打气筒可以将空气打进自行车的轮胎?2.为什么湿衣服在太阳底下干的更快?
3.为什么水烧开后能顶开壶盖?因为气体分子间隙大,易压缩因为太阳底下温度高,分子运动快因为水从液体变成气体,分子间隙变大,体积膨胀5.为什么装氧气的钢瓶要承受很大的压力? 6.为什么水泥路面中要嵌玻璃条或木条或留一条缝?4.为什么空气是均匀的?因为分子不断运动,使空气变的均匀因为分子不断运动,撞击钢瓶壁防止因温度变化,分子间隙发生变化,使路面热胀冷缩而变形7.发生物理变化时,构成物质的微粒本身没有改变;但发生化学变化时,原来物质的微粒变成其他物质的微粒了8.物质发生“三态”变化时,构成物质的微粒本身没有改变,只是微粒之间的空隙发生了改变讨论一下我们已经知道,氧气具有助燃性,氢气具有可燃性,你能从微粒的角度分析它们化学性质为什么不同吗?
不同物质由不同的微粒构成,具有不同的化学性质。练一练1、用微粒的观点解释下列现象:
(1)、“遥知不是雪,唯有暗香来”
(2)、为什么湿衣服晾在阳光下容易干?
2、将水加热,变成水蒸气体积增大,说明受热后构成水的微粒运动速率______且间距______
3、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明构成物质的微粒间______;在上述的一些变化中,物质的微粒本身_____(填有或没有)变化, 所发生的变化属于____变化。
你相信吗?一滴水(20滴水约1毫升)里大约有1.67X1021个水分子,如果10亿人来数一滴水里的水分子个数,每人每分钟数100个,日夜不停需要数3万年才能数完。原子的构成
氧化汞分解的微 观 过 程化学变化的实质旧的分子分解(离解)原子重新组合新的分子 化学变化中,分子是可分的,原子不可分。小
结问题讨论原子再可分吗?想一想原子结构的发现史 公元前5世纪,古希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。2、1803年,英国科学家道尔顿提出 近代原子学说,他认为原子是微小 的不可分割的实心球体。英国化学家道尔顿
(J.Dalton , 1766~1844)3.原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)4.α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)5.电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,
反之,出现的机会少。一、原子的构成1.原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)新课讲解2.构成原子的粒子的电性和质量一个质子和一个电子所带的电量相等,电性相反。一个质子和一个中子的质量约相等。原子的质量主要集中在原子核上。你发现了什么问题讨论想一想3.几种原子的构成质子数=核外电子数=核电荷数不是所有的原子都含有中子。质子数不一定等于中子数。不同种类的原子,核内的质子数不同,核外的电子数也不同。从下表中你能总结出什么规律?结论: ①原子一定由质子和电子构成(不一定有
中子,有一种氢原子没有中子) ②质子数不一定等于中子数③核电荷数=质子数=核外电子数,④质子与核外电子电量相等,电性相反,故整个原子不显电性。4.原子核·原子的大小关系:原子中,原子核很小,电子在原子空间作高速运动。原子核原子原子核比原子小得多原子里有很大空间,电子就在这个空间里绕原子核作高速运动。电子绕核运动知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……有关夸克的结构和性质仍有探索和研究中……课堂练习1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②③④⑤①②④③①③⑤ 几种原子的质量 原子的质量如此小,无论书写、记忆、还是使
用都极不方便。原子的质量又该怎样衡量呢?相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。二、相对原子质量注意点:
相对原子质量只是一个比,不是原子的实际质量。
相对原子质量的标准是一个碳12原子质量的1/12,
而不是一个碳12原子质量。
相对原子质量的单位是“1”,而不是“千克”、“克”等。
相对原子质量大的其原子的实际质量也大。◆符号 Ar
◆表达式氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= ≈ 1
碳12的十二分之一的质量氧原子的相对原子质量=比一比,看谁查得又快又准:1、查阅相对原子质量表(1)根据P154附录Ⅱ查得相对原子质量为:氮_ _氯_ _钠_ _铁_ _(取4位有效数字)14.0135.4522.9955.85112162331比一比,看谁查得又快又准:(2)根据P75表4-3查出下列原子的相对原子质量:相对原子质量≈ 质子数 + 中子数你发现了什么?表5-1 构成原子的粒子及其性质
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为相对原子质量。——元素符号相对原子质量 — 核电荷数 ——
(核内质子数)(补充)相对原子质量:填写下列表格:课堂练习 铁原子的相对原子质量是( )
A 56克 B 56
C 9.288*10-26 Kg D 1/56组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子BB课堂练习铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成,整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反相对分子质量相对分子质量等于构成分子的各原子的相对质子质量的总和。
它也是一个比值,单位也是“1”
分子的质量大相对分子质量也在。
相对分子质量用符号“Mr”表示。练一练根据相对原子质量计算下列物质的相对分子质量。
Cl2 P2O5 CO2 NaOH
Cu2 (OH) 2CO3一、原子的构成原子原子核核外电子质子中子(1个质子带1 个单位正电荷)(不带电)(1个电子带1 个单位负电荷)核电荷数=质子数=核外电子数课堂小结二、相对原子质量相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。相对原子质量=质子数+中子数整个原子对外不显电性资料介绍 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。他们的追求除了其优秀的个人素质以外,我认为,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
我们同学的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文、音乐, 陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。我们应向先辈们对真理执着追求的精神学习。教与学心得
分子、原子、离子
一、微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
实验一、微粒的运动提示:无色酚酞遇碱变红结论二、微粒是不断运动的{思考}想想装有蒸馏水和酚酞的烧杯为什么会变成红色?{原因}因为从浓氨水中会挥发出氨分子,氨分子运动到了装有蒸馏水和酚酞的烧杯中,与水结合形成了氨水。酚酞遇到了氨水变红。实验二、微粒的运动你还能举出生活中关于微粒运动的例子吗?
日常生活中我们都有这样的体验:在热水中溶解糖要比冷水中溶解快,你知道其中的原因吗?
温度越高,微粒运动速度越快。实验三:微粒之间有间隙 先用胶头滴管向玻璃管中加水,使其充满玻璃管容积的二分之一,再用胶头滴管慢慢滴入酒精,使其充满玻璃管。用手指堵紧开口的一端,颠倒数次。观察体积是否变化。结论三、微粒之间有间隙。{试问} 1+1=2吗?{原因}因为酒精微粒和水微粒分别填补了对方微粒相互之间的空隙,从而使得总体积变小。实验四:空气和水的压缩
取一支针筒,抽取一定量的空气,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
在刚才的这支针筒内抽取相同量的水,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
针筒内的水和空气能否被压缩?你知道原因吗?哪个更易被压缩?
现在你知道原因了吧?
微粒间间隙不同,一般:气>液>固
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程。(微粒本身没有变化)通过刚才的分析,你能解释物质“三态”变化的原因吗?固态固态 液态液态 气态物质状态的变化微观三维模拟动画小结: 微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
2、微粒在不停地运动,温度越高,微粒运动速度越快。
3、微粒之间有一定的空隙。1.为什么用打气筒可以将空气打进自行车的轮胎?2.为什么湿衣服在太阳底下干的更快?
3.为什么水烧开后能顶开壶盖?因为气体分子间隙大,易压缩因为太阳底下温度高,分子运动快因为水从液体变成气体,分子间隙变大,体积膨胀5.为什么装氧气的钢瓶要承受很大的压力? 6.为什么水泥路面中要嵌玻璃条或木条或留一条缝?4.为什么空气是均匀的?因为分子不断运动,使空气变的均匀因为分子不断运动,撞击钢瓶壁防止因温度变化,分子间隙发生变化,使路面热胀冷缩而变形7.发生物理变化时,构成物质的微粒本身没有改变;但发生化学变化时,原来物质的微粒变成其他物质的微粒了8.物质发生“三态”变化时,构成物质的微粒本身没有改变,只是微粒之间的空隙发生了改变讨论一下我们已经知道,氧气具有助燃性,氢气具有可燃性,你能从微粒的角度分析它们化学性质为什么不同吗?
不同物质由不同的微粒构成,具有不同的化学性质。练一练1、用微粒的观点解释下列现象:
(1)、“遥知不是雪,唯有暗香来”
(2)、为什么湿衣服晾在阳光下容易干?
2、将水加热,变成水蒸气体积增大,说明受热后构成水的微粒运动速率______且间距______
3、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明构成物质的微粒间______;在上述的一些变化中,物质的微粒本身_____(填有或没有)变化, 所发生的变化属于____变化。
你相信吗?一滴水(20滴水约1毫升)里大约有1.67X1021个水分子,如果10亿人来数一滴水里的水分子个数,每人每分钟数100个,日夜不停需要数3万年才能数完。原子的构成
氧化汞分解的微 观 过 程化学变化的实质旧的分子分解(离解)原子重新组合新的分子 化学变化中,分子是可分的,原子不可分。小
结问题讨论原子再可分吗?想一想原子结构的发现史 公元前5世纪,古希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。2、1803年,英国科学家道尔顿提出 近代原子学说,他认为原子是微小 的不可分割的实心球体。英国化学家道尔顿
(J.Dalton , 1766~1844)3.原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)4.α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)5.电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,
反之,出现的机会少。一、原子的构成1.原子原子核核外电子质子中子(每个质子带一个单位正电荷)(不带电)(每个电子带一个单位的负电荷)新课讲解2.构成原子的粒子的电性和质量一个质子和一个电子所带的电量相等,电性相反。一个质子和一个中子的质量约相等。原子的质量主要集中在原子核上。你发现了什么问题讨论想一想3.几种原子的构成质子数=核外电子数=核电荷数不是所有的原子都含有中子。质子数不一定等于中子数。不同种类的原子,核内的质子数不同,核外的电子数也不同。从下表中你能总结出什么规律?结论: ①原子一定由质子和电子构成(不一定有
中子,有一种氢原子没有中子) ②质子数不一定等于中子数③核电荷数=质子数=核外电子数,④质子与核外电子电量相等,电性相反,故整个原子不显电性。4.原子核·原子的大小关系:原子中,原子核很小,电子在原子空间作高速运动。原子核原子原子核比原子小得多原子里有很大空间,电子就在这个空间里绕原子核作高速运动。电子绕核运动知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……有关夸克的结构和性质仍有探索和研究中……课堂练习1、将①分子②原子③质子④中子⑤电子等粒子用序号分别填 入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②③④⑤①②④③①③⑤ 几种原子的质量 原子的质量如此小,无论书写、记忆、还是使
用都极不方便。原子的质量又该怎样衡量呢?相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。二、相对原子质量注意点:
相对原子质量只是一个比,不是原子的实际质量。
相对原子质量的标准是一个碳12原子质量的1/12,
而不是一个碳12原子质量。
相对原子质量的单位是“1”,而不是“千克”、“克”等。
相对原子质量大的其原子的实际质量也大。◆符号 Ar
◆表达式氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= ≈ 1
碳12的十二分之一的质量氧原子的相对原子质量=比一比,看谁查得又快又准:1、查阅相对原子质量表(1)根据P154附录Ⅱ查得相对原子质量为:氮_ _氯_ _钠_ _铁_ _(取4位有效数字)14.0135.4522.9955.85112162331比一比,看谁查得又快又准:(2)根据P75表4-3查出下列原子的相对原子质量:相对原子质量≈ 质子数 + 中子数你发现了什么?表5-1 构成原子的粒子及其性质
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为相对原子质量。——元素符号相对原子质量 — 核电荷数 ——
(核内质子数)(补充)相对原子质量:填写下列表格:课堂练习 铁原子的相对原子质量是( )
A 56克 B 56
C 9.288*10-26 Kg D 1/56组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子BB课堂练习铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成,整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反相对分子质量相对分子质量等于构成分子的各原子的相对质子质量的总和。
它也是一个比值,单位也是“1”
分子的质量大相对分子质量也在。
相对分子质量用符号“Mr”表示。练一练根据相对原子质量计算下列物质的相对分子质量。
Cl2 P2O5 CO2 NaOH
Cu2 (OH) 2CO3一、原子的构成原子原子核核外电子质子中子(1个质子带1 个单位正电荷)(不带电)(1个电子带1 个单位负电荷)核电荷数=质子数=核外电子数课堂小结二、相对原子质量相对原子质量:以一种碳原子质量的1/12作为标准,其它原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。相对原子质量=质子数+中子数整个原子对外不显电性资料介绍 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。他们的追求除了其优秀的个人素质以外,我认为,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
我们同学的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文、音乐, 陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。我们应向先辈们对真理执着追求的精神学习。教与学心得
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
