3.1 构成物质的基本微粒(共75张PPT)
文档属性
| 名称 | 3.1 构成物质的基本微粒(共75张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-17 00:00:00 | ||
图片预览









文档简介
课件75张PPT。第一节 构成物质的基本微粒九年级化学(上册)第三章 物质构成的奥秘课时一:微粒的性质绚丽多姿的物质根据已有经验,你对构成物质的微粒有怎样的认识?可用哪些事实来说明?微粒的性质
1、构成物质的微粒极小,肉眼是看不见的。
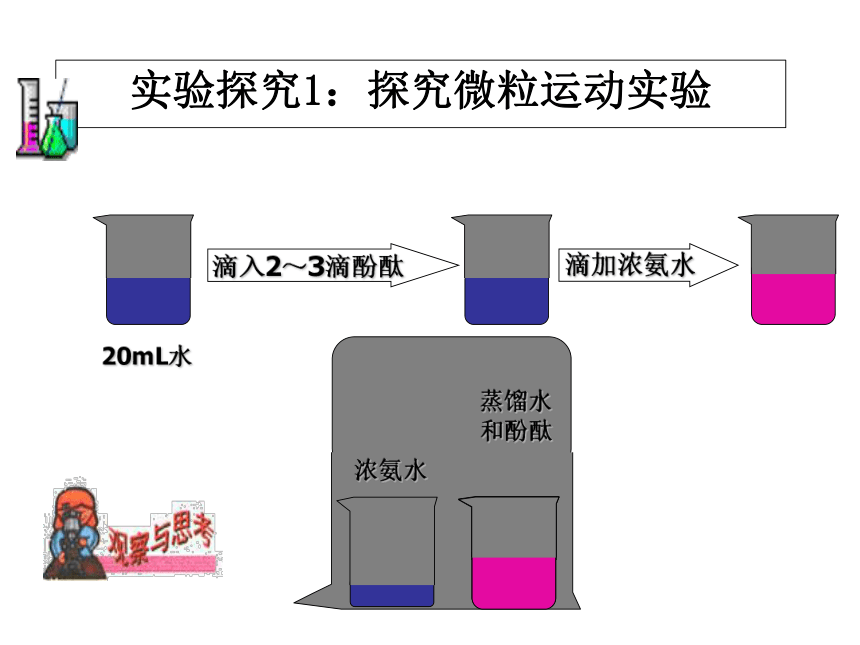
实验探究1:探究微粒运动实验滴入2~3滴酚酞滴加浓氨水1、氨水能使酚酞变红,而不是空气或水;
2、氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使酚酞变红。
3、微粒总在不停地做无规则的运动。结论想一想:1、探究微粒运动实验中,为什么烧杯B 中液体没有变红呢?
结论:构成物质的微粒虽然都在不停地做无规则的运动;但是不同的微粒运动情况不同。
日常生活中有什么事例可以说明构成物质的微粒在不断的运动吗?
用微粒的观点解释:湿衣服为什么会晒干?
为什么湿衣服在阳光照射的地方干燥的更快呢?
议一议微粒的运动速率与温度有关;
温度越高运动速率越快。分子的运动性微粒的性质
2、微粒总在不停地做无规则的运动。不同的微粒运动情况不同。温度越高运动速率越快。
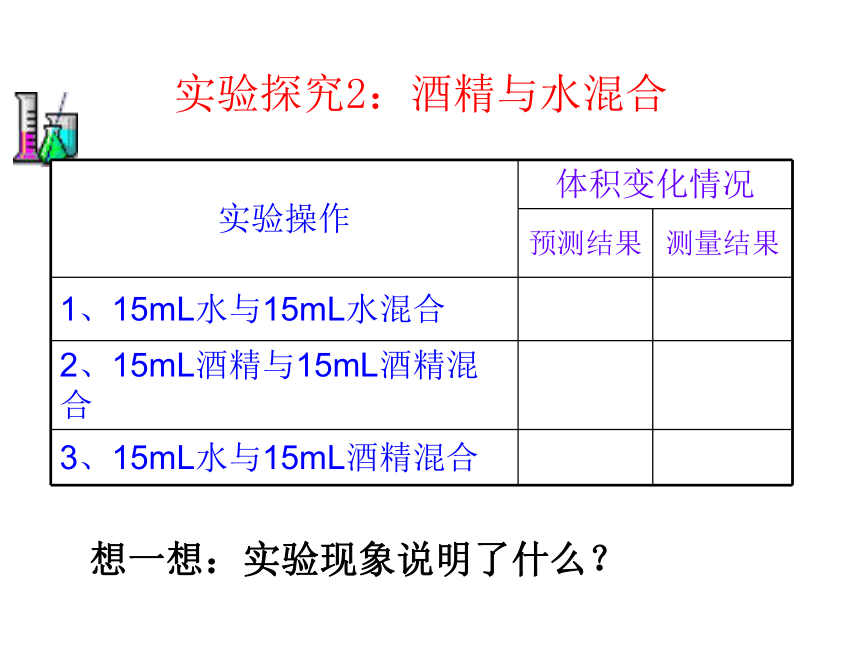
实验探究2:酒精与水混合想一想:实验现象说明了什么? 取一支针筒,抽取一定量的空气,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
在刚才的这支针筒内抽取相同量的水,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
思考:哪一支针筒内的物质容易被压缩?你知道其中的原因吗?
实验探究3:水和空气的压缩 影响微粒间空隙大小的因素: 1、温度:温度升高微粒间的空隙变大,温度降低微粒间的空隙变小。
2、物质的存在状态:一般来说,气体物质
中微粒间的空隙较大,液体、固体微粒间的
空隙较小。
物质状态的变化微观三维模拟动画固态固态 液态液态 气态构成物质的微粒之间都有一定的空隙;
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程;
在气体物质中,微粒之间的距离比较大;
气体容易被压缩。结论微粒的性质
3、微粒都有一定的空隙;气体物质中,微粒之间的距离比较大,固体物质中,微粒之间的距离比较小。
小结:2、微粒总在不停地做无规则的运动。3、构成物质的微粒间都有一定的间隙。1、物质都是由极其细小的、
肉眼看不见的微粒构成的1、以下生活、学习经验,不能说明微粒之间有空 隙的是( )
A 打气筒能将气体压缩
B 酒精和水混合,总体积变小
C 物体有热胀冷缩的现象
D 海绵能吸水
2、为什么“墙内开花墙外香”?D同步训练: 3、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明组成物质的微粒间___ _;在上述的一些变化中,物质的微粒本身_______仍然是原来的物质,所发生的变化属于____变化。不停地运动没有变化物理有空隙 4、选择左栏的“实验现象”和右栏“解释”之间相关的项填在答案栏中。BCAD构成物质的基本微粒 课时二:分子 原子 构成物质的基本粒子有分子、原子和离子
问题的提出1、水通电后会生成什么?
2、为什么生成的氢气和氧气不再具有水的性质?因为它们是由不同的微粒构成的 微粒不同性质不同一、分子不同物质具有不同的性质(构成物质的微粒不同)
氧气、氢气、水、二氧化碳都是由分子构成的
大量分子聚集形成物质
你知道吗? 一个水分子的质量大约是0.0000000000000000000000003千克,一滴水中大约有1700000000000000000000个水分子,一个氧原子的直径大约为0.000000000148米,如果把氧原子紧密地排列1.48厘米长的一列大约需要100000000个原子;如果将一滴水放大到地球一样大,那么,一个水分子是多大呢? 一、分子
1、分子是构成物质的一种微粒。如常见的水、氧气、氢气、二氧化碳、酒精、氮气等2、分子的基本性质:分子是构成物质的一种微粒,具有微粒的基本性质,分子的质量和体积都很小,分子在不停地运动,分子之间有间隙3、分子能保持物质化学性质(构成物质的微粒保持物质的化学性质)。同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同。但分子不保持物质的物理性质。
你能用分子的观点解释水蒸发吗?蒸发时,温度高,分子间空隙变大,但分子本身没有发生变化,是物理变化水电解时,水分子发生变化了吗在水电解过程中,发生变化的是什么?不变的又是什么?
物理变化与化学变化的本质区别是什么?
化学变化的实质分子1→原子→分子2 →新物质
分子分解成原子,原子重新组合成新分子
分子是否发生变化二、原子变化:分子,不变:原子 分析氧化汞受热分解模拟图氧化汞二、原子化学变化中,分子可以分成原子,而原子不能分。
原子是构成物质的又一种基本粒子,常见的金属(铁、铜、汞等)及稀有气体(如氦、氖等)、碳(金刚石、石墨等)、硅等都是由原子直接构成。
意大利化学家、物理学家阿佛加德罗(1776~1856)提出了分子学说。原子学说创始人--英国物理学家、化学家约翰·道尔顿。被称为“近代化学之父”,成为近代化学的奠基人。 人类对分子、原子的认识阿佛加德罗 道尔顿20世纪,许多用于表面研究的新技术相继问世,如扫描电子显微镜、电子探针、扫描隧道显微镜(STM)等,使人类能够看到分子原子的真是“长相”,并运用STM操纵原子分子,我国科学工作者通过STM操纵,用原子绘出祖国地图,用原子书写“中国”文字,用分子材料构造分子机械,将应用微型器件的构造技术推向世界先进水平。
人类对原子的认识通过移动硅原子构成的文字原子操纵术我来总结分子原子的联系和区别。1、很小 、彼此有间隔 、不停地运动
2、同种分子(原子)性质相同,不同种分子(原子)性质不相同。
3、都具有种类和数量的含义。
1、在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
1、原子是化学变化中的最小微粒。
2、在化学反应中,不可再分,不能变成其它原子。
分子由原子构成的,分子可以分解为构成它的原子。
1、请判断下列几种说法是否正确。1、分子大、原子小。2、分子能直接构成物质, 原子不能。3、分子能保持物质化学性质,原子不能。练习2、下列关于分子的说法,正确的是( )
A 只要分子没有改变,物质就没有发生任何变化
B 液态物质的分子肉眼看得见,气态物质的分子肉眼看不见
C 分子能保持物质的性质
D 分子之间都有间隙D3、水由 组成,
1个水分子由 构成。
4、在电解水的实验中,水的 破裂为氢
和氧 ,该反应的文字表达为: ,可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。(提示:填“分子”或“原子”) 氢元素和氧元素 两个氢原子和一个氧原子 分子 原子 原子 再分 原子 原子 5、通过反应示意图解答下列问题:
(1)该反应的基本反应类型为 反应。
(2)请分系以上微观过程模拟图,你能总结出的一条结论是:
。
甲 乙 丙分解在化学变化中分子可以在分而原子不能再分……从宏观上讲,物质发生物理变化时,是物质的状态或形状改变,并没有生成其他物质;物质发生化学变化时,有新物质生成;从微观上讲,发生物理变化是构成物质的分子的运动状况或间隔发生了变化,但分子本身没有改变,物质的化学性质不变。
发生化学变化时,构成物质的分子本身发生了改变,生成了其他物质的分子。6、用分子的观点解释物理变化和化学变化。
7、用分子的观点认识混合物和纯净物。
从宏观角度看,纯净物是由一种物质组成,而混合物是由两种或两种以上物质组成。从微观角度看,由分子构成的物质,如果是由同种分子构成的就是纯净物,如果是由不同种分子构成的就是混合物。由于同种分子性质相同,不同种分子性质不同,所以纯净物有固定的性质和组成,混合物则没有。
8、从分子、原子的角度分析,酒精蒸发与酒精燃烧这两种变化有什么不同,予以说明答案:酒精蒸发只是酒精分子间的间隔发生了变化,酒精分子没有变,属于物理变化;酒精燃烧是酒精和空气中的氧气反应,酒精分子和氧分子都分成了原子,这些原子由重新组合,构成二氧化碳分子和水分子,反应前后分子发生了变化,属于化学变化。课时三 原子的构成原子很小,原子还可以再分吗?原子并不是构成物质的最小微粒 (1897年) 发现了电子英国物理学家卢瑟福α粒子散射实验大部分α粒子(正电荷)直接穿透金属箔片;少数的α粒子方向明显发生大角度改变,极少数碰到坚硬不可穿透的质点弹回来归纳小结1、原子由位于中心的原子核(带正电荷)和核外电子(一个电子带一个单位负电荷)构成 。
2、原子核很小,但集中了几乎原子的全部质量;电子的质量小的多,几乎可以忽略。绕原子核高速运动。
3、原子核带正电荷和电子带负电荷电性相反,电量相等,原子呈电中性。原子核和电子还能被打开吗?卢瑟福α粒子轰击氮原子核 质子(一个质子带一个单位正电荷)
又预言了中子(不带电)存在,被证实。原子的构成
在原子中,核电荷数=质子数=核外电子数=原子序数问题:核内质子所带电荷数(质子数)与原子核所带电荷数(核电荷数)和核外电子所带电荷数(核外电子数)有什么关系?原子结构的探索 discovery道尔顿提出原子学说
汤姆生的“糖果布丁”模型
卢瑟福的行星模型现代原子结构电子在核外做无规则的高速运转知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……原子的质量测定值一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克原子的质量很小,记忆、计算都很不方便,怎么办?二、相对原子质量(Ar) 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。 你能找出相对原子质量与质子数和中子数之间的关系吗?相对原子质量≈质子数+中子数[练习]1、一个镁原子的质量为aKg,镁原子的相对原子质量24,求基准碳原子的质量。
2、钠原子的相对原子质量为( ),核电荷数为11,则钠原子由( )个质子和 12个中子构成一个原子核,核外有( )个电子作高速运动而构成相对分子质量等于构成分子的各原子的相对原子质量的总和,用Mr表示。举例:
Mr(A2BC)=2×Ar(A)+Ar(B)+Ar(c) 分子是由原子结合而成的,我们可以用相对分子质量表示分子质量的大小。 根据表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少。氧分子的相对分子质量 =水分子的相对分子质量 =CO2分子的相对分子质量 =16 + 16 = 321×2 + 16 = 18 12 + 16×2 = 44练习:计算相对分子质量K2CO3
C16H12N2O
Mg(NO3)2
5C6H6
kAl(SO4)2.12H20课时四 离子一、核外电子的排布1、核外电子的分层排布 在多个电子的原子里,核外电子是分层运动的,由里向外,电子能量渐增。原子核核内质子数电子层电子层上的电子个数2、原子结构示意图1、电子层符号K L M N O P Qn1 2 3 4 5 6 7 能量高低离核远近低高近远2、各电子层最多容纳的电子数2个 8个 18个 32个 …… 2n2个NeArHeLiBeNaMgAlHCBNOSiPF你能画出下列原子结构示意图吗?试试看!NeAr合作探究1:稀有气体元素
的原子结构He合作探究2:金属
元素
的原
子结
构LiBeNaMgAl合作探究3:非金属元素的原子结构HCBNOSiPF思考与讨论: 元素的分类、最外层电子数与元素化学性质有什么样的关系呢?金属元素非金属元素稀有气体元素小于4一般大于4等于8(氦等于2)易失去电子,不稳定易得到电子,不稳定不易得失电子,稳定元素的分类、最外层电子数、元素化学性质关系1.当原子得失电子后,
还显电中性吗?
2.原子得失电子后,所得到
的微粒如何称呼?提出问题离子Na+Cl-↓↓钠与氯气反应形成氯化钠氯化钠由________________构成.氯离子和钠离子结论:阳离子阴离子1、离子的形成2、离子 :带电荷的原子或原子团。Na+ Mg2+ NH4+(铵根离子) Cl- OH- SO42- (硫酸根离子) 讨论与交流:1、在原子中,质子数和电子数有何关系 ?Mg2+S2-2、在离子中,质子数和电子数又有何关系?原子中,质子数=电子数阳离子中,质子数>电子数阴离子中,质子数<电子数质子数=电子数质子数>电子数质子数<电子数不带电带正电带负电用元素符号表示
Na,S 用离子符号表示
Na+用离子符号表示
S2-原子阳离子阴离子原子与离子的区别分子原子构成再分物质构成构成元素组成离子小结:构成物质的基本微粒
1、构成物质的微粒极小,肉眼是看不见的。
实验探究1:探究微粒运动实验滴入2~3滴酚酞滴加浓氨水1、氨水能使酚酞变红,而不是空气或水;
2、氨水中的微粒从一只烧杯跑进另一烧杯中,发生化学变化,使酚酞变红。
3、微粒总在不停地做无规则的运动。结论想一想:1、探究微粒运动实验中,为什么烧杯B 中液体没有变红呢?
结论:构成物质的微粒虽然都在不停地做无规则的运动;但是不同的微粒运动情况不同。
日常生活中有什么事例可以说明构成物质的微粒在不断的运动吗?
用微粒的观点解释:湿衣服为什么会晒干?
为什么湿衣服在阳光照射的地方干燥的更快呢?
议一议微粒的运动速率与温度有关;
温度越高运动速率越快。分子的运动性微粒的性质
2、微粒总在不停地做无规则的运动。不同的微粒运动情况不同。温度越高运动速率越快。
实验探究2:酒精与水混合想一想:实验现象说明了什么? 取一支针筒,抽取一定量的空气,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
在刚才的这支针筒内抽取相同量的水,用手指堵出针筒末端的小孔,将栓塞慢慢推入,观察现象;
思考:哪一支针筒内的物质容易被压缩?你知道其中的原因吗?
实验探究3:水和空气的压缩 影响微粒间空隙大小的因素: 1、温度:温度升高微粒间的空隙变大,温度降低微粒间的空隙变小。
2、物质的存在状态:一般来说,气体物质
中微粒间的空隙较大,液体、固体微粒间的
空隙较小。
物质状态的变化微观三维模拟动画固态固态 液态液态 气态构成物质的微粒之间都有一定的空隙;
物质的“三态”变化实际上就是微粒之间的间隙发生改变的过程;
在气体物质中,微粒之间的距离比较大;
气体容易被压缩。结论微粒的性质
3、微粒都有一定的空隙;气体物质中,微粒之间的距离比较大,固体物质中,微粒之间的距离比较小。
小结:2、微粒总在不停地做无规则的运动。3、构成物质的微粒间都有一定的间隙。1、物质都是由极其细小的、
肉眼看不见的微粒构成的1、以下生活、学习经验,不能说明微粒之间有空 隙的是( )
A 打气筒能将气体压缩
B 酒精和水混合,总体积变小
C 物体有热胀冷缩的现象
D 海绵能吸水
2、为什么“墙内开花墙外香”?D同步训练: 3、打开食醋瓶盖时,闻到了刺激气味,表明微粒在_________;食盐能溶解在水里,说明组成物质的微粒间___ _;在上述的一些变化中,物质的微粒本身_______仍然是原来的物质,所发生的变化属于____变化。不停地运动没有变化物理有空隙 4、选择左栏的“实验现象”和右栏“解释”之间相关的项填在答案栏中。BCAD构成物质的基本微粒 课时二:分子 原子 构成物质的基本粒子有分子、原子和离子
问题的提出1、水通电后会生成什么?
2、为什么生成的氢气和氧气不再具有水的性质?因为它们是由不同的微粒构成的 微粒不同性质不同一、分子不同物质具有不同的性质(构成物质的微粒不同)
氧气、氢气、水、二氧化碳都是由分子构成的
大量分子聚集形成物质
你知道吗? 一个水分子的质量大约是0.0000000000000000000000003千克,一滴水中大约有1700000000000000000000个水分子,一个氧原子的直径大约为0.000000000148米,如果把氧原子紧密地排列1.48厘米长的一列大约需要100000000个原子;如果将一滴水放大到地球一样大,那么,一个水分子是多大呢? 一、分子
1、分子是构成物质的一种微粒。如常见的水、氧气、氢气、二氧化碳、酒精、氮气等2、分子的基本性质:分子是构成物质的一种微粒,具有微粒的基本性质,分子的质量和体积都很小,分子在不停地运动,分子之间有间隙3、分子能保持物质化学性质(构成物质的微粒保持物质的化学性质)。同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同。但分子不保持物质的物理性质。
你能用分子的观点解释水蒸发吗?蒸发时,温度高,分子间空隙变大,但分子本身没有发生变化,是物理变化水电解时,水分子发生变化了吗在水电解过程中,发生变化的是什么?不变的又是什么?
物理变化与化学变化的本质区别是什么?
化学变化的实质分子1→原子→分子2 →新物质
分子分解成原子,原子重新组合成新分子
分子是否发生变化二、原子变化:分子,不变:原子 分析氧化汞受热分解模拟图氧化汞二、原子化学变化中,分子可以分成原子,而原子不能分。
原子是构成物质的又一种基本粒子,常见的金属(铁、铜、汞等)及稀有气体(如氦、氖等)、碳(金刚石、石墨等)、硅等都是由原子直接构成。
意大利化学家、物理学家阿佛加德罗(1776~1856)提出了分子学说。原子学说创始人--英国物理学家、化学家约翰·道尔顿。被称为“近代化学之父”,成为近代化学的奠基人。 人类对分子、原子的认识阿佛加德罗 道尔顿20世纪,许多用于表面研究的新技术相继问世,如扫描电子显微镜、电子探针、扫描隧道显微镜(STM)等,使人类能够看到分子原子的真是“长相”,并运用STM操纵原子分子,我国科学工作者通过STM操纵,用原子绘出祖国地图,用原子书写“中国”文字,用分子材料构造分子机械,将应用微型器件的构造技术推向世界先进水平。
人类对原子的认识通过移动硅原子构成的文字原子操纵术我来总结分子原子的联系和区别。1、很小 、彼此有间隔 、不停地运动
2、同种分子(原子)性质相同,不同种分子(原子)性质不相同。
3、都具有种类和数量的含义。
1、在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
1、原子是化学变化中的最小微粒。
2、在化学反应中,不可再分,不能变成其它原子。
分子由原子构成的,分子可以分解为构成它的原子。
1、请判断下列几种说法是否正确。1、分子大、原子小。2、分子能直接构成物质, 原子不能。3、分子能保持物质化学性质,原子不能。练习2、下列关于分子的说法,正确的是( )
A 只要分子没有改变,物质就没有发生任何变化
B 液态物质的分子肉眼看得见,气态物质的分子肉眼看不见
C 分子能保持物质的性质
D 分子之间都有间隙D3、水由 组成,
1个水分子由 构成。
4、在电解水的实验中,水的 破裂为氢
和氧 ,该反应的文字表达为: ,可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。(提示:填“分子”或“原子”) 氢元素和氧元素 两个氢原子和一个氧原子 分子 原子 原子 再分 原子 原子 5、通过反应示意图解答下列问题:
(1)该反应的基本反应类型为 反应。
(2)请分系以上微观过程模拟图,你能总结出的一条结论是:
。
甲 乙 丙分解在化学变化中分子可以在分而原子不能再分……从宏观上讲,物质发生物理变化时,是物质的状态或形状改变,并没有生成其他物质;物质发生化学变化时,有新物质生成;从微观上讲,发生物理变化是构成物质的分子的运动状况或间隔发生了变化,但分子本身没有改变,物质的化学性质不变。
发生化学变化时,构成物质的分子本身发生了改变,生成了其他物质的分子。6、用分子的观点解释物理变化和化学变化。
7、用分子的观点认识混合物和纯净物。
从宏观角度看,纯净物是由一种物质组成,而混合物是由两种或两种以上物质组成。从微观角度看,由分子构成的物质,如果是由同种分子构成的就是纯净物,如果是由不同种分子构成的就是混合物。由于同种分子性质相同,不同种分子性质不同,所以纯净物有固定的性质和组成,混合物则没有。
8、从分子、原子的角度分析,酒精蒸发与酒精燃烧这两种变化有什么不同,予以说明答案:酒精蒸发只是酒精分子间的间隔发生了变化,酒精分子没有变,属于物理变化;酒精燃烧是酒精和空气中的氧气反应,酒精分子和氧分子都分成了原子,这些原子由重新组合,构成二氧化碳分子和水分子,反应前后分子发生了变化,属于化学变化。课时三 原子的构成原子很小,原子还可以再分吗?原子并不是构成物质的最小微粒 (1897年) 发现了电子英国物理学家卢瑟福α粒子散射实验大部分α粒子(正电荷)直接穿透金属箔片;少数的α粒子方向明显发生大角度改变,极少数碰到坚硬不可穿透的质点弹回来归纳小结1、原子由位于中心的原子核(带正电荷)和核外电子(一个电子带一个单位负电荷)构成 。
2、原子核很小,但集中了几乎原子的全部质量;电子的质量小的多,几乎可以忽略。绕原子核高速运动。
3、原子核带正电荷和电子带负电荷电性相反,电量相等,原子呈电中性。原子核和电子还能被打开吗?卢瑟福α粒子轰击氮原子核 质子(一个质子带一个单位正电荷)
又预言了中子(不带电)存在,被证实。原子的构成
在原子中,核电荷数=质子数=核外电子数=原子序数问题:核内质子所带电荷数(质子数)与原子核所带电荷数(核电荷数)和核外电子所带电荷数(核外电子数)有什么关系?原子结构的探索 discovery道尔顿提出原子学说
汤姆生的“糖果布丁”模型
卢瑟福的行星模型现代原子结构电子在核外做无规则的高速运转知识的延伸实验证明,质子和中子是由更小的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……原子的质量测定值一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克原子的质量很小,记忆、计算都很不方便,怎么办?二、相对原子质量(Ar) 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。 你能找出相对原子质量与质子数和中子数之间的关系吗?相对原子质量≈质子数+中子数[练习]1、一个镁原子的质量为aKg,镁原子的相对原子质量24,求基准碳原子的质量。
2、钠原子的相对原子质量为( ),核电荷数为11,则钠原子由( )个质子和 12个中子构成一个原子核,核外有( )个电子作高速运动而构成相对分子质量等于构成分子的各原子的相对原子质量的总和,用Mr表示。举例:
Mr(A2BC)=2×Ar(A)+Ar(B)+Ar(c) 分子是由原子结合而成的,我们可以用相对分子质量表示分子质量的大小。 根据表3-4相对原子质量的数据,算一算氧气(O2)、水(H2O)、二氧化碳(CO2)分子的相对分子质量是多少。氧分子的相对分子质量 =水分子的相对分子质量 =CO2分子的相对分子质量 =16 + 16 = 321×2 + 16 = 18 12 + 16×2 = 44练习:计算相对分子质量K2CO3
C16H12N2O
Mg(NO3)2
5C6H6
kAl(SO4)2.12H20课时四 离子一、核外电子的排布1、核外电子的分层排布 在多个电子的原子里,核外电子是分层运动的,由里向外,电子能量渐增。原子核核内质子数电子层电子层上的电子个数2、原子结构示意图1、电子层符号K L M N O P Qn1 2 3 4 5 6 7 能量高低离核远近低高近远2、各电子层最多容纳的电子数2个 8个 18个 32个 …… 2n2个NeArHeLiBeNaMgAlHCBNOSiPF你能画出下列原子结构示意图吗?试试看!NeAr合作探究1:稀有气体元素
的原子结构He合作探究2:金属
元素
的原
子结
构LiBeNaMgAl合作探究3:非金属元素的原子结构HCBNOSiPF思考与讨论: 元素的分类、最外层电子数与元素化学性质有什么样的关系呢?金属元素非金属元素稀有气体元素小于4一般大于4等于8(氦等于2)易失去电子,不稳定易得到电子,不稳定不易得失电子,稳定元素的分类、最外层电子数、元素化学性质关系1.当原子得失电子后,
还显电中性吗?
2.原子得失电子后,所得到
的微粒如何称呼?提出问题离子Na+Cl-↓↓钠与氯气反应形成氯化钠氯化钠由________________构成.氯离子和钠离子结论:阳离子阴离子1、离子的形成2、离子 :带电荷的原子或原子团。Na+ Mg2+ NH4+(铵根离子) Cl- OH- SO42- (硫酸根离子) 讨论与交流:1、在原子中,质子数和电子数有何关系 ?Mg2+S2-2、在离子中,质子数和电子数又有何关系?原子中,质子数=电子数阳离子中,质子数>电子数阴离子中,质子数<电子数质子数=电子数质子数>电子数质子数<电子数不带电带正电带负电用元素符号表示
Na,S 用离子符号表示
Na+用离子符号表示
S2-原子阳离子阴离子原子与离子的区别分子原子构成再分物质构成构成元素组成离子小结:构成物质的基本微粒
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
