探索碱的性质[上学期]
图片预览











文档简介
课件35张PPT。第3节 探索碱的性质你知道生活中酸性的食物 吗?知识回顾常见食物的酸性:牛肉、猪肉、鸡肉、金枪鱼、牡蛎、目鱼、奶酪、米、麦、面包、酒类、花生、薄肠、糖、饼干、白糖等。火腿、鸡蛋、龙虾、章鱼、鱿鱼、奶油、豌豆、鳗鱼、河鱼、巧克力、葱、粉、炸豆腐等。其实很多食物是碱性的。你还知道生活中碱性的食物 吗?常见食物的碱性: 牛乳、茶、柿子、黄瓜、胡萝卜、萝卜、菠菜、柑橘类、葡萄、芋头、海带、葡萄干、马铃薯、卷心菜、笋、香菇类、油菜、南瓜、豆腐、苹果、梨、香蕉、樱桃等。你去尝一个未成熟的柿子,会有什么感觉?思 考涩 味这是因为柿子里含有 物质碱性食用碱性食品时会感到涩味,洗澡时不小心有肥皂泡溅到嘴里也有这种感觉。碱还有哪些性质呢?一、碱有哪些性质 实验1、酸碱指示剂和pH试纸与碱的作用变红变蓝 PH > 7变红变蓝 PH > 7碱性溶液能使紫色石蕊变蓝,无色酚酞变红.结论: 二、什么是碱?思考:电离产物的共同之处是什么?NaOH = Na+ + OH– Ca(OH)2= Ca+ +2OH– Ba(OH)2 =Ba++2OH– KOH = K + + OH–碱的涵义:电离出的阴离子全部是氢氧根离子OH-的一类化合物。P17实验2:氢氧化钠溶液与酸反应 1、在2支分别盛有3毫升氢氧化钠稀溶液的试管里,各滴入1滴酚酞试液,分别向2支试管里逐滴加稀盐酸和稀硫酸,边滴边振荡,直到红色刚好变成无色。2、用滴管吸取反应后的溶液滴在蒸发皿中,在小火上烘干,蒸发皿上留下了什么?这说明溶液的酸碱性发生了什么变化? 变成中性白色的晶体。思考化学方程式:NaOH + HCl = NaCl + H2O
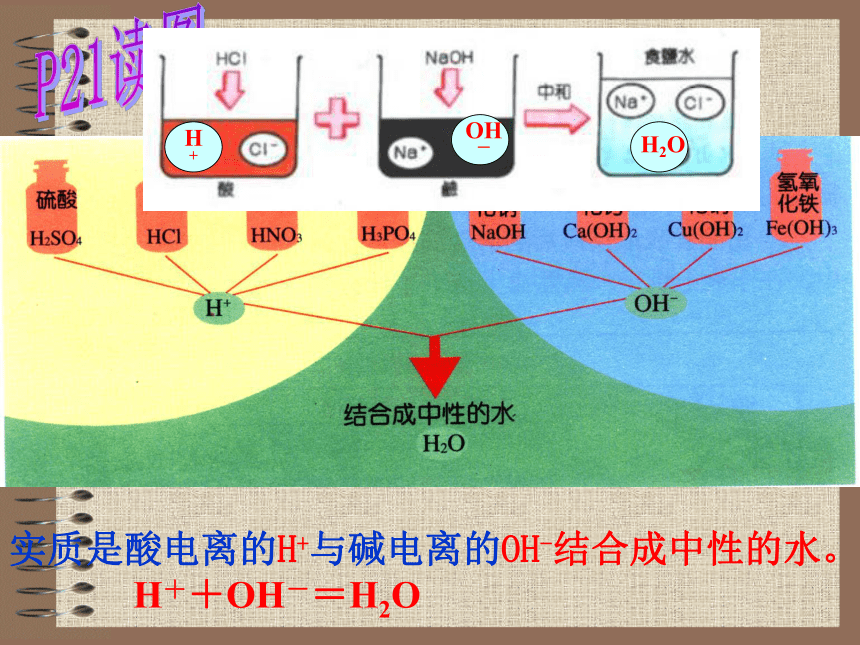
2NaOH + H2SO4 = Na2SO4 + 2H2O碱 + 酸 = 盐 + 水碱跟酸作用生成盐和水的反应叫中和反应。 你知道中和反应在工农业生产、生活和科学实验中有什么应用?思 考施加熟石灰[Ca(OH)2]改良酸性土壤、中和过量的酸;精制石油时,用氢氧化钠来中和过量的酸等。P21读图根据下图说出中和反应的实质。实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O 用什么办法能够知道在稀盐酸和氢氧化钠溶液的中和反应过程中,酸和碱没有剩余,恰好完全反应?使用指示剂,如用无色酚酞或紫色石蕊试液pH试纸来检验。思 考 检验CO2气体的存在P18实验③:向一支盛有澄清石灰水的试管中通入二氧化碳,观察发生了什么现象:化学反应方程式:
CO2 + Ca(OH)2 = CaCO3↓+ H2O澄清石灰水变浑浊。非金属氧化物+碱 = 盐 + 水CO2+H2O=H2CO3
SO2+H2O=H2SO3
SO3+H2O=H2SO4非金属氧化物+水=酸思 考 1、二氧化硫排入大气有何危害?工业上常用氢氧化钠溶液来吸收二氧化硫 SO2+2NaOH=Na2SO3+H2O
亚硫酸钠工业上常用碱溶液来吸收有毒的酸性气体SO3+2NaOH=Na2SO4+H2O
硫酸钠
CO2+2NaOH=Na2CO3+H2O
碳酸钠 3、氢氧化钠或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O思 考 2、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞?而是用橡皮塞或木塞。SiO2+2NaOH=Na2SiO3+H2OP19实验④
1、在2支试管中分别注入2-3毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?氯化铜显绿色,氯化铁显黄色。2、在上述2支试管中分别滴加1毫升氢氧化钠溶液,试管中发生了什么变化?检验铜离子Cu2+或氢氧根离子OH-的存在检验铁离子Fe3+或氢氧根离子OH-的存在CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl 绿色 无色 蓝色絮状沉淀 无色FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl黄色 红褐色絮状沉淀盐 + 碱 = 新碱 + 新盐化学反应方程式: 产生蓝色絮状沉淀和红褐色絮状沉淀 你知道碱具有哪些共性?1、碱性溶液能使紫色石蕊变蓝,无色酚酞变红.2、碱跟酸作用生成盐和水这种反应也叫中和反应。3、非金属氧化物跟碱反应生成盐和水4、盐和碱反应生成新碱 和新盐盐+碱= 新碱+新盐非金属氧化物+碱= 盐 + 水碱 + 酸 = 盐 + 水注意:盐和碱必需都是可溶性的可溶性碱都能满足以上四条性质,难溶性碱只能满足第2条。 1.以Ba(OH)2为例,分别写出它与CO2、HCl、H2SO4 、CuCl2、FeCl3的反应。练 习Ba(OH)2+CO2= BaCO3 ↓ +H2O
Ba(OH)2+ 2HCl= BaCl2+H2O
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
Ba(OH)2+CuCl2=BaCl2+Cu(OH)2 ↓
3Ba(OH)2+2FeCl3=3BaCl2+2Fe(OH)3 ↓2.蜜蜂或蚊虫的分泌物含有酸性物质,如果被这些昆虫叮咬,可用弱碱性溶液如______________________涂抹,以减轻红肿痛痒。被黄蜂蜇伤的部位会带有碱性,可以用弱酸溶液如_____中和。碳酸氢钠溶液、肥皂水醋碱的个性知识回顾1、碱有哪些通性?
2、要注意哪些事项?强碱: KOH、 NaOH
Ca(OH)2 Ba(OH)2
弱碱:氨水、氢氧化铝、氢氧化镁、氢氧化锌等。碱的分类:1、氢氧化钠俗名:烧碱、火碱和苛性钠2、氢氧化钠用途烧 碱氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织、印染等工业。但是日常生中直接使用氢氧化钠的情况是比较少的,它并不是面粉发酵后使用的“碱”,也不是洗涤油污使用的“碱”。在饮食和洗涤方面所用的“碱”实际上都纯碱——碳酸钠,而不是烧碱——氢氧化钠。氢氧化钠的主要用途是在工业上。例如,我国四大发明之一的造纸,其生产过程中氢氧化钠就起到溶解造纸原料——木材或草类植物里的非纤维素成分的作用,从而得到以纤维素为主要成分的纸浆。在纺织印染工业中,一般先将棉织品于适当温度在稀氢氧化钠深液中浸泡蒸煮,这样除掉棉织品表面的覆盖物,才能使染色均匀、牢固。在以上二例中都是利用了氢氧化钠的腐蚀性,可见腐蚀性有其破坏性的一面,也有可利用的一面。在精炼石油的过程中,主要是利用氢氧化钠与酸发生中和反应的性质除去精炼过程中剩余的硫酸和其它酸性物质。 碱是制造许多产品的重要原料。水管清洁剂含有
氢氧化钠(碱液)家用氨类清洁剂
的腐蚀性较小碱和健康氢氧化镁和氢氧化铝可以治疗对人体不利的胃酸过多症。碱和工业灰浆和水泥是用碱性的氢氧
化钙制取的。园丁有时把氢
氧化钙加到土壤中,减小土
壤的酸性,以利于作物的生长①阅读氢氧化钠试剂瓶的标签。
用镊子取出一小块NaOH固体放在表面皿上。
②让学生观察刚取出的NaOH颜色、状态、表面干燥情况,放置几分钟后表面状态有什么变化?P20实验1:白色固体、放置几分钟后表面变潮湿。氢氧化钠固体可作某些气体(中性气体:氢气H2、氧气O2、一氧化碳CO、氮气N2;碱性气体:氨气NH3)的干燥剂。物质暴露在空气中因吸收空气中的水分,表面潮湿并逐渐溶解的现象叫潮解。注意:氢氧化钠会与酸性气体反应,不能干燥酸性气体(HCl、CO2、 SO2、SO3 、 H2S等)③将玻璃皿中的NaOH移入试管中,加入少量水(3毫升左右),用手触摸试管底部,注意温度有什么变化。极易溶于水、试管底部发热。
溶解时放出大量的热。④1)用玻璃棒沾取少量溶液。2)将得到的溶液抹在纸上,过一会儿观察到什么现象?具有强烈的腐蚀性 ⑤将2)中的溶液稀释(加水约半试管),用玻璃棒沾取此溶液抹在手指上捻一捻有什么感觉,然后立即用水冲洗手指。碱的水溶液有滑腻感。⑥把一小撮兔毛或全毛绒线放入盛有烧碱溶液的试管中,加热煮沸后观察现象:兔毛或毛线被溶解羊毛在碱性条件下易发生水解,即不耐碱。金属氧化物+水=碱2、氢氧化钙实验2:1)、氢氧化钙溶液中滴入盐酸和稀硫酸溶液,观察有什么变化发生?化学反应方程式:Ca(OH )2 + 2HCl = Ca Cl2+ 2H2OCa(OH )2 + H2SO4= Ca SO4+2H2O 碱 + 酸 = 盐 + 水没有变化俗名:熟石灰、消石灰、石灰浆、石灰乳
其水溶液俗称为石灰水,有腐蚀性。生石灰(CaO)跟水起反应,生成氢氧化钙,同时放出大量的热。CaO+H2O=Ca(OH)2要用指示剂才能观察到变化的发生。(2)在碳酸钠溶液和氯化铁溶液中滴加氢氧化钙溶液,有何变化?产生白色沉淀和红褐色沉淀化学反应方程式:Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH 3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2鉴别铁Fe3+离子或氢氧根离子OH- 碱 + 盐 =新碱 + 新盐 有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。在这个过程发生了哪些化学变化?写出有关的化学方程式。思考化学反应方程式: CO2 + Ca(OH)2 = CaCO3↓+ H2O因为放一盆炭火可以使室内二氧化碳的浓度增大,二氧化碳与石灰水反应生成白色沉淀碳酸钙和水,墙面变得潮湿,而且室内的温度会升高,有利于反应的进行,过几天水蒸发后墙壁就变得又硬又白了。小结:烧碱的个性:氢氧化钠NaOH:俗称烧碱、火碱、苛性钠(1)物理性质:白色固体,极易溶解于水并放出大量的热;有吸水性,易潮解;水溶液有涩味和滑腻感。(3)强碱,有很强的腐蚀性。(2)氢氧化钠是一种碱性干燥剂 干燥范围:碱性气体 (NH3) 中性气体 (H2、O2、N2 、 CO等) 注意:不能干燥酸性气体(HCl、CO2、 SO2、SO3 、 H2S等) 氢氧化钠必须密封保存(4)暴露在空气中易变质:2NaOH + CO2 = Na2CO3 + H2O氢氧化钠NaOH固体长时间显露在空气中会潮解,经充分干燥后,该固体Na2CO3的质量增大。说说氢氧化钠的用途。
2NaOH + H2SO4 = Na2SO4 + 2H2O碱 + 酸 = 盐 + 水碱跟酸作用生成盐和水的反应叫中和反应。 你知道中和反应在工农业生产、生活和科学实验中有什么应用?思 考施加熟石灰[Ca(OH)2]改良酸性土壤、中和过量的酸;精制石油时,用氢氧化钠来中和过量的酸等。P21读图根据下图说出中和反应的实质。实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O 用什么办法能够知道在稀盐酸和氢氧化钠溶液的中和反应过程中,酸和碱没有剩余,恰好完全反应?使用指示剂,如用无色酚酞或紫色石蕊试液pH试纸来检验。思 考 检验CO2气体的存在P18实验③:向一支盛有澄清石灰水的试管中通入二氧化碳,观察发生了什么现象:化学反应方程式:
CO2 + Ca(OH)2 = CaCO3↓+ H2O澄清石灰水变浑浊。非金属氧化物+碱 = 盐 + 水CO2+H2O=H2CO3
SO2+H2O=H2SO3
SO3+H2O=H2SO4非金属氧化物+水=酸思 考 1、二氧化硫排入大气有何危害?工业上常用氢氧化钠溶液来吸收二氧化硫 SO2+2NaOH=Na2SO3+H2O
亚硫酸钠工业上常用碱溶液来吸收有毒的酸性气体SO3+2NaOH=Na2SO4+H2O
硫酸钠
CO2+2NaOH=Na2CO3+H2O
碳酸钠 3、氢氧化钠或氢氧化钠溶液不能敞口放置,为什么? CO2+2NaOH=Na2CO3+H2O思 考 2、盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞?而是用橡皮塞或木塞。SiO2+2NaOH=Na2SiO3+H2OP19实验④
1、在2支试管中分别注入2-3毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色?氯化铜显绿色,氯化铁显黄色。2、在上述2支试管中分别滴加1毫升氢氧化钠溶液,试管中发生了什么变化?检验铜离子Cu2+或氢氧根离子OH-的存在检验铁离子Fe3+或氢氧根离子OH-的存在CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl 绿色 无色 蓝色絮状沉淀 无色FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl黄色 红褐色絮状沉淀盐 + 碱 = 新碱 + 新盐化学反应方程式: 产生蓝色絮状沉淀和红褐色絮状沉淀 你知道碱具有哪些共性?1、碱性溶液能使紫色石蕊变蓝,无色酚酞变红.2、碱跟酸作用生成盐和水这种反应也叫中和反应。3、非金属氧化物跟碱反应生成盐和水4、盐和碱反应生成新碱 和新盐盐+碱= 新碱+新盐非金属氧化物+碱= 盐 + 水碱 + 酸 = 盐 + 水注意:盐和碱必需都是可溶性的可溶性碱都能满足以上四条性质,难溶性碱只能满足第2条。 1.以Ba(OH)2为例,分别写出它与CO2、HCl、H2SO4 、CuCl2、FeCl3的反应。练 习Ba(OH)2+CO2= BaCO3 ↓ +H2O
Ba(OH)2+ 2HCl= BaCl2+H2O
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
Ba(OH)2+CuCl2=BaCl2+Cu(OH)2 ↓
3Ba(OH)2+2FeCl3=3BaCl2+2Fe(OH)3 ↓2.蜜蜂或蚊虫的分泌物含有酸性物质,如果被这些昆虫叮咬,可用弱碱性溶液如______________________涂抹,以减轻红肿痛痒。被黄蜂蜇伤的部位会带有碱性,可以用弱酸溶液如_____中和。碳酸氢钠溶液、肥皂水醋碱的个性知识回顾1、碱有哪些通性?
2、要注意哪些事项?强碱: KOH、 NaOH
Ca(OH)2 Ba(OH)2
弱碱:氨水、氢氧化铝、氢氧化镁、氢氧化锌等。碱的分类:1、氢氧化钠俗名:烧碱、火碱和苛性钠2、氢氧化钠用途烧 碱氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织、印染等工业。但是日常生中直接使用氢氧化钠的情况是比较少的,它并不是面粉发酵后使用的“碱”,也不是洗涤油污使用的“碱”。在饮食和洗涤方面所用的“碱”实际上都纯碱——碳酸钠,而不是烧碱——氢氧化钠。氢氧化钠的主要用途是在工业上。例如,我国四大发明之一的造纸,其生产过程中氢氧化钠就起到溶解造纸原料——木材或草类植物里的非纤维素成分的作用,从而得到以纤维素为主要成分的纸浆。在纺织印染工业中,一般先将棉织品于适当温度在稀氢氧化钠深液中浸泡蒸煮,这样除掉棉织品表面的覆盖物,才能使染色均匀、牢固。在以上二例中都是利用了氢氧化钠的腐蚀性,可见腐蚀性有其破坏性的一面,也有可利用的一面。在精炼石油的过程中,主要是利用氢氧化钠与酸发生中和反应的性质除去精炼过程中剩余的硫酸和其它酸性物质。 碱是制造许多产品的重要原料。水管清洁剂含有
氢氧化钠(碱液)家用氨类清洁剂
的腐蚀性较小碱和健康氢氧化镁和氢氧化铝可以治疗对人体不利的胃酸过多症。碱和工业灰浆和水泥是用碱性的氢氧
化钙制取的。园丁有时把氢
氧化钙加到土壤中,减小土
壤的酸性,以利于作物的生长①阅读氢氧化钠试剂瓶的标签。
用镊子取出一小块NaOH固体放在表面皿上。
②让学生观察刚取出的NaOH颜色、状态、表面干燥情况,放置几分钟后表面状态有什么变化?P20实验1:白色固体、放置几分钟后表面变潮湿。氢氧化钠固体可作某些气体(中性气体:氢气H2、氧气O2、一氧化碳CO、氮气N2;碱性气体:氨气NH3)的干燥剂。物质暴露在空气中因吸收空气中的水分,表面潮湿并逐渐溶解的现象叫潮解。注意:氢氧化钠会与酸性气体反应,不能干燥酸性气体(HCl、CO2、 SO2、SO3 、 H2S等)③将玻璃皿中的NaOH移入试管中,加入少量水(3毫升左右),用手触摸试管底部,注意温度有什么变化。极易溶于水、试管底部发热。
溶解时放出大量的热。④1)用玻璃棒沾取少量溶液。2)将得到的溶液抹在纸上,过一会儿观察到什么现象?具有强烈的腐蚀性 ⑤将2)中的溶液稀释(加水约半试管),用玻璃棒沾取此溶液抹在手指上捻一捻有什么感觉,然后立即用水冲洗手指。碱的水溶液有滑腻感。⑥把一小撮兔毛或全毛绒线放入盛有烧碱溶液的试管中,加热煮沸后观察现象:兔毛或毛线被溶解羊毛在碱性条件下易发生水解,即不耐碱。金属氧化物+水=碱2、氢氧化钙实验2:1)、氢氧化钙溶液中滴入盐酸和稀硫酸溶液,观察有什么变化发生?化学反应方程式:Ca(OH )2 + 2HCl = Ca Cl2+ 2H2OCa(OH )2 + H2SO4= Ca SO4+2H2O 碱 + 酸 = 盐 + 水没有变化俗名:熟石灰、消石灰、石灰浆、石灰乳
其水溶液俗称为石灰水,有腐蚀性。生石灰(CaO)跟水起反应,生成氢氧化钙,同时放出大量的热。CaO+H2O=Ca(OH)2要用指示剂才能观察到变化的发生。(2)在碳酸钠溶液和氯化铁溶液中滴加氢氧化钙溶液,有何变化?产生白色沉淀和红褐色沉淀化学反应方程式:Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH 3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2鉴别铁Fe3+离子或氢氧根离子OH- 碱 + 盐 =新碱 + 新盐 有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。在这个过程发生了哪些化学变化?写出有关的化学方程式。思考化学反应方程式: CO2 + Ca(OH)2 = CaCO3↓+ H2O因为放一盆炭火可以使室内二氧化碳的浓度增大,二氧化碳与石灰水反应生成白色沉淀碳酸钙和水,墙面变得潮湿,而且室内的温度会升高,有利于反应的进行,过几天水蒸发后墙壁就变得又硬又白了。小结:烧碱的个性:氢氧化钠NaOH:俗称烧碱、火碱、苛性钠(1)物理性质:白色固体,极易溶解于水并放出大量的热;有吸水性,易潮解;水溶液有涩味和滑腻感。(3)强碱,有很强的腐蚀性。(2)氢氧化钠是一种碱性干燥剂 干燥范围:碱性气体 (NH3) 中性气体 (H2、O2、N2 、 CO等) 注意:不能干燥酸性气体(HCl、CO2、 SO2、SO3 、 H2S等) 氢氧化钠必须密封保存(4)暴露在空气中易变质:2NaOH + CO2 = Na2CO3 + H2O氢氧化钠NaOH固体长时间显露在空气中会潮解,经充分干燥后,该固体Na2CO3的质量增大。说说氢氧化钠的用途。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
