中考复习-空气的复习[下学期]
图片预览










文档简介
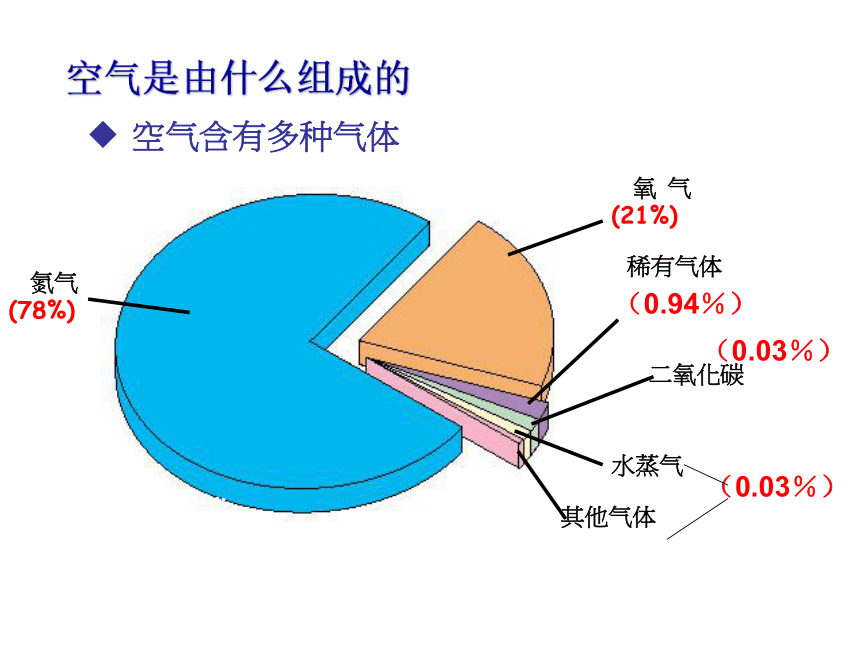
课件69张PPT。空气 一、空气的主要成分空气是由什么组成的空气含有多种气体其他气体二氧化碳(0.94%)
(0.03%)
(0.03%)
根据作用指出气体的名称稀有气体(0.94%)按体积算氮气(78%)氧气(21%)其他气体(1%)二氧化碳(0.03%)水蒸气等其他杂质(0.03%)冲入灯泡延长使用寿命,用于食品防腐、保鲜,液态氮可作冷冻剂,是制作化肥、炸药的原料供给生物呼吸,支持燃料的燃烧用作保护气,制成各种用途的霓虹灯光合作用原料,用于制造纯碱、尿素、汽水饮料可用于人工降雨,还可用于灭火根据下列现象说明空气中存在着某种气体物质,将物质填在空格内。
(1)小白鼠在装有空气的密闭容器中可存活一段时间,说明空气中含有____。
(2)石灰水长期露置于空气中,瓶壁和石灰水底部均会出现白色固体,说明空气中含有_____。
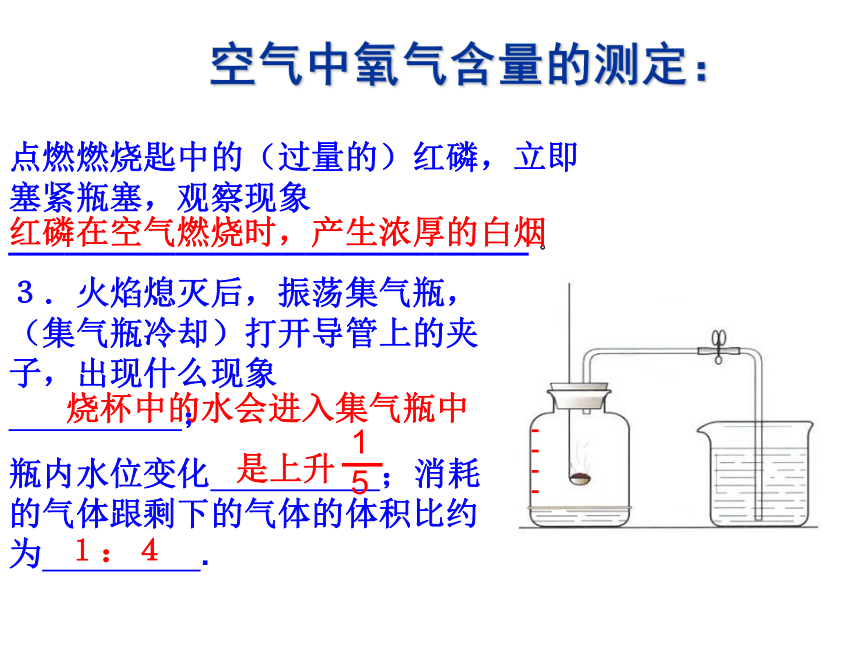
(3)夏天,盛放棒冰的杯子外壁上附有一层水珠,说明空气中含有____。点燃燃烧匙中的(过量的)红磷,立即塞紧瓶塞,观察现象____________________________ 。红磷在空气燃烧时,产生浓厚的白烟 3.火焰熄灭后,振荡集气瓶,(集气瓶冷却)打开导管上的夹子,出现什么现象 ;
瓶内水位变化 ;消耗的气体跟剩下的气体的体积比约为 .烧杯中的水会进入集气瓶中 是上升1:4空气中氧气含量的测定:你认为包装袋中充的可能是什么气体?阐述你的理由。若想进一步验证,该如何设计方案?二、大气压一、大气压的存在:大气压强生活中哪些现象可以证明大气压的存在?大气压的实验证明:
历史上著名的实验-马德堡半球实验。首次测量出大气压的值的科学家是托里拆利(意大利)12376厘米水银1标准大气压=__mmHg=_____Pa空盒气压计水银气压计二、大气压的测量7601.01×105大气压的特点:
大气压随高度增加而减小,且大气压的值与地点、天气、季节、的变化有关。一般来说,晴天大气压比阴天高,冬天比夏天高。 三、大气压的特点:为什么用高压锅烧饭容易熟?沸点与压强:一切液体的沸点,气压增大时升高。沸点与压强:一切液体的沸点,气压减小时降低,练习:
☆测得马德堡半球实验直径30cm则马德堡半球上受到得压力约多大。F=pS=1.01×105Pa×0.707 m2=7.14×103N气压对液体沸点的影响气压高 液体沸点高
气压低 液体沸点低气压高 气体液化温度高
气压低 气体液化温度低思考:要将氧气变成液态,可以采取哪些方法?降温加压高气压区 晴燥天气
低气压区 阴雨天气气压对天气的影响 晴朗天气人们的心情一般比阴雨天气好些氧气和二氧化碳比较氧气和二氧化碳的物理性质无色无味气态常温常压不易溶于水比空气大无色无味气态微溶于水比空气大根据它们的物理性质有哪些用途? 实验室收集氧气和二氧化碳时,可以选用什么装置?排水法向上排空气法向下排空气法氧气二氧化碳氧气练习1、既能用排水法,又能用向上排空气法收集的气体必须具备的性质是( )。
A.易溶于水,密度大于空气
B.易溶于水,密度小于空气
C.不易溶于水,密度大于空气
D.难溶于水,密度小于空气
C氧气的用途助燃供给呼吸氧化性氧气的化学性质提高炉内的温度氧气急救病人燃烧:可燃物质发生的一种发光、发热的剧烈
的氧化反应。爆炸(有限空间里的燃烧)氧化剧烈的氧化缓慢氧化平静的燃烧急速的燃烧通常的燃烧如喷气发动机中的燃烧如呼吸和金属的锈蚀自燃(从缓慢氧化转变为剧烈氧化)爆炸燃烧需要什么条件呢?燃烧的条件:1.可燃物2. 充足的氧气.3.温度达到着火点灭火与自救1.使可燃物与空气(氧气)隔绝2.将可燃物的温度降低到着火点以下氧气的化学性质点燃点燃点燃点燃明亮蓝紫色火焰,放热,产生刺激性气味的气体白光,放热,产生能使澄清变浑浊的气体剧烈燃烧,火星四射,放热,产生黑色固体放热,冒出白烟CuH2CH4CO实验室用的少量氧气的制取和收集方法二:加热高锰酸钾(氯酸钾)法方法一:分解双氧水法方法1:分解过氧化氢(双氧水)(H2O2)法2H2O2H2O2+O2MnO2--------催化剂用什么方法可以知道氧气
收集满了?用一根带火星的木条
放于集气瓶口,看木
条是否复燃===============方法2:加热高锰酸钾法查、装、定、点、收、取、灭试管口应略低于试管底(试管口略向下倾斜)铁夹夹在离管口约1/3至1/4处收集满氧气后,要先从水槽中移出导管,再熄灭酒精灯实验时,试管口要塞一团棉花2 .有两个集满氧气的集气瓶,用带火星的木条分别以甲、乙两种方式迅速插入,观察到木条复燃,且甲中燃烧比在乙中燃烧更旺。上述实验说明了氧气具有的性质是:_______________________C氧气能支持燃烧,氧气的密度比空气大3.实验室制取氧气时,装药品的大试管口应 ( )
(A)朝下 (B)朝上
(C)略向下倾斜 (D)略向上倾斜
4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时CD5.校运动会田径比赛发令枪打响后,产生的白烟主要是( )
(A)二氧化碳 (B)五氧化二磷
(C)四氧化三铁 (D)二氧化硫
6.某同学用燃烧红磷的方法测定空气中氧气体积分数,实验后发现测得的氧气体积分数小于1/5,对此你认为下列做法不可取的是( )
(A)检查实验装置是否漏气
(B)可能红磷的量不足,没有除尽氧气
(C)没有冷却至室温就打开止水夹,进入瓶内的水减少
(D)将红磷改成足量的木炭,重新实验BD3、实验室用排水法制氧气时,装高锰酸钾的试管破裂了,其原因可能是 ( )
①装药品前忘了检查气密性
②试管口没有略向下倾斜
③试管没有均匀预热
④收集氧气先熄灭酒精灯后取出导气管 A.只①② B.只有②④
C.②③④ D.①②③④
C氧气的工业制法?分离空气法物理变化原理: 空气多次压缩降温液态空气降温蒸发-196℃氮气(沸点-196℃)液氧(沸点-183℃)1. 二氧化碳不能燃烧,也不支持燃烧。二氧化碳的化学性质二氧化碳的密度比空气大二氧化碳微溶于水2、二氧化碳跟水能反应二氧化碳的化学性质CO2+H2O=H2CO3紫色石蕊试液紫色变成红色红色恢复紫色碳酸能使紫色石蕊变红色CO2+H2O=H2CO3浑浊二氧化碳的化学性质CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙检验
二氧化碳
CO2 + 2NaOH = Na2CO3+ H2O 如果将二氧化碳通入到烧碱溶液中,是否也可以观察到浑浊的现象?一、CO2的物理性质 二氧化碳的性质1、通常情况下是无色、无气味的气体。2、能溶于水(1:1)二、CO2的化学性质1、一般情况下,CO2不能燃烧,不能支持燃烧。2、CO2不能供呼吸。3、CO2跟水反应。CO2+H2O = H2CO3H2CO3 = CO2↑ +H2O 4、CO2与石灰水[Ca(OH)2]反应。CO2+ Ca(OH)2 = H2O +CaCO3 ↓小结人工降雨灭火工业原料致冷剂光合作用 CO2的用途你能说出这些用途与哪些性质相关吗?讨论:为什么久置石灰水的试剂瓶内壁总是出现白膜?怎样才能除去白膜?用化学方程式来表示CO2+ Ca(OH)2 = H2O +CaCO3 ↓2HCl+CaCO3 = H2O + CO2 ↑ + CaCl2实验室制取二氧化碳原料:石灰石或大理石稀盐酸原理:2HCl+CaCO3 = H2O + CO2 ↑ + CaCl2装置:指出错误之处拔高训练实验室有时用硫化亚铁(FeS)固体和稀硫酸在常温下反应,生成硫酸亚铁同时,得到一种无色,有刺激性气味,可溶于水的气体,经测定该气体的密度比空气的密度大.
试根据以上叙述及下图填空:
(1)叙述该气体物理性质有______
无色,刺激性气味,可溶于水,密度比空气大 (2)制取该气体应选_____装置,收集装置___;
(3)试推断制取该气体的化学方程___________________________AACDBDE已知氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶于水。实验室常用碱石灰和硫酸按两种固体混合加热的方法制取氨气。根据所学的知识判断,实验室制取氨气时发生装置应选择( )装置,收集装置应选择( )装置。AC1、臭氧化学式:O3 紫外线
(1)来源: O2=====2O O+O2====O3(2)臭氧的性质:是一种蓝色带腥臭味的气体,有很强的氧化性和不稳定性(3)分布:臭氧主要集中在大气平流层(距地面20—35千米处)——臭氧层 2、臭氧层的作用:阻挡和削弱过强的紫外线,对生 物起保护作 用 3、臭氧层被破坏的原因:氟里昂等温室效应温室效应,是指二氧化碳含量升高,增强大气对太阳光中红外线辐射的吸收,使地球表面温度上升。由环境污染引起的温室效应是指地球表面变热的现象。 它会带来以下几种严重恶果: 1) 地球上的病虫害增加; 2) 海平面上升; 3) 气候反常,海洋风暴增多; 4) 土地干旱,沙漠化面积增大。植树造林
减少化石燃料的燃烧如何制止温室效应?大气污染1、引起空气污染的主要成分有:
这些污染物主要来自:
粉尘和有毒气体(如CO、SO2和氮氧化物)等汽车尾气、工业废气、尘烟排放、土地沙漠化等造成空气污染的因素(1)燃料燃烧排放的废气和烟尘
(2)工业废气(3)汽车等车辆排放的尾气(4)燃烧香烟、建筑装饰材料释放的有毒气体空气污染的种类是如何划分? 空气污染的种类 (1)汽车尾气:
二氧化硫、氮氧化物(主要是一氧化氮
和二氧化氮)、碳氧化物(二氧化碳和
一氧化碳)、碳氢化合物等光化学烟雾污染:汽车排放的废气在阳光紫外线的照射下,
发生一系列化学反应,反应产物与废气一
起构成光化学烟雾污染具体表现:烟雾弥漫呈浅兰色,危害:刺激眼睛和呼吸道黏膜,引起眼睛
红肿和喉炎。(2)烟尘等可吸入颗粒物当空气中可吸入颗粒物过多时,就会直接影响
人们的生活与生产,如引起慢性气管炎、矽肺、
肺癌等疾病和影响制药或电子产品的质量等。 (3)酸雨:pH低于5.6的酸性降水叫酸雨成因:空气中的二氧化硫、氮氧化物在
降水时溶解在水中形成有害的硫酸
和硝酸的缘故危害:酸雨直接危害人类健康;酸雨使水域和
土壤酸化,损害农作物和林木生长,危害
渔业;腐蚀建筑物、工厂设备和文化古迹。
保护空气的措施:(1)控制污染源,
加强空气质量滥测
和预报(2)发展“绿色工业”,
使用洁净无污染的能源(3)植树造林,绿化环境(4)制订环境保护法你会做吗?1.下列不是大自然中氧气的消耗的是( )
A.生物呼吸作用 B.物质燃烧
C.动植物尸体氧化腐烂 D.水蒸发 2.因二氧化碳太多引起的环境问题称为( )
A.保温效应 B.温室效应
C.地面效应 D.反射效应 你会做吗?3.为了保护大气中的臭氧层,可采取的措施是 ( )
A.减少并逐步停止冰箱制冷剂氟利昂的生产和使用
B.防止CO大量排入大气中
防止SO2大量排入大气中
D.减少煤等化石燃料的使用,发展氢能源 4.臭氧层浓度减少会使更 的紫外线辐射到地球上,从而造成对健康的伤害(填多或少) 你会做吗?5.实验室里制取二氧化碳都要用到的一组仪器是 ( )
A.广口瓶、长颈漏斗、导管、集气瓶
B.大试管、集气瓶、水槽、导管
C.酒精灯、广口瓶、漏斗、烧杯
D.烧杯、玻璃棒、长颈漏斗、集气瓶 6.实验室利用大理石与足量的盐酸反应制取二氧化碳,如果制取二氧化碳5.5克,问需用含碳酸钙质量分数为96%的大理石多少克? 你会做吗?7.实验室里制取CO2气体,一般有五个步骤,请按顺序排列 ( )
①收集CO2气体;②按要求装配好仪器装置;③向漏斗注入盐酸;④检查装置气密性;⑤向广口瓶中放入大理石小块。
A.②④⑤③① B.①②③④⑤
C.①③②④⑤ D.④②③⑤① 你会做吗?8.四支试管中分别充满下列气体,若将它们分别倒立于水槽中,试管内水位上升最高的是 ( )
A.H2 B.CO2 C.O2 D.空气 9.盛有石灰水的容器敞开放置一段时间后,容器壁上常会形成一层白色物质,其原因为(用化学方程式表示) 。若要除去壁上白色物质,可用稀盐酸冲洗。其原理为(用化学方程式表示) 。 10、汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 ___________________________________。下列能控制空气污染源的方法是_______________①开发氢能源;②使用电动车;③植树造林;④戴呼吸面具。 2CO+2NO =N2+2CO2催化剂(1)(2) 11、把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g, 这3.84g就是放出O2的质量,这也是解本题的关键.
解 根据质量守恒定律
mO2 = 13.32g – 9.48g = 3.84g
设生成物中KCl质量为xg
2KClO3=====2KCl+3O2↑
149 96
x 3.84g
∴ x=5.96g
MnO2的质量 9.48g – 5.96g = 3.52g
答:氧气的质量为3.84g,剩余物为KCl和MnO2质量分别为5.96g和3.52g.
MnO2149X963.84g=
(0.03%)
(0.03%)
根据作用指出气体的名称稀有气体(0.94%)按体积算氮气(78%)氧气(21%)其他气体(1%)二氧化碳(0.03%)水蒸气等其他杂质(0.03%)冲入灯泡延长使用寿命,用于食品防腐、保鲜,液态氮可作冷冻剂,是制作化肥、炸药的原料供给生物呼吸,支持燃料的燃烧用作保护气,制成各种用途的霓虹灯光合作用原料,用于制造纯碱、尿素、汽水饮料可用于人工降雨,还可用于灭火根据下列现象说明空气中存在着某种气体物质,将物质填在空格内。
(1)小白鼠在装有空气的密闭容器中可存活一段时间,说明空气中含有____。
(2)石灰水长期露置于空气中,瓶壁和石灰水底部均会出现白色固体,说明空气中含有_____。
(3)夏天,盛放棒冰的杯子外壁上附有一层水珠,说明空气中含有____。点燃燃烧匙中的(过量的)红磷,立即塞紧瓶塞,观察现象____________________________ 。红磷在空气燃烧时,产生浓厚的白烟 3.火焰熄灭后,振荡集气瓶,(集气瓶冷却)打开导管上的夹子,出现什么现象 ;
瓶内水位变化 ;消耗的气体跟剩下的气体的体积比约为 .烧杯中的水会进入集气瓶中 是上升1:4空气中氧气含量的测定:你认为包装袋中充的可能是什么气体?阐述你的理由。若想进一步验证,该如何设计方案?二、大气压一、大气压的存在:大气压强生活中哪些现象可以证明大气压的存在?大气压的实验证明:
历史上著名的实验-马德堡半球实验。首次测量出大气压的值的科学家是托里拆利(意大利)12376厘米水银1标准大气压=__mmHg=_____Pa空盒气压计水银气压计二、大气压的测量7601.01×105大气压的特点:
大气压随高度增加而减小,且大气压的值与地点、天气、季节、的变化有关。一般来说,晴天大气压比阴天高,冬天比夏天高。 三、大气压的特点:为什么用高压锅烧饭容易熟?沸点与压强:一切液体的沸点,气压增大时升高。沸点与压强:一切液体的沸点,气压减小时降低,练习:
☆测得马德堡半球实验直径30cm则马德堡半球上受到得压力约多大。F=pS=1.01×105Pa×0.707 m2=7.14×103N气压对液体沸点的影响气压高 液体沸点高
气压低 液体沸点低气压高 气体液化温度高
气压低 气体液化温度低思考:要将氧气变成液态,可以采取哪些方法?降温加压高气压区 晴燥天气
低气压区 阴雨天气气压对天气的影响 晴朗天气人们的心情一般比阴雨天气好些氧气和二氧化碳比较氧气和二氧化碳的物理性质无色无味气态常温常压不易溶于水比空气大无色无味气态微溶于水比空气大根据它们的物理性质有哪些用途? 实验室收集氧气和二氧化碳时,可以选用什么装置?排水法向上排空气法向下排空气法氧气二氧化碳氧气练习1、既能用排水法,又能用向上排空气法收集的气体必须具备的性质是( )。
A.易溶于水,密度大于空气
B.易溶于水,密度小于空气
C.不易溶于水,密度大于空气
D.难溶于水,密度小于空气
C氧气的用途助燃供给呼吸氧化性氧气的化学性质提高炉内的温度氧气急救病人燃烧:可燃物质发生的一种发光、发热的剧烈
的氧化反应。爆炸(有限空间里的燃烧)氧化剧烈的氧化缓慢氧化平静的燃烧急速的燃烧通常的燃烧如喷气发动机中的燃烧如呼吸和金属的锈蚀自燃(从缓慢氧化转变为剧烈氧化)爆炸燃烧需要什么条件呢?燃烧的条件:1.可燃物2. 充足的氧气.3.温度达到着火点灭火与自救1.使可燃物与空气(氧气)隔绝2.将可燃物的温度降低到着火点以下氧气的化学性质点燃点燃点燃点燃明亮蓝紫色火焰,放热,产生刺激性气味的气体白光,放热,产生能使澄清变浑浊的气体剧烈燃烧,火星四射,放热,产生黑色固体放热,冒出白烟CuH2CH4CO实验室用的少量氧气的制取和收集方法二:加热高锰酸钾(氯酸钾)法方法一:分解双氧水法方法1:分解过氧化氢(双氧水)(H2O2)法2H2O2H2O2+O2MnO2--------催化剂用什么方法可以知道氧气
收集满了?用一根带火星的木条
放于集气瓶口,看木
条是否复燃===============方法2:加热高锰酸钾法查、装、定、点、收、取、灭试管口应略低于试管底(试管口略向下倾斜)铁夹夹在离管口约1/3至1/4处收集满氧气后,要先从水槽中移出导管,再熄灭酒精灯实验时,试管口要塞一团棉花2 .有两个集满氧气的集气瓶,用带火星的木条分别以甲、乙两种方式迅速插入,观察到木条复燃,且甲中燃烧比在乙中燃烧更旺。上述实验说明了氧气具有的性质是:_______________________C氧气能支持燃烧,氧气的密度比空气大3.实验室制取氧气时,装药品的大试管口应 ( )
(A)朝下 (B)朝上
(C)略向下倾斜 (D)略向上倾斜
4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )
(A)加热固体药品前
(B)与加热固体药品同时
(C)开始有气泡放出时
(D)气泡连续并均匀放出时CD5.校运动会田径比赛发令枪打响后,产生的白烟主要是( )
(A)二氧化碳 (B)五氧化二磷
(C)四氧化三铁 (D)二氧化硫
6.某同学用燃烧红磷的方法测定空气中氧气体积分数,实验后发现测得的氧气体积分数小于1/5,对此你认为下列做法不可取的是( )
(A)检查实验装置是否漏气
(B)可能红磷的量不足,没有除尽氧气
(C)没有冷却至室温就打开止水夹,进入瓶内的水减少
(D)将红磷改成足量的木炭,重新实验BD3、实验室用排水法制氧气时,装高锰酸钾的试管破裂了,其原因可能是 ( )
①装药品前忘了检查气密性
②试管口没有略向下倾斜
③试管没有均匀预热
④收集氧气先熄灭酒精灯后取出导气管 A.只①② B.只有②④
C.②③④ D.①②③④
C氧气的工业制法?分离空气法物理变化原理: 空气多次压缩降温液态空气降温蒸发-196℃氮气(沸点-196℃)液氧(沸点-183℃)1. 二氧化碳不能燃烧,也不支持燃烧。二氧化碳的化学性质二氧化碳的密度比空气大二氧化碳微溶于水2、二氧化碳跟水能反应二氧化碳的化学性质CO2+H2O=H2CO3紫色石蕊试液紫色变成红色红色恢复紫色碳酸能使紫色石蕊变红色CO2+H2O=H2CO3浑浊二氧化碳的化学性质CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙检验
二氧化碳
CO2 + 2NaOH = Na2CO3+ H2O 如果将二氧化碳通入到烧碱溶液中,是否也可以观察到浑浊的现象?一、CO2的物理性质 二氧化碳的性质1、通常情况下是无色、无气味的气体。2、能溶于水(1:1)二、CO2的化学性质1、一般情况下,CO2不能燃烧,不能支持燃烧。2、CO2不能供呼吸。3、CO2跟水反应。CO2+H2O = H2CO3H2CO3 = CO2↑ +H2O 4、CO2与石灰水[Ca(OH)2]反应。CO2+ Ca(OH)2 = H2O +CaCO3 ↓小结人工降雨灭火工业原料致冷剂光合作用 CO2的用途你能说出这些用途与哪些性质相关吗?讨论:为什么久置石灰水的试剂瓶内壁总是出现白膜?怎样才能除去白膜?用化学方程式来表示CO2+ Ca(OH)2 = H2O +CaCO3 ↓2HCl+CaCO3 = H2O + CO2 ↑ + CaCl2实验室制取二氧化碳原料:石灰石或大理石稀盐酸原理:2HCl+CaCO3 = H2O + CO2 ↑ + CaCl2装置:指出错误之处拔高训练实验室有时用硫化亚铁(FeS)固体和稀硫酸在常温下反应,生成硫酸亚铁同时,得到一种无色,有刺激性气味,可溶于水的气体,经测定该气体的密度比空气的密度大.
试根据以上叙述及下图填空:
(1)叙述该气体物理性质有______
无色,刺激性气味,可溶于水,密度比空气大 (2)制取该气体应选_____装置,收集装置___;
(3)试推断制取该气体的化学方程___________________________AACDBDE已知氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶于水。实验室常用碱石灰和硫酸按两种固体混合加热的方法制取氨气。根据所学的知识判断,实验室制取氨气时发生装置应选择( )装置,收集装置应选择( )装置。AC1、臭氧化学式:O3 紫外线
(1)来源: O2=====2O O+O2====O3(2)臭氧的性质:是一种蓝色带腥臭味的气体,有很强的氧化性和不稳定性(3)分布:臭氧主要集中在大气平流层(距地面20—35千米处)——臭氧层 2、臭氧层的作用:阻挡和削弱过强的紫外线,对生 物起保护作 用 3、臭氧层被破坏的原因:氟里昂等温室效应温室效应,是指二氧化碳含量升高,增强大气对太阳光中红外线辐射的吸收,使地球表面温度上升。由环境污染引起的温室效应是指地球表面变热的现象。 它会带来以下几种严重恶果: 1) 地球上的病虫害增加; 2) 海平面上升; 3) 气候反常,海洋风暴增多; 4) 土地干旱,沙漠化面积增大。植树造林
减少化石燃料的燃烧如何制止温室效应?大气污染1、引起空气污染的主要成分有:
这些污染物主要来自:
粉尘和有毒气体(如CO、SO2和氮氧化物)等汽车尾气、工业废气、尘烟排放、土地沙漠化等造成空气污染的因素(1)燃料燃烧排放的废气和烟尘
(2)工业废气(3)汽车等车辆排放的尾气(4)燃烧香烟、建筑装饰材料释放的有毒气体空气污染的种类是如何划分? 空气污染的种类 (1)汽车尾气:
二氧化硫、氮氧化物(主要是一氧化氮
和二氧化氮)、碳氧化物(二氧化碳和
一氧化碳)、碳氢化合物等光化学烟雾污染:汽车排放的废气在阳光紫外线的照射下,
发生一系列化学反应,反应产物与废气一
起构成光化学烟雾污染具体表现:烟雾弥漫呈浅兰色,危害:刺激眼睛和呼吸道黏膜,引起眼睛
红肿和喉炎。(2)烟尘等可吸入颗粒物当空气中可吸入颗粒物过多时,就会直接影响
人们的生活与生产,如引起慢性气管炎、矽肺、
肺癌等疾病和影响制药或电子产品的质量等。 (3)酸雨:pH低于5.6的酸性降水叫酸雨成因:空气中的二氧化硫、氮氧化物在
降水时溶解在水中形成有害的硫酸
和硝酸的缘故危害:酸雨直接危害人类健康;酸雨使水域和
土壤酸化,损害农作物和林木生长,危害
渔业;腐蚀建筑物、工厂设备和文化古迹。
保护空气的措施:(1)控制污染源,
加强空气质量滥测
和预报(2)发展“绿色工业”,
使用洁净无污染的能源(3)植树造林,绿化环境(4)制订环境保护法你会做吗?1.下列不是大自然中氧气的消耗的是( )
A.生物呼吸作用 B.物质燃烧
C.动植物尸体氧化腐烂 D.水蒸发 2.因二氧化碳太多引起的环境问题称为( )
A.保温效应 B.温室效应
C.地面效应 D.反射效应 你会做吗?3.为了保护大气中的臭氧层,可采取的措施是 ( )
A.减少并逐步停止冰箱制冷剂氟利昂的生产和使用
B.防止CO大量排入大气中
防止SO2大量排入大气中
D.减少煤等化石燃料的使用,发展氢能源 4.臭氧层浓度减少会使更 的紫外线辐射到地球上,从而造成对健康的伤害(填多或少) 你会做吗?5.实验室里制取二氧化碳都要用到的一组仪器是 ( )
A.广口瓶、长颈漏斗、导管、集气瓶
B.大试管、集气瓶、水槽、导管
C.酒精灯、广口瓶、漏斗、烧杯
D.烧杯、玻璃棒、长颈漏斗、集气瓶 6.实验室利用大理石与足量的盐酸反应制取二氧化碳,如果制取二氧化碳5.5克,问需用含碳酸钙质量分数为96%的大理石多少克? 你会做吗?7.实验室里制取CO2气体,一般有五个步骤,请按顺序排列 ( )
①收集CO2气体;②按要求装配好仪器装置;③向漏斗注入盐酸;④检查装置气密性;⑤向广口瓶中放入大理石小块。
A.②④⑤③① B.①②③④⑤
C.①③②④⑤ D.④②③⑤① 你会做吗?8.四支试管中分别充满下列气体,若将它们分别倒立于水槽中,试管内水位上升最高的是 ( )
A.H2 B.CO2 C.O2 D.空气 9.盛有石灰水的容器敞开放置一段时间后,容器壁上常会形成一层白色物质,其原因为(用化学方程式表示) 。若要除去壁上白色物质,可用稀盐酸冲洗。其原理为(用化学方程式表示) 。 10、汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 ___________________________________。下列能控制空气污染源的方法是_______________①开发氢能源;②使用电动车;③植树造林;④戴呼吸面具。 2CO+2NO =N2+2CO2催化剂(1)(2) 11、把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g, 这3.84g就是放出O2的质量,这也是解本题的关键.
解 根据质量守恒定律
mO2 = 13.32g – 9.48g = 3.84g
设生成物中KCl质量为xg
2KClO3=====2KCl+3O2↑
149 96
x 3.84g
∴ x=5.96g
MnO2的质量 9.48g – 5.96g = 3.52g
答:氧气的质量为3.84g,剩余物为KCl和MnO2质量分别为5.96g和3.52g.
MnO2149X963.84g=
