浙江省杭州市江南实验学校2017-2018学年高二上学期第三次月考化学试卷
文档属性
| 名称 | 浙江省杭州市江南实验学校2017-2018学年高二上学期第三次月考化学试卷 |  | |
| 格式 | zip | ||
| 文件大小 | 630.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-23 10:30:36 | ||
图片预览




文档简介
江南实验学校2017-2018学年上学期第三次月考
高二年级化学试卷
分值:100分 时间:90分钟 命题人:
可能用到的相对原子质量:
H:1 C:12 N:14 O:16
第Ⅰ卷
一、选择题(只有一个选项符合题意,共10小题,每小题2分,共20分)
1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应为2Cl--2e-Cl2↑
B.氢氧燃料电池的负极反应:O2+2H2O+4e-4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为Cu-2e-Cu2+
D.钢铁发生电化学腐蚀的正极反应Fe-2e-Fe2+
3.下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
4.根据下列事实:
(1)X+Y2+X2++Y;
(2)Z+2H2OZ(OH)2+H2↑;
(3)Z2+氧化性比X2+弱;
(4)由Y、W电极组成的原电池,电极反应为W2++2e-W,Y-2e-Y2+。
可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
5.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
6.在多电子原子中,轨道能量是由以下哪些因素决定( )
①电子层 ②电子亚层 ③空间伸展方向 ④自旋状态.
A.①② B.①④
C.②③ D.③④
7.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s2
C.4s24p1 D.3s23p5
8.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;
③1s22s22p5.则下列有关比较中正确的是( )
A.最高正化合价:③>②>① B.第一电离能:③>②>①
C.电负性:③>②>① D.原子半径:③>②>①
9. 下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3s2表示3s能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,3d、4d、5d能级的轨道数依次增多
10.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X可以显负价,Y显正价
B.最高价含氧酸的酸性:X对应的酸性弱于Y对应的
C.第一电离能可能Y小于X
D.气态氢化物的稳定性:HmY小于HnX
二、选择题(只有一个选项符合题意,共10小题,每小题3分,共30分)
11.下列关于价电子构型为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为:
12.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
A.a﹣4 B.a+8
C.a﹣5 D.a+4
13.下列说法正确的是( )
A.电离能大的元素,不易失电子,易得到电子,表现非金属性
B.电离能大的元素其电负性必然也大
C.电负性最大的非金属元素形成的含氧酸的酸性最强
D.电离能最小的元素形成的氧化物的水化物的碱性最强
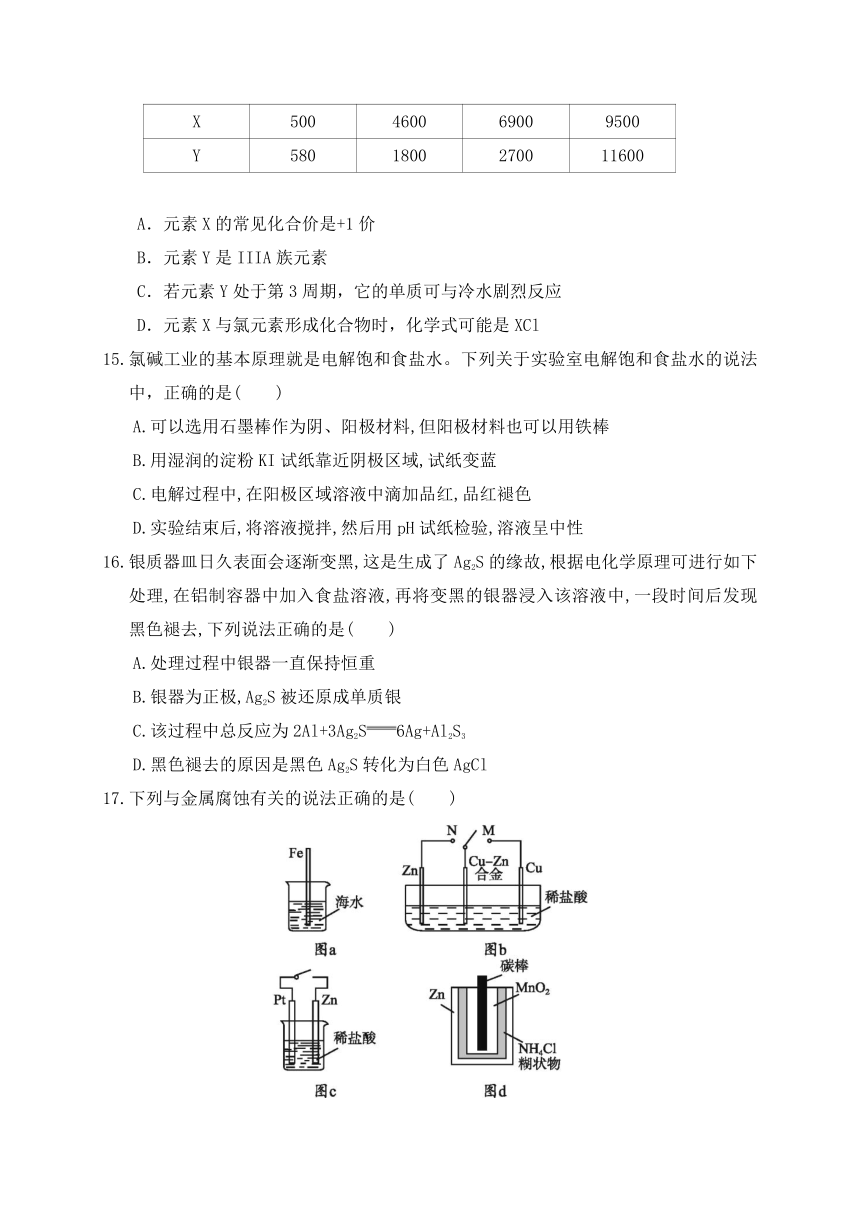
14.已知X、Y是主族元素,I为电离能,单位是kJ?mol﹣1。根据如下表所列数据判断,错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.若元素Y处于第3周期,它的单质可与冷水剧烈反应
D.元素X与氯元素形成化合物时,化学式可能是XCl
15.氯碱工业的基本原理就是电解饱和食盐水。下列关于实验室电解饱和食盐水的说法中,正确的是( )
A.可以选用石墨棒作为阴、阳极材料,但阳极材料也可以用铁棒
B.用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝
C.电解过程中,在阳极区域溶液中滴加品红,品红褪色
D.实验结束后,将溶液搅拌,然后用pH试纸检验,溶液呈中性
16.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去,下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原成单质银
C.该过程中总反应为2Al+3Ag2S6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
17.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
18.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
19.某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两
极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指
针偏转。下列有关描述正确的是( )
A.断开K2,闭合K1时,总反应的离子方程式为
2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-2Cl-
D.断开K1,闭合K2时,石墨电极作正极
20.高铁电池是一种新型可充电电池,该电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移 3 mol 电子,正极有 1 mol K2FeO4 被还原
D.放电时正极附近溶液的碱性减弱
第Ⅱ卷
三、填空题(本题共4小题,共50分)
21.(11分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为,E与B的质量比为。根据以上条件,回答下列问题:
(1)推断下列元素分别是:A ,B ,C 。
(2)写出D原子的电子排布式 。
(3)指出E元素在元素周期表中的位置 。
(4)比较A、B、C三种元素的第一电离能的大小顺序 (按由大到小的顺序排列)。
(5)比较元素D和E的电负性的相对大小 。
22.(15分)如表是五种主族元素的结构特点及其元素、单质、化合物的性质.
元素
结构特点及元素、单质、化合物的性质
X
气态氢化物与最高价氧化物对应水化物可以化合成盐
Y
原子中s电子数与p电子数相同,且p电子的能量最高
Z
单质在空气中燃烧产生黄色火焰,生成黄色粉末
W
最外层电子排布(n+1)sn(n+1)pn﹣1
T
单质升华可以产生紫色的烟
(1)写出X的电子排布式为 ;其单质的化学性质 (填“稳定”或“活泼”),该元素的非金属性 (填“强”或“弱”),证明其强弱的理由是_ 。
(2)W的最高价氧化物对应的水化物可以与X、Z的最高价氧化物对应的水化物反应,写出反应的离子方程式: , 。
(3)Y元素的电子排布式为 ,其在周期表中的位置是第 周期第 族。
(4)X的气态氢化物与其最高价氧化物对应的水化物所形成的盐的水溶液的pH 7(填“>”“<”或“=”),理由是 (用离子方程式解释)。
(5)X、Y、Z、W、T五种元素中,第一电离能最小的是 (填元素符号或化学式,下同),电负性最大的是 ,最小的是 ,五种元素两两所形成的化合物中,最有可能是离子化合物的是 。
23.(14 分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是__________________________________________。
②Y电极上的电极反应式为 。检验该电极反应产物的方法_____________。
(2)如要用电解方法精炼粗铜,电解液a选用 CuSO4 溶液,则
① X 电极的材料是____________。电极反应式是_____________。
② Y 电极的材料是____________。电极反应式是_____________。
(说明:杂质发生的电极反应不必写出)
24.(10分)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
请回答:
(1)写出甲池中正极的电极反应式: 。?
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极 ,总反应的离子方程式为 。?
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。?
(4)由此实验,可得到如下哪些正确结论? (填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
化学参考答案
1-5:DACCD 6-10:ABBAB 11-15:BCDCC 16-20:BBADD
21、(共11分)
(1)C,O,N(每空1分)
(2)1s22s22p63s23p2(2分)。
(3)第三周期ⅥA族(2分)。
(4)N>O>C(2分)。
(5)S>Si(2分)。
22、(每空1分,共15分)
(1)1s22s22p3, 稳定, 强, 硝酸是强酸;
(2)Al(OH)3+3H+=Al3++3H2O, Al(OH)3+OH﹣=AlO2﹣+2H2O。
(3)1s22s22p4, 二, ⅥA。
(4)<, NH4++H2O?NH3·H2O+H+
(5)Na, O, Na, Na2O(或Na2O2)。
23、(共14分)
(1) ① 2H++2e-=H2↑或 2H2O+2e-=2OH-+H2↑(2 分);
放出气体,溶液变红。(2 分)
② 2Cl–-2e-=Cl2 ↑(2 分);
把湿润的碘化钾淀粉试纸放在 Y 电极附近,试纸变蓝色。(2 分)
(2) ①纯铜(1分),Cu2++2e-=Cu (2 分)
②粗铜(1分),Cu-2e-=Cu2+(2 分)
24. (共10分)
(1)2H++2e-H2↑(2分)
(2)Al+4OH--3e-AlO2-+2H2O(2分), 2Al+2OH-+2H2O2 AlO2-+3H2↑(2分)
(3)Mg Al(每空1分)
(4)a、d(2分)
高二年级化学试卷
分值:100分 时间:90分钟 命题人:
可能用到的相对原子质量:
H:1 C:12 N:14 O:16
第Ⅰ卷
一、选择题(只有一个选项符合题意,共10小题,每小题2分,共20分)
1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应为2Cl--2e-Cl2↑
B.氢氧燃料电池的负极反应:O2+2H2O+4e-4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为Cu-2e-Cu2+
D.钢铁发生电化学腐蚀的正极反应Fe-2e-Fe2+
3.下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
4.根据下列事实:
(1)X+Y2+X2++Y;
(2)Z+2H2OZ(OH)2+H2↑;
(3)Z2+氧化性比X2+弱;
(4)由Y、W电极组成的原电池,电极反应为W2++2e-W,Y-2e-Y2+。
可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
5.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
6.在多电子原子中,轨道能量是由以下哪些因素决定( )
①电子层 ②电子亚层 ③空间伸展方向 ④自旋状态.
A.①② B.①④
C.②③ D.③④
7.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s2
C.4s24p1 D.3s23p5
8.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;
③1s22s22p5.则下列有关比较中正确的是( )
A.最高正化合价:③>②>① B.第一电离能:③>②>①
C.电负性:③>②>① D.原子半径:③>②>①
9. 下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3s2表示3s能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,3d、4d、5d能级的轨道数依次增多
10.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X可以显负价,Y显正价
B.最高价含氧酸的酸性:X对应的酸性弱于Y对应的
C.第一电离能可能Y小于X
D.气态氢化物的稳定性:HmY小于HnX
二、选择题(只有一个选项符合题意,共10小题,每小题3分,共30分)
11.下列关于价电子构型为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为:
12.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
A.a﹣4 B.a+8
C.a﹣5 D.a+4
13.下列说法正确的是( )
A.电离能大的元素,不易失电子,易得到电子,表现非金属性
B.电离能大的元素其电负性必然也大
C.电负性最大的非金属元素形成的含氧酸的酸性最强
D.电离能最小的元素形成的氧化物的水化物的碱性最强
14.已知X、Y是主族元素,I为电离能,单位是kJ?mol﹣1。根据如下表所列数据判断,错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.若元素Y处于第3周期,它的单质可与冷水剧烈反应
D.元素X与氯元素形成化合物时,化学式可能是XCl
15.氯碱工业的基本原理就是电解饱和食盐水。下列关于实验室电解饱和食盐水的说法中,正确的是( )
A.可以选用石墨棒作为阴、阳极材料,但阳极材料也可以用铁棒
B.用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝
C.电解过程中,在阳极区域溶液中滴加品红,品红褪色
D.实验结束后,将溶液搅拌,然后用pH试纸检验,溶液呈中性
16.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去,下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原成单质银
C.该过程中总反应为2Al+3Ag2S6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
17.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
18.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
19.某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两
极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指
针偏转。下列有关描述正确的是( )
A.断开K2,闭合K1时,总反应的离子方程式为
2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-2Cl-
D.断开K1,闭合K2时,石墨电极作正极
20.高铁电池是一种新型可充电电池,该电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移 3 mol 电子,正极有 1 mol K2FeO4 被还原
D.放电时正极附近溶液的碱性减弱
第Ⅱ卷
三、填空题(本题共4小题,共50分)
21.(11分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为,E与B的质量比为。根据以上条件,回答下列问题:
(1)推断下列元素分别是:A ,B ,C 。
(2)写出D原子的电子排布式 。
(3)指出E元素在元素周期表中的位置 。
(4)比较A、B、C三种元素的第一电离能的大小顺序 (按由大到小的顺序排列)。
(5)比较元素D和E的电负性的相对大小 。
22.(15分)如表是五种主族元素的结构特点及其元素、单质、化合物的性质.
元素
结构特点及元素、单质、化合物的性质
X
气态氢化物与最高价氧化物对应水化物可以化合成盐
Y
原子中s电子数与p电子数相同,且p电子的能量最高
Z
单质在空气中燃烧产生黄色火焰,生成黄色粉末
W
最外层电子排布(n+1)sn(n+1)pn﹣1
T
单质升华可以产生紫色的烟
(1)写出X的电子排布式为 ;其单质的化学性质 (填“稳定”或“活泼”),该元素的非金属性 (填“强”或“弱”),证明其强弱的理由是_ 。
(2)W的最高价氧化物对应的水化物可以与X、Z的最高价氧化物对应的水化物反应,写出反应的离子方程式: , 。
(3)Y元素的电子排布式为 ,其在周期表中的位置是第 周期第 族。
(4)X的气态氢化物与其最高价氧化物对应的水化物所形成的盐的水溶液的pH 7(填“>”“<”或“=”),理由是 (用离子方程式解释)。
(5)X、Y、Z、W、T五种元素中,第一电离能最小的是 (填元素符号或化学式,下同),电负性最大的是 ,最小的是 ,五种元素两两所形成的化合物中,最有可能是离子化合物的是 。
23.(14 分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是__________________________________________。
②Y电极上的电极反应式为 。检验该电极反应产物的方法_____________。
(2)如要用电解方法精炼粗铜,电解液a选用 CuSO4 溶液,则
① X 电极的材料是____________。电极反应式是_____________。
② Y 电极的材料是____________。电极反应式是_____________。
(说明:杂质发生的电极反应不必写出)
24.(10分)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
请回答:
(1)写出甲池中正极的电极反应式: 。?
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极 ,总反应的离子方程式为 。?
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。?
(4)由此实验,可得到如下哪些正确结论? (填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
化学参考答案
1-5:DACCD 6-10:ABBAB 11-15:BCDCC 16-20:BBADD
21、(共11分)
(1)C,O,N(每空1分)
(2)1s22s22p63s23p2(2分)。
(3)第三周期ⅥA族(2分)。
(4)N>O>C(2分)。
(5)S>Si(2分)。
22、(每空1分,共15分)
(1)1s22s22p3, 稳定, 强, 硝酸是强酸;
(2)Al(OH)3+3H+=Al3++3H2O, Al(OH)3+OH﹣=AlO2﹣+2H2O。
(3)1s22s22p4, 二, ⅥA。
(4)<, NH4++H2O?NH3·H2O+H+
(5)Na, O, Na, Na2O(或Na2O2)。
23、(共14分)
(1) ① 2H++2e-=H2↑或 2H2O+2e-=2OH-+H2↑(2 分);
放出气体,溶液变红。(2 分)
② 2Cl–-2e-=Cl2 ↑(2 分);
把湿润的碘化钾淀粉试纸放在 Y 电极附近,试纸变蓝色。(2 分)
(2) ①纯铜(1分),Cu2++2e-=Cu (2 分)
②粗铜(1分),Cu-2e-=Cu2+(2 分)
24. (共10分)
(1)2H++2e-H2↑(2分)
(2)Al+4OH--3e-AlO2-+2H2O(2分), 2Al+2OH-+2H2O2 AlO2-+3H2↑(2分)
(3)Mg Al(每空1分)
(4)a、d(2分)
同课章节目录
