华师大版九年级上册/第一章 酸 碱 盐/2.重要的酸(第一课时)[上学期]
文档属性
| 名称 | 华师大版九年级上册/第一章 酸 碱 盐/2.重要的酸(第一课时)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 12.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2008-01-21 00:00:00 | ||
图片预览

文档简介
2重要的酸 (第一课时)
● 教学目标
1. 了解盐酸、硫酸的物理性质和化学性质。
2. 知道浓硫酸具有腐蚀性,知道稀释浓硫酸的正确方法。
3. 能够区别稀盐酸和稀硫酸,知道AgCl和BaSO4是不溶于稀硝酸的白色沉淀。
4. 体验用已有化学知识探究物质性质的过程。
5 .通过实验培养严谨、求实的科学态度和科学方法。
●教学重点
1. 让学生了解盐酸和硫酸的性质,知道浓硫酸具有腐蚀性,知道稀释浓硫酸的正确方法。
2. 让学生体验通过动脑、动手探究物质性质的过程。
●教学难点
对实验现象的分析、思考
●课时安排
1课时
●教学方法
教师引导、学生实验,设疑推进
●教学用具
投影仪、胶头滴管、试管、量筒、石蕊试纸、火柴、纸片、木条、点滴板、烧杯、浓硫酸、稀硫酸、蒸馏水。
●教学过程
[趣味实验]演示“黑面包”实验:
在200ml的烧杯中放入20g蔗糖,加入几滴水,搅拌均匀。再加15ml质量分数为98%的浓硫酸,迅速搅拌,就可以看到白色的蔗糖变成了黑色的物质,并伴随着气体的发出而膨胀、长高。
问:向蔗糖中加入的是什么液体?
告诉学生:加入的物质是浓硫酸,这种物质平时哪里含有?汽车(电瓶车)用的铅蓄电池中含有H2SO4。酸雨中也含有极少量的H2SO4。它是化学工业上人们常说的“三酸两碱”中的一酸。
还有二酸是盐酸,人的胃液中含有盐酸。
还有硝酸:酸雨中还含有极少量的HNO3。(因含有氮元素,是制化肥的原料等)。
下面我们就来学习硫酸和盐酸。
它们是一种什么样的物质?它们又有哪些性质呢?
物质的性质一般有物理性质和化学性质等。(复习什么是物理性质。)
(下面开展一项活动)
讲台上有一瓶浓硫酸,一瓶浓盐酸和一瓶蒸馏水。
选出学生代表走到讲台上进行实验
(可观察酸的颜色、状态,拿起酸和水的瓶子比较它们的重,打开酸的瓶盖闻一闻气味。
出示幻灯片:扇气入鼻——闻气味的正确方法
化学实验中有时需要闻一些气体的气味,为了安全, 不能用力用力猛吸, 应该用手轻轻扇动, 只使少量的气体进入 鼻腔即可。
下面由学生代表告诉全班同学结果。
然后小组讨论设计一个记录浓硫酸和浓盐酸的物理性质的表格(并记录结果):
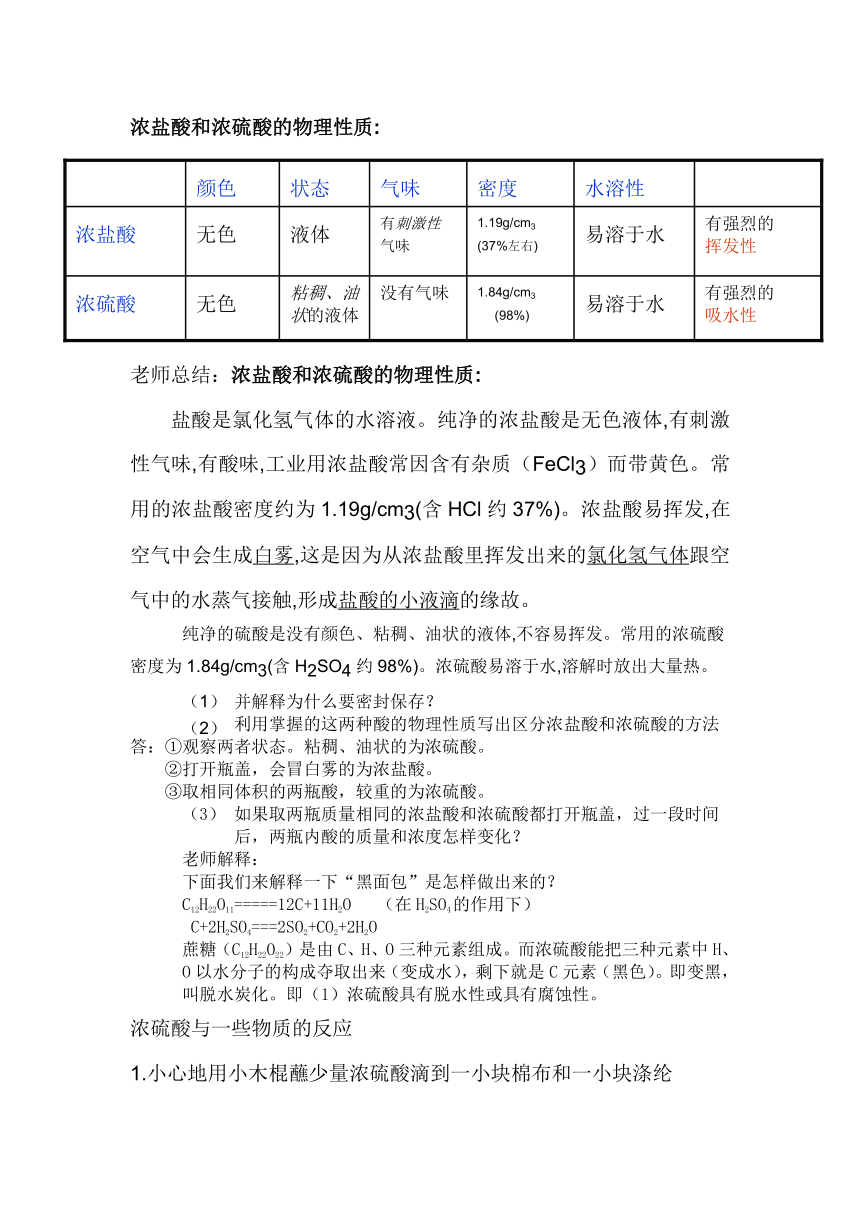
浓盐酸和浓硫酸的物理性质:
老师总结:浓盐酸和浓硫酸的物理性质:
盐酸是氯化氢气体的水溶液。纯净的浓盐酸是无色液体,有刺激性气味,有酸味,工业用浓盐酸常因含有杂质(FeCl3)而带黄色。常用的浓盐酸密度约为1.19g/cm3(含HCl约37%)。浓盐酸易挥发,在空气中会生成白雾,这是因为从浓盐酸里挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸的小液滴的缘故。
纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。常用的浓硫酸密度为1.84g/cm3(含H2SO4约98%)。浓硫酸易溶于水,溶解时放出大量热。
(1) 并解释为什么要密封保存?
(2) 利用掌握的这两种酸的物理性质写出区分浓盐酸和浓硫酸的方法
答:①观察两者状态。粘稠、油状的为浓硫酸。
②打开瓶盖,会冒白雾的为浓盐酸。
③取相同体积的两瓶酸,较重的为浓硫酸。
(3) 如果取两瓶质量相同的浓盐酸和浓硫酸都打开瓶盖,过一段时间后,两瓶内酸的质量和浓度怎样变化?
老师解释:
下面我们来解释一下“黑面包”是怎样做出来的?
C12H22O11=====12C+11H2O (在H2SO4的作用下)
C+2H2SO4===2SO2+CO2+2H2O
蔗糖(C12H22O22)是由C、H、O三种元素组成。而浓硫酸能把三种元素中H、O以水分子的构成夺取出来(变成水),剩下就是C元素(黑色)。即变黑,叫脱水炭化。即(1)浓硫酸具有脱水性或具有腐蚀性。
浓硫酸与一些物质的反应
1.小心地用小木棍蘸少量浓硫酸滴到一小块棉布和一小块涤纶
布上,放置一会后,观察并记录现象: 棉布上的现象是 发黑
涤纶布上的现象 褪色、发黑
小木棍上的现象是 发黑
2.向试管中加入2ml水,再小心地滴入2滴浓硫酸,轻轻振荡试管。
用手触摸试管外壁,记录下你的感觉和解释:
试管发热,因为浓硫酸溶于水时要放出大量的热。
3.根据以上实验,讨论应如何安全使用浓硫酸。
二.安全使用浓硫酸
日常生活用品中,纸张、木材、布料、人的皮肤等都会有C、H、O三种元素,棉布和小木棍主要成分都是纤维素、碳水化合物,都很容易受浓硫酸腐蚀而炭化。
可看到发黑现象。
下面我们分组实验(提示必须要小心,因为浓硫酸有较强的腐蚀性)
出示幻灯片:
怎样安全使用浓硫酸
1. 千万不要用手直接接触浓硫酸; 2.浓硫酸要存放在安全的地方; 3.决不能用浓硫酸泼向人或动物以及任何非实验必须的物品等,防止各种事故发生。
(因实验时要用到稀硫酸),所以
怎样稀释浓硫酸?(浓→稀)
出示幻灯片:浓硫酸与水反应剧烈,放出大量的热,所以稀释浓硫酸时,一定要把
浓硫酸沿着玻璃棒或器壁慢慢注入水中,并不断搅拌。切不可将水倒入浓硫酸里。
为什么?
如果把水倒进浓硫酸里,由于水的密度比浓硫酸小,它就浮在浓硫酸上面,浓硫酸溶解时放出的热量会形成局部高温,使水翻腾致使酸液飞涨,造成事故。
如果不慎将浓硫酸沾到了皮肤或衣服上,应立即用布吸干,再用
大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液(NaHCO3)。
盐酸和硫酸的用途:
(4)
(5)
。。。。
这节课我们学了哪些内容:
1.盐酸的物理性质:
纯洁盐酸无色、有刺激性气味,工业盐酸因含FeCl3等杂质而显黄色,浓盐酸易挥发出氯化氢气体并跟空气中的水蒸气形成盐酸小液滴(白雾)。
2.浓硫酸的物理性质:
浓硫酸是无色、粘稠、油状的液体,有强烈的吸水性(可作干燥剂),易溶于水且同时放出大量的热(稀释时一定要使浓硫酸沿玻璃棒或容器壁慢慢注入水中,并不断搅拌)。
3.浓硫酸具有脱水性和强腐蚀性(使纸张、蔗糖等炭化变黑,会烧伤皮肤、腐蚀衣服。若不慎将浓硫酸沾到皮肤上,应立即用布吸干,再用大量水冲洗,然后涂上3%--5%的碳酸氢钠溶液)。
4.酸的用途:
盐酸用于金属除绣、制药物、助消化等;硫酸用于生产化肥、金属除绣、精练石油等。
1.浓硫酸和浓盐酸为什么要密封保存
2.利用掌握的这两种酸的物理性质说出区分浓硫酸和浓盐酸的方法
3.如果取两瓶质量相同的浓盐酸和浓硫酸都打开瓶盖,过一段时间后,两瓶内酸的质量和浓度怎样变化
布置作业:
(1) 课本P12 1、2、3
(2) 作业本B本P1-2 重要的酸(一)
颜色
状态
气味
密度
水溶性
浓盐酸
无色
液体
有刺激性
气味
1.19g/cm3
(37%左右)
易溶于水
有强烈的
挥发性
浓硫酸
无色
粘稠、油状的液体
没有气味
1.84g/cm3
(98%)
易溶于水
有强烈的
吸水性
浓硫酸是实验室常用的干燥剂
用作干燥剂
硫酸、盐酸均可用于
金属表面除绣
金属表面除绣
盐酸可用于制造盐酸
麻黄素等药物
制造药物
生产化肥
硫酸用于精炼石油
硫酸用于生产硫酸铵等化肥
精练石油
胃液中的盐酸帮助消化食物
帮助消化
酸
● 教学目标
1. 了解盐酸、硫酸的物理性质和化学性质。
2. 知道浓硫酸具有腐蚀性,知道稀释浓硫酸的正确方法。
3. 能够区别稀盐酸和稀硫酸,知道AgCl和BaSO4是不溶于稀硝酸的白色沉淀。
4. 体验用已有化学知识探究物质性质的过程。
5 .通过实验培养严谨、求实的科学态度和科学方法。
●教学重点
1. 让学生了解盐酸和硫酸的性质,知道浓硫酸具有腐蚀性,知道稀释浓硫酸的正确方法。
2. 让学生体验通过动脑、动手探究物质性质的过程。
●教学难点
对实验现象的分析、思考
●课时安排
1课时
●教学方法
教师引导、学生实验,设疑推进
●教学用具
投影仪、胶头滴管、试管、量筒、石蕊试纸、火柴、纸片、木条、点滴板、烧杯、浓硫酸、稀硫酸、蒸馏水。
●教学过程
[趣味实验]演示“黑面包”实验:
在200ml的烧杯中放入20g蔗糖,加入几滴水,搅拌均匀。再加15ml质量分数为98%的浓硫酸,迅速搅拌,就可以看到白色的蔗糖变成了黑色的物质,并伴随着气体的发出而膨胀、长高。
问:向蔗糖中加入的是什么液体?
告诉学生:加入的物质是浓硫酸,这种物质平时哪里含有?汽车(电瓶车)用的铅蓄电池中含有H2SO4。酸雨中也含有极少量的H2SO4。它是化学工业上人们常说的“三酸两碱”中的一酸。
还有二酸是盐酸,人的胃液中含有盐酸。
还有硝酸:酸雨中还含有极少量的HNO3。(因含有氮元素,是制化肥的原料等)。
下面我们就来学习硫酸和盐酸。
它们是一种什么样的物质?它们又有哪些性质呢?
物质的性质一般有物理性质和化学性质等。(复习什么是物理性质。)
(下面开展一项活动)
讲台上有一瓶浓硫酸,一瓶浓盐酸和一瓶蒸馏水。
选出学生代表走到讲台上进行实验
(可观察酸的颜色、状态,拿起酸和水的瓶子比较它们的重,打开酸的瓶盖闻一闻气味。
出示幻灯片:扇气入鼻——闻气味的正确方法
化学实验中有时需要闻一些气体的气味,为了安全, 不能用力用力猛吸, 应该用手轻轻扇动, 只使少量的气体进入 鼻腔即可。
下面由学生代表告诉全班同学结果。
然后小组讨论设计一个记录浓硫酸和浓盐酸的物理性质的表格(并记录结果):
浓盐酸和浓硫酸的物理性质:
老师总结:浓盐酸和浓硫酸的物理性质:
盐酸是氯化氢气体的水溶液。纯净的浓盐酸是无色液体,有刺激性气味,有酸味,工业用浓盐酸常因含有杂质(FeCl3)而带黄色。常用的浓盐酸密度约为1.19g/cm3(含HCl约37%)。浓盐酸易挥发,在空气中会生成白雾,这是因为从浓盐酸里挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸的小液滴的缘故。
纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。常用的浓硫酸密度为1.84g/cm3(含H2SO4约98%)。浓硫酸易溶于水,溶解时放出大量热。
(1) 并解释为什么要密封保存?
(2) 利用掌握的这两种酸的物理性质写出区分浓盐酸和浓硫酸的方法
答:①观察两者状态。粘稠、油状的为浓硫酸。
②打开瓶盖,会冒白雾的为浓盐酸。
③取相同体积的两瓶酸,较重的为浓硫酸。
(3) 如果取两瓶质量相同的浓盐酸和浓硫酸都打开瓶盖,过一段时间后,两瓶内酸的质量和浓度怎样变化?
老师解释:
下面我们来解释一下“黑面包”是怎样做出来的?
C12H22O11=====12C+11H2O (在H2SO4的作用下)
C+2H2SO4===2SO2+CO2+2H2O
蔗糖(C12H22O22)是由C、H、O三种元素组成。而浓硫酸能把三种元素中H、O以水分子的构成夺取出来(变成水),剩下就是C元素(黑色)。即变黑,叫脱水炭化。即(1)浓硫酸具有脱水性或具有腐蚀性。
浓硫酸与一些物质的反应
1.小心地用小木棍蘸少量浓硫酸滴到一小块棉布和一小块涤纶
布上,放置一会后,观察并记录现象: 棉布上的现象是 发黑
涤纶布上的现象 褪色、发黑
小木棍上的现象是 发黑
2.向试管中加入2ml水,再小心地滴入2滴浓硫酸,轻轻振荡试管。
用手触摸试管外壁,记录下你的感觉和解释:
试管发热,因为浓硫酸溶于水时要放出大量的热。
3.根据以上实验,讨论应如何安全使用浓硫酸。
二.安全使用浓硫酸
日常生活用品中,纸张、木材、布料、人的皮肤等都会有C、H、O三种元素,棉布和小木棍主要成分都是纤维素、碳水化合物,都很容易受浓硫酸腐蚀而炭化。
可看到发黑现象。
下面我们分组实验(提示必须要小心,因为浓硫酸有较强的腐蚀性)
出示幻灯片:
怎样安全使用浓硫酸
1. 千万不要用手直接接触浓硫酸; 2.浓硫酸要存放在安全的地方; 3.决不能用浓硫酸泼向人或动物以及任何非实验必须的物品等,防止各种事故发生。
(因实验时要用到稀硫酸),所以
怎样稀释浓硫酸?(浓→稀)
出示幻灯片:浓硫酸与水反应剧烈,放出大量的热,所以稀释浓硫酸时,一定要把
浓硫酸沿着玻璃棒或器壁慢慢注入水中,并不断搅拌。切不可将水倒入浓硫酸里。
为什么?
如果把水倒进浓硫酸里,由于水的密度比浓硫酸小,它就浮在浓硫酸上面,浓硫酸溶解时放出的热量会形成局部高温,使水翻腾致使酸液飞涨,造成事故。
如果不慎将浓硫酸沾到了皮肤或衣服上,应立即用布吸干,再用
大量水冲洗,然后涂上3%—5%的碳酸氢钠溶液(NaHCO3)。
盐酸和硫酸的用途:
(4)
(5)
。。。。
这节课我们学了哪些内容:
1.盐酸的物理性质:
纯洁盐酸无色、有刺激性气味,工业盐酸因含FeCl3等杂质而显黄色,浓盐酸易挥发出氯化氢气体并跟空气中的水蒸气形成盐酸小液滴(白雾)。
2.浓硫酸的物理性质:
浓硫酸是无色、粘稠、油状的液体,有强烈的吸水性(可作干燥剂),易溶于水且同时放出大量的热(稀释时一定要使浓硫酸沿玻璃棒或容器壁慢慢注入水中,并不断搅拌)。
3.浓硫酸具有脱水性和强腐蚀性(使纸张、蔗糖等炭化变黑,会烧伤皮肤、腐蚀衣服。若不慎将浓硫酸沾到皮肤上,应立即用布吸干,再用大量水冲洗,然后涂上3%--5%的碳酸氢钠溶液)。
4.酸的用途:
盐酸用于金属除绣、制药物、助消化等;硫酸用于生产化肥、金属除绣、精练石油等。
1.浓硫酸和浓盐酸为什么要密封保存
2.利用掌握的这两种酸的物理性质说出区分浓硫酸和浓盐酸的方法
3.如果取两瓶质量相同的浓盐酸和浓硫酸都打开瓶盖,过一段时间后,两瓶内酸的质量和浓度怎样变化
布置作业:
(1) 课本P12 1、2、3
(2) 作业本B本P1-2 重要的酸(一)
颜色
状态
气味
密度
水溶性
浓盐酸
无色
液体
有刺激性
气味
1.19g/cm3
(37%左右)
易溶于水
有强烈的
挥发性
浓硫酸
无色
粘稠、油状的液体
没有气味
1.84g/cm3
(98%)
易溶于水
有强烈的
吸水性
浓硫酸是实验室常用的干燥剂
用作干燥剂
硫酸、盐酸均可用于
金属表面除绣
金属表面除绣
盐酸可用于制造盐酸
麻黄素等药物
制造药物
生产化肥
硫酸用于精炼石油
硫酸用于生产硫酸铵等化肥
精练石油
胃液中的盐酸帮助消化食物
帮助消化
酸
