探索酸的性质[上学期]
图片预览





文档简介
课件15张PPT。第二节 探索酸的性质一 、几个定义:
电离:
酸:
碱:
盐:
酸碱指示剂:
中和反应:一些物质溶解于水或受热熔化而离解成自由移动的离子的过程。电离产生的阳离子全都是氢离子的一类物质。电离产生的阴离子全都是氢氧根离子的一类物质。由金属阳离子和酸根阴离子构成的一类物质。在酸或碱溶液里能显示不同颜色的物质。酸碱作用生成盐和水的反应。二、酸的性质:1、与酸碱指示剂反应:
2、与某些金属反应:
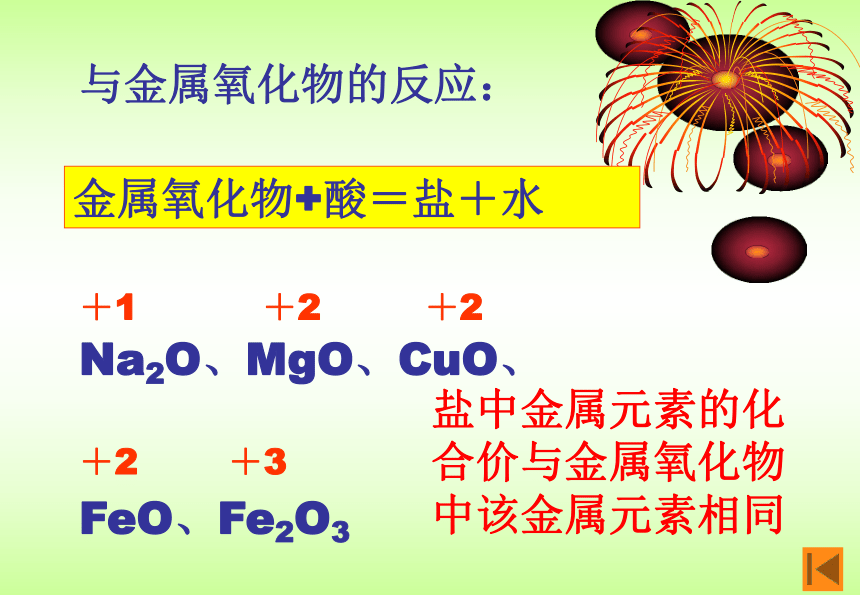
3、与金属氧化物反应:
4、与碱反应:
5、与某些盐反应:与某些金属反应:钠、镁、铝、铁、锌等金属2Na+2HCl=2NaCl+H2↑Mg+H2SO4=MgSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Zn+H2SO4=ZnSO4+H2↑金属+酸=盐+H2 ↑与金属氧化物的反应:
Na2O、MgO、CuO、
FeO、Fe2O3金属氧化物+酸=盐+水+1+2+2+2+3盐中金属元素的化合价与金属氧化物中该金属元素相同Na2O
MgO
CuO
FeO
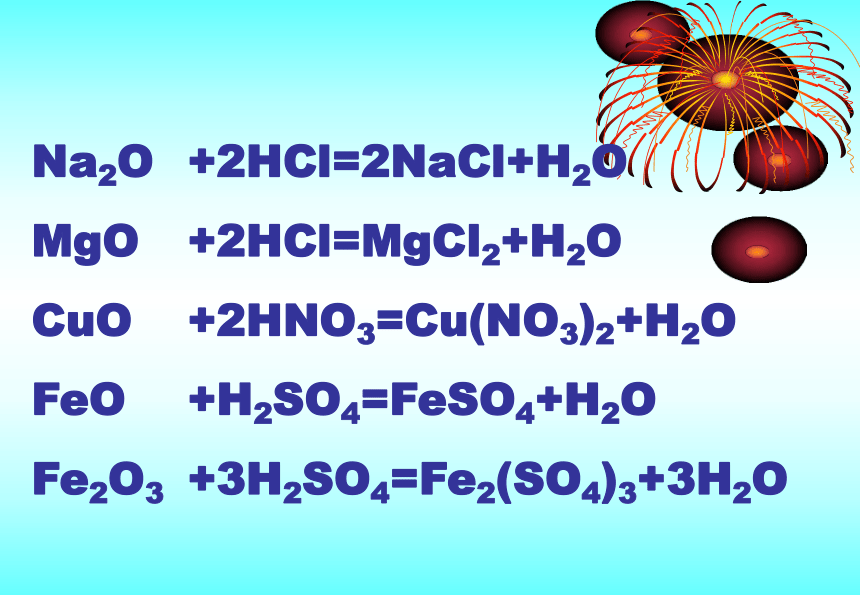
Fe2O3+2HCl=2NaCl+H2O
+2HCl=MgCl2+H2O
+2HNO3=Cu(NO3)2+H2O
+H2SO4=FeSO4+H2O
+3H2SO4=Fe2(SO4)3+3H2O
与碱的反应: 碱+酸=盐+水NaOH
Ca(OH)2
Fe(OH)3
Ba(OH)2 +HCl=NaCl+H2O+2HCl=CaCl2+2H2O+H2SO4=BaSO4↓+2H2O +3HNO3=Fe (NO3)3+3H2O 与某些盐的反应: 盐 + 酸 =新盐+新酸 反应条件:有沉淀、气体或水生成。Na2CO3+ HCl
AgNO3+HCI
BaCO3+ HNO3
Ba(NO3)2+H2SO4 2 =2NaCl+H2O+CO2↑ 2 =Ba(NO3)2+H2O+CO2↑=AgCl↓+HNO3=BaSO4↓+2HNO3酸的个性:硫酸:可做干燥剂将有机物炭化盐酸:挥发性与银盐产生白色沉淀用于检验盐酸的存在;(尤其是Cl-的存在) 练习:1、化学式的书写:硝酸、硝酸钠、硝酸铜、硝酸铁氧化钠、氧化镁、氧化铝、氧化铁硫酸、硫酸铜、硫酸钾、硫酸铝、硫酸亚铁书写原则:正价在左,负价在右;
化合价代数和为零。2、电离方程式的书写: 左边 右边
化学式=阳离子符号+阴离子符号 HCI = H+ + Cl- CuCl2 = Cu2+ + 2Cl- AgNO3= Ag+ + NO3- Fe2(SO4)3 = 2Fe3+ + 3SO42-3、化学方程式的书写: HClH2SO4作业:
自主练习手册5~6页填空、选择题完成。
完成课堂上化学方程式书写。
电离:
酸:
碱:
盐:
酸碱指示剂:
中和反应:一些物质溶解于水或受热熔化而离解成自由移动的离子的过程。电离产生的阳离子全都是氢离子的一类物质。电离产生的阴离子全都是氢氧根离子的一类物质。由金属阳离子和酸根阴离子构成的一类物质。在酸或碱溶液里能显示不同颜色的物质。酸碱作用生成盐和水的反应。二、酸的性质:1、与酸碱指示剂反应:
2、与某些金属反应:
3、与金属氧化物反应:
4、与碱反应:
5、与某些盐反应:与某些金属反应:钠、镁、铝、铁、锌等金属2Na+2HCl=2NaCl+H2↑Mg+H2SO4=MgSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Zn+H2SO4=ZnSO4+H2↑金属+酸=盐+H2 ↑与金属氧化物的反应:
Na2O、MgO、CuO、
FeO、Fe2O3金属氧化物+酸=盐+水+1+2+2+2+3盐中金属元素的化合价与金属氧化物中该金属元素相同Na2O
MgO
CuO
FeO
Fe2O3+2HCl=2NaCl+H2O
+2HCl=MgCl2+H2O
+2HNO3=Cu(NO3)2+H2O
+H2SO4=FeSO4+H2O
+3H2SO4=Fe2(SO4)3+3H2O
与碱的反应: 碱+酸=盐+水NaOH
Ca(OH)2
Fe(OH)3
Ba(OH)2 +HCl=NaCl+H2O+2HCl=CaCl2+2H2O+H2SO4=BaSO4↓+2H2O +3HNO3=Fe (NO3)3+3H2O 与某些盐的反应: 盐 + 酸 =新盐+新酸 反应条件:有沉淀、气体或水生成。Na2CO3+ HCl
AgNO3+HCI
BaCO3+ HNO3
Ba(NO3)2+H2SO4 2 =2NaCl+H2O+CO2↑ 2 =Ba(NO3)2+H2O+CO2↑=AgCl↓+HNO3=BaSO4↓+2HNO3酸的个性:硫酸:可做干燥剂将有机物炭化盐酸:挥发性与银盐产生白色沉淀用于检验盐酸的存在;(尤其是Cl-的存在) 练习:1、化学式的书写:硝酸、硝酸钠、硝酸铜、硝酸铁氧化钠、氧化镁、氧化铝、氧化铁硫酸、硫酸铜、硫酸钾、硫酸铝、硫酸亚铁书写原则:正价在左,负价在右;
化合价代数和为零。2、电离方程式的书写: 左边 右边
化学式=阳离子符号+阴离子符号 HCI = H+ + Cl- CuCl2 = Cu2+ + 2Cl- AgNO3= Ag+ + NO3- Fe2(SO4)3 = 2Fe3+ + 3SO42-3、化学方程式的书写: HClH2SO4作业:
自主练习手册5~6页填空、选择题完成。
完成课堂上化学方程式书写。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
