2017-2018学年鲁科版选修4课件: 第二章 第四节 化学反应条件的优化——工业合成氨课件(44张)
文档属性
| 名称 | 2017-2018学年鲁科版选修4课件: 第二章 第四节 化学反应条件的优化——工业合成氨课件(44张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-30 00:00:00 | ||
图片预览









文档简介
课件44张PPT。第四节 化学反应条件的优化--工业合成氨弗里茨·哈伯与合成氨 合成氨从第一次实验室研制到工业化投产经历了约150年的时间。德国科学家哈伯在10年的时间内进行了无数次的探索,单是寻找高效稳定的催化剂,2年间他们就进行了多达6500次试验,测试了2500种不同的配方,最后选定了一种合适的催化剂--铁,使合成氨的设想在1913年成为工业现实。鉴于合成氨工业的实现,瑞典皇家科学院于1918年向哈伯颁发了诺贝尔化学奖。化学反应条件的优化
----工业合成氨分析:合成氨的反应特点可逆放热减小生产宗旨 产品的产率高
(生产的多) → 化学反应限度问题
产品生产周期短
(生产的快) → 化学反应速率问题合成氨反应有哪些特点?①可逆反应③正反应气体体积缩小④正反应是放热反应②熵减小的反应ΔS<0 N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
(1体积) (3体积) (2体积)合成氨反应是一个可逆反应: N2(g)+3H2(g) 2NH3(g)
已知298 K时: ΔH=-92.2 kJ·mol-1
ΔS =-198.2 J·K-1·mol-1
合成氨反应的平衡常数K=4.1×106(mol·L-1)-2
请根据正反应的焓变和熵变分析298 K下合成氨反应能否自发进行?ΔH-TΔS =-92.2 kJ·mol-1+298 K×198.2×
10-3 kJ·k-1·mol-1因为ΔH-TΔS<0,298 K下合成氨反应能自发进行1:1 1:2 1:3 1:4 1:5 1:6 0.60.50.40.30.20.1NH3%N2:H2一、合成氨的反应限度请同学们根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨生成的多?___温、___压有利于化学平衡正向移动,N2、H2浓度比为_____有利于化学平衡正向移动。高低1:3二、合成氨反应的速率结合影响反应速率的因素,思考什么条件 能使氨生成的快?升高温度
增大压强
增大反应物浓度
使用催化剂高压高压低温高温使用无影响增大浓度增大浓度减小浓度减小浓度不同条件下平衡混合气中氨的体积分数思考相同温度时增大压强,反应的程度如何变化?反应的程度越大。不同条件下平衡混合气中氨的体积分数思考相同压强时升高温度,反应的程度如何变化?反应的程度越小高压高温使用高压低温不影响根据外界条件对反应速率和反应限度的影响,
请为工业合成氨选择合适的条件:N2(g)+3H2(g) 2NH3(g) ΔH =-92.4 kJ·mol-1 适宜温度(500℃左右)使用铁触媒作催化剂N2和H2的物质的量比为1:2.8的投料比, 氨及时从混合气中分离出去2×107~5×107 Pa催化剂活性大1.一般要使用催化剂:
2.选择合适的温度:
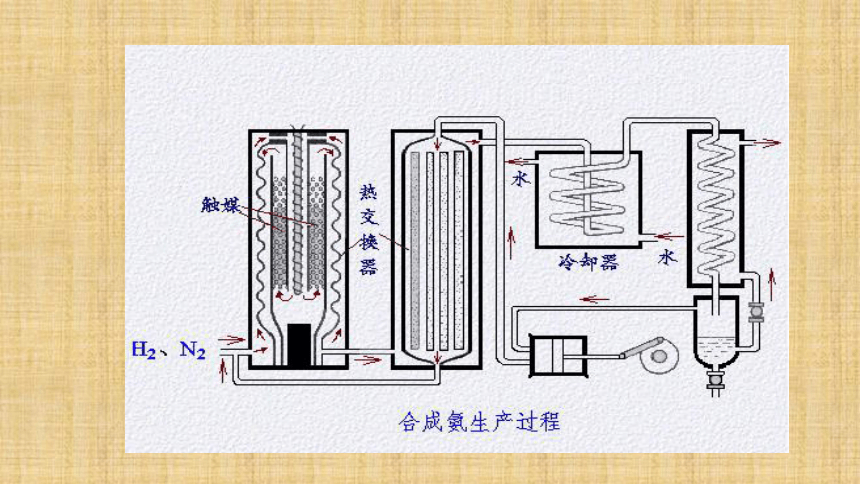
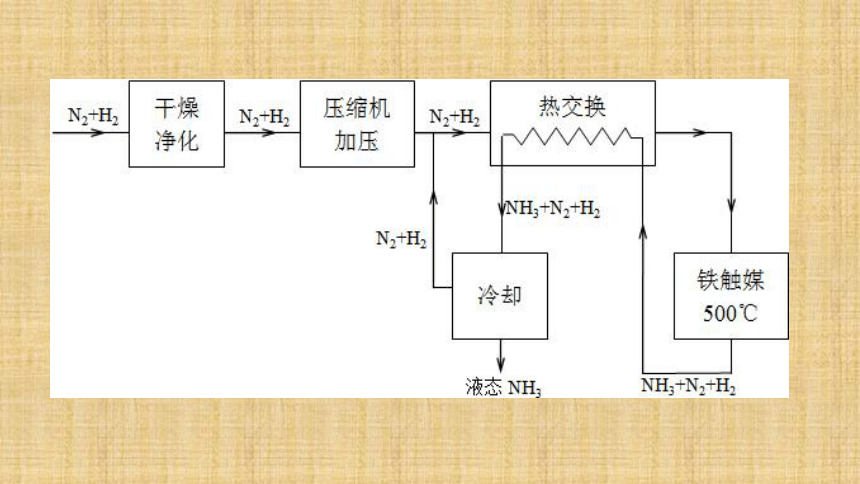
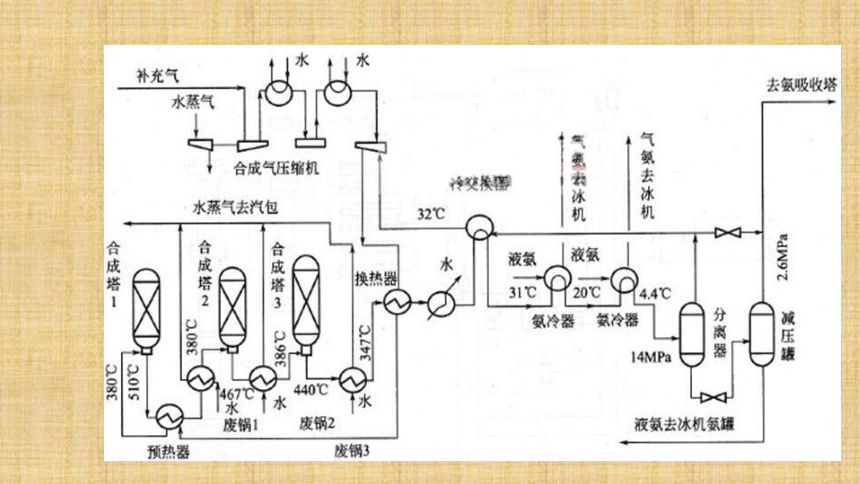
3.选择合适的压强:既要考虑化学反应速率和化学平衡,还要综合考虑设备等。该温度是催化剂活性最大的温度;加快化学反应速率,提高生产效率,提高经济效益;工业上利用某可逆反应生产产品有哪些注意事项? 四、工业流程 造气
净化
合成氨原料气的制备煤、石油、天然气、石脑油等净化造气N2和H2循环利用简要流程合成氨工业简述:1.主要流程:原料气制取→净化 →压缩 →合成→分离→液氨2.原料气制取:制氮气:(造气)(净化)(合成氨)制氢气:平衡时NH3含量
合成氨工业的现状及发展趋势
一、我国合成氨工业已走过了五十多年的路程,从小到大从弱到强,从3000吨/年——5000吨/年到45万吨/年,从碳铵到尿素。根据中国氮肥协会统计2011年合成氨产量5864.1万吨/年,位居世界第一,其中88%用来生产化肥;30万吨/年工厂有74家约占49.4%,8万吨/年上以工厂有223家占82.4%,合成氨工业由3000吨/年发展到今天40万吨/年(单系列),全国从1000个厂到今只有300个厂,然而总产量不但没有下降,反而有所增加,尿素2011年出口355.95万吨,从而保证了粮食生产连年丰收。(据农业部门反映一吨尿素可增产粮食几吨),我国粮食为什么连年丰收增产,一是靠国家支农、惠农、护农政策,二是靠优良品种,三是靠化肥支撑。因此对于我们这样一个有13.4亿人的大国,如果粮食生产不能稳定,那是不堪设想的。因此合成氨工业是国家发展的需要,也是人民生活的需要。二、我国合成氨工业发展趋势 由于我国人多地少,粮食需求量大,因此合成氨工业必须由小变大,向大型化、现代化发展,过去小规模用块煤的技术已远远不能满足国民经济发展需要,发展趋势主要是: 1.由小变大,扶大压小; 2.由块煤变粉煤; 3.由低压向中压、高压气化发展; 具体有以下几点: 1.中压、高压造气 不管用水煤浆气化炉、干粉煤气化炉,还是块煤炉,流化床气化炉都要向中压、高压发展,现在有的气化炉已做到8.7Map,一般都在4.0Map左右。 透平压缩这样可以省电3%左右。 2.低压合成氨。 过去为了追求产量合成氨压力由低压向高压发展,现在从降低能耗的角度又能向低压,目前已成功运用15Map,10Map即正在试验中,这样可以做到电耗最低。 3.高度净化,为了保证催化剂长周期运行气体净化已达到PPM级,甚至PPb级。 4.消灭三废,最少做到达标排放,最终做到零排放。三、合成氨工业发展对空分的要求,由于合成氨工业向大型化发展,因此对空分也提出了由小向大型发展的要求,从几千米3/时到几万米3/时,同时O2纯度N2纯度也提出了更高的要求。同步练习1.下列有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体,其中氨气只占13%~14%,所以生产氨的工厂效率都很低
B.由于氨易液化,氮气、氢气是循环使用的,总体来讲氨的产率比较高
C.合成氨反应温度不采用常温而选择500 ℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107 Pa~5×107 Pa,因为该压强下铁触媒的活性最大B【思路点拨】(1)n(N2)∶n(H2)=1∶3
(2)500 ℃有利于加快反应速率,且此时催化剂活性最大。
【自主解答】选B。虽然从合成塔出来的混合气体中氨气只占13%~14%,但由于氮气、氢气是循环使用的,总体来讲氨的产率比较高;合成氨的反应是放热反应,选择高温不利于氨气的合成,选择500 ℃左右的温度利于提高化学反应速率和增大催化剂的活性;催化剂的活性取决于温度的大小,而不是取决于压强的高低。
2.在一密闭容器中,N2、H2合成氨的反应已达到平衡。此时再往容器中通入一定量N2,保持温度和容器体积不变,当反应再次达到平衡时,与第一次平衡状态相比
( )
A.NH3的百分含量增大
B.NH3的浓度减小
C.H2的转化率提高
D.N2的转化率提高C【解析】选C。N2、H2合成氨的反应已达到平衡,此时再往容器中通入一定量N2,保持温度和容器体积不变,那么N2的浓度增大,所以平衡会向正反应方向移动,H2的转化率增大,NH3的浓度也会增大,但气体总物质的量增多,NH3的百分含量不一定增大。3.工业合成氨时,必须除去原料气中的杂质,其主要原因是( )
A.减小副反应
B.提高N2、H2的浓度
C.防止催化剂中毒
D.有利于平衡移动
【解析】选C。因为杂质的存在,会引起催化剂中毒。C4.工业上用氢气和一氧化碳气体在一定条件下反应生
产甲醇CO(g)+2H2(g) CH3OH(g) (正反应是放热反
应)为了提高甲醇的产量,从理论上讲下列措施中正
确的是( )
A.高温高压 B.高温低压
C.低温低压 D.低温高压
【解析】选D。这是一个气体体积减小的放热反应,为了提高甲醇的产量,应尽可能让平衡向正反应方向移动,则低温高压是使平衡向正向移动的条件。D5.能够使合成氨进行的程度增大的措施是( )
A.升高温度 B.降低压强
C.使用催化剂 D.不断移去NH3
【解析】选D。使合成氨反应进行的程度增大,也就是使化学反应平衡向着生成NH3的方向移动。升高温度、降低压强,平衡向着NH3减少的方向移动,使用催化剂平衡不移动,不断移去NH3,减小了生成物浓度,平衡向着生成NH3的方向移动。D6.从化学反应速率和化学平衡两方面考虑,合成氨应采用的条件是( )
A.低温、高压、催化剂
B.低温、低压、催化剂
C.高温、高压、催化剂
D.适当温度、高压、催化剂D【解析】选D。高温时反应速率快,但不利于平衡限度,故选择适当温度,高压有利于平衡右移,提高NH3产率,使用催化剂会加快反应速率,提高生产效率。7.下列事实能用勒·夏特列原理解释的是( )
A.使用铁触媒有利于氨的合成
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
【解析】选B。由于使用铁触媒能同等程度地加快正、逆
反应速率,v(正)和v(逆)仍然保持相等,所以它不破
坏化学平衡状态,平衡不发生移动,只能缩短达到合成氨
平衡的时间,显然选项A不能用勒·夏特列原理解释;合
成NH3的反应特点之一是正反应是气体体积缩小的反应,B当其他条件不变时,增大压强平衡向气体体积减小的方向移动,所以高压将有利于NH3的合成,选项B符合题意;合成NH3反应的另一特点是正反应为放热反应,低温虽有利于平衡向正反应方向移动,但反应速率太慢,生产周期太长,所以在生产上一般采用提高温度(500 ℃)加快反应速率的方法来提高NH3的生产效率,另一方面选用500 ℃考虑到此温度下催化剂活性最大,因此选项C不能用勒·夏特列原理来解释;合成氨采用循环操作,并没有涉及化学平衡的移动,因此选项D不能用勒·夏特列原理解释。8.关于氨的合成工业的下列说法正确的是( )
A.从合成塔出来的气体中氨一般占15%,所以工业生产氨的效率都很低
B.由于NH3易液化,N2、H2可循环使用,因此总的来说工业合成氨的产率很高
C.合成氨工业的反应温度控制在500 ℃左右,目的是使平衡向正反应方向移动
D.合成氨工业采用20 MPa~50MPa的压强,是因为该条件下催化剂的活性最好B9.在一定条件下,合成氨反应达到平衡后,混合气体中NH3的
体积占25%,若反应前后条件保持不变,则反应后缩小的气体
体积与原反应物体积之比是( )
A.1/5 B.1/4 C.1/3 D.1/2A
----工业合成氨分析:合成氨的反应特点可逆放热减小生产宗旨 产品的产率高
(生产的多) → 化学反应限度问题
产品生产周期短
(生产的快) → 化学反应速率问题合成氨反应有哪些特点?①可逆反应③正反应气体体积缩小④正反应是放热反应②熵减小的反应ΔS<0 N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
(1体积) (3体积) (2体积)合成氨反应是一个可逆反应: N2(g)+3H2(g) 2NH3(g)
已知298 K时: ΔH=-92.2 kJ·mol-1
ΔS =-198.2 J·K-1·mol-1
合成氨反应的平衡常数K=4.1×106(mol·L-1)-2
请根据正反应的焓变和熵变分析298 K下合成氨反应能否自发进行?ΔH-TΔS =-92.2 kJ·mol-1+298 K×198.2×
10-3 kJ·k-1·mol-1因为ΔH-TΔS<0,298 K下合成氨反应能自发进行1:1 1:2 1:3 1:4 1:5 1:6 0.60.50.40.30.20.1NH3%N2:H2一、合成氨的反应限度请同学们根据合成氨反应的特点,利用影响化学平衡移动的因素,分析什么条件有利于氨生成的多?___温、___压有利于化学平衡正向移动,N2、H2浓度比为_____有利于化学平衡正向移动。高低1:3二、合成氨反应的速率结合影响反应速率的因素,思考什么条件 能使氨生成的快?升高温度
增大压强
增大反应物浓度
使用催化剂高压高压低温高温使用无影响增大浓度增大浓度减小浓度减小浓度不同条件下平衡混合气中氨的体积分数思考相同温度时增大压强,反应的程度如何变化?反应的程度越大。不同条件下平衡混合气中氨的体积分数思考相同压强时升高温度,反应的程度如何变化?反应的程度越小高压高温使用高压低温不影响根据外界条件对反应速率和反应限度的影响,
请为工业合成氨选择合适的条件:N2(g)+3H2(g) 2NH3(g) ΔH =-92.4 kJ·mol-1 适宜温度(500℃左右)使用铁触媒作催化剂N2和H2的物质的量比为1:2.8的投料比, 氨及时从混合气中分离出去2×107~5×107 Pa催化剂活性大1.一般要使用催化剂:
2.选择合适的温度:
3.选择合适的压强:既要考虑化学反应速率和化学平衡,还要综合考虑设备等。该温度是催化剂活性最大的温度;加快化学反应速率,提高生产效率,提高经济效益;工业上利用某可逆反应生产产品有哪些注意事项? 四、工业流程 造气
净化
合成氨原料气的制备煤、石油、天然气、石脑油等净化造气N2和H2循环利用简要流程合成氨工业简述:1.主要流程:原料气制取→净化 →压缩 →合成→分离→液氨2.原料气制取:制氮气:(造气)(净化)(合成氨)制氢气:平衡时NH3含量
合成氨工业的现状及发展趋势
一、我国合成氨工业已走过了五十多年的路程,从小到大从弱到强,从3000吨/年——5000吨/年到45万吨/年,从碳铵到尿素。根据中国氮肥协会统计2011年合成氨产量5864.1万吨/年,位居世界第一,其中88%用来生产化肥;30万吨/年工厂有74家约占49.4%,8万吨/年上以工厂有223家占82.4%,合成氨工业由3000吨/年发展到今天40万吨/年(单系列),全国从1000个厂到今只有300个厂,然而总产量不但没有下降,反而有所增加,尿素2011年出口355.95万吨,从而保证了粮食生产连年丰收。(据农业部门反映一吨尿素可增产粮食几吨),我国粮食为什么连年丰收增产,一是靠国家支农、惠农、护农政策,二是靠优良品种,三是靠化肥支撑。因此对于我们这样一个有13.4亿人的大国,如果粮食生产不能稳定,那是不堪设想的。因此合成氨工业是国家发展的需要,也是人民生活的需要。二、我国合成氨工业发展趋势 由于我国人多地少,粮食需求量大,因此合成氨工业必须由小变大,向大型化、现代化发展,过去小规模用块煤的技术已远远不能满足国民经济发展需要,发展趋势主要是: 1.由小变大,扶大压小; 2.由块煤变粉煤; 3.由低压向中压、高压气化发展; 具体有以下几点: 1.中压、高压造气 不管用水煤浆气化炉、干粉煤气化炉,还是块煤炉,流化床气化炉都要向中压、高压发展,现在有的气化炉已做到8.7Map,一般都在4.0Map左右。 透平压缩这样可以省电3%左右。 2.低压合成氨。 过去为了追求产量合成氨压力由低压向高压发展,现在从降低能耗的角度又能向低压,目前已成功运用15Map,10Map即正在试验中,这样可以做到电耗最低。 3.高度净化,为了保证催化剂长周期运行气体净化已达到PPM级,甚至PPb级。 4.消灭三废,最少做到达标排放,最终做到零排放。三、合成氨工业发展对空分的要求,由于合成氨工业向大型化发展,因此对空分也提出了由小向大型发展的要求,从几千米3/时到几万米3/时,同时O2纯度N2纯度也提出了更高的要求。同步练习1.下列有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体,其中氨气只占13%~14%,所以生产氨的工厂效率都很低
B.由于氨易液化,氮气、氢气是循环使用的,总体来讲氨的产率比较高
C.合成氨反应温度不采用常温而选择500 ℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107 Pa~5×107 Pa,因为该压强下铁触媒的活性最大B【思路点拨】(1)n(N2)∶n(H2)=1∶3
(2)500 ℃有利于加快反应速率,且此时催化剂活性最大。
【自主解答】选B。虽然从合成塔出来的混合气体中氨气只占13%~14%,但由于氮气、氢气是循环使用的,总体来讲氨的产率比较高;合成氨的反应是放热反应,选择高温不利于氨气的合成,选择500 ℃左右的温度利于提高化学反应速率和增大催化剂的活性;催化剂的活性取决于温度的大小,而不是取决于压强的高低。
2.在一密闭容器中,N2、H2合成氨的反应已达到平衡。此时再往容器中通入一定量N2,保持温度和容器体积不变,当反应再次达到平衡时,与第一次平衡状态相比
( )
A.NH3的百分含量增大
B.NH3的浓度减小
C.H2的转化率提高
D.N2的转化率提高C【解析】选C。N2、H2合成氨的反应已达到平衡,此时再往容器中通入一定量N2,保持温度和容器体积不变,那么N2的浓度增大,所以平衡会向正反应方向移动,H2的转化率增大,NH3的浓度也会增大,但气体总物质的量增多,NH3的百分含量不一定增大。3.工业合成氨时,必须除去原料气中的杂质,其主要原因是( )
A.减小副反应
B.提高N2、H2的浓度
C.防止催化剂中毒
D.有利于平衡移动
【解析】选C。因为杂质的存在,会引起催化剂中毒。C4.工业上用氢气和一氧化碳气体在一定条件下反应生
产甲醇CO(g)+2H2(g) CH3OH(g) (正反应是放热反
应)为了提高甲醇的产量,从理论上讲下列措施中正
确的是( )
A.高温高压 B.高温低压
C.低温低压 D.低温高压
【解析】选D。这是一个气体体积减小的放热反应,为了提高甲醇的产量,应尽可能让平衡向正反应方向移动,则低温高压是使平衡向正向移动的条件。D5.能够使合成氨进行的程度增大的措施是( )
A.升高温度 B.降低压强
C.使用催化剂 D.不断移去NH3
【解析】选D。使合成氨反应进行的程度增大,也就是使化学反应平衡向着生成NH3的方向移动。升高温度、降低压强,平衡向着NH3减少的方向移动,使用催化剂平衡不移动,不断移去NH3,减小了生成物浓度,平衡向着生成NH3的方向移动。D6.从化学反应速率和化学平衡两方面考虑,合成氨应采用的条件是( )
A.低温、高压、催化剂
B.低温、低压、催化剂
C.高温、高压、催化剂
D.适当温度、高压、催化剂D【解析】选D。高温时反应速率快,但不利于平衡限度,故选择适当温度,高压有利于平衡右移,提高NH3产率,使用催化剂会加快反应速率,提高生产效率。7.下列事实能用勒·夏特列原理解释的是( )
A.使用铁触媒有利于氨的合成
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
【解析】选B。由于使用铁触媒能同等程度地加快正、逆
反应速率,v(正)和v(逆)仍然保持相等,所以它不破
坏化学平衡状态,平衡不发生移动,只能缩短达到合成氨
平衡的时间,显然选项A不能用勒·夏特列原理解释;合
成NH3的反应特点之一是正反应是气体体积缩小的反应,B当其他条件不变时,增大压强平衡向气体体积减小的方向移动,所以高压将有利于NH3的合成,选项B符合题意;合成NH3反应的另一特点是正反应为放热反应,低温虽有利于平衡向正反应方向移动,但反应速率太慢,生产周期太长,所以在生产上一般采用提高温度(500 ℃)加快反应速率的方法来提高NH3的生产效率,另一方面选用500 ℃考虑到此温度下催化剂活性最大,因此选项C不能用勒·夏特列原理来解释;合成氨采用循环操作,并没有涉及化学平衡的移动,因此选项D不能用勒·夏特列原理解释。8.关于氨的合成工业的下列说法正确的是( )
A.从合成塔出来的气体中氨一般占15%,所以工业生产氨的效率都很低
B.由于NH3易液化,N2、H2可循环使用,因此总的来说工业合成氨的产率很高
C.合成氨工业的反应温度控制在500 ℃左右,目的是使平衡向正反应方向移动
D.合成氨工业采用20 MPa~50MPa的压强,是因为该条件下催化剂的活性最好B9.在一定条件下,合成氨反应达到平衡后,混合气体中NH3的
体积占25%,若反应前后条件保持不变,则反应后缩小的气体
体积与原反应物体积之比是( )
A.1/5 B.1/4 C.1/3 D.1/2A
