2017-2018学年鲁科版选修4课件: 第三章第三节 沉淀溶解平衡(第1课时) 课件(35张)
文档属性
| 名称 | 2017-2018学年鲁科版选修4课件: 第三章第三节 沉淀溶解平衡(第1课时) 课件(35张) |  | |
| 格式 | zip | ||
| 文件大小 | 569.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-30 16:55:45 | ||
图片预览










文档简介
课件35张PPT。第1课时 沉淀溶解平衡与溶度积第三单元 第三节 学习目标定位
1.知道沉淀溶解平衡的概念及其影响因素。
2.明确溶度积和浓度商的关系,并由此学会判断反应进行
的方向。一 沉淀溶解平衡及其影响因素二 溶度积常数内容索引达标检测 提升技能一 沉淀溶解平衡及其影响因素1.在装有少量难溶的PbI2黄色固体的试管中,加入约3 mL蒸馏水,充分振荡后静置。
(1)若在上层清液中滴加浓的KI溶液,观察到的现象是________________ _______。
(2)由上述实验得出的结论是______________________________________ _______。
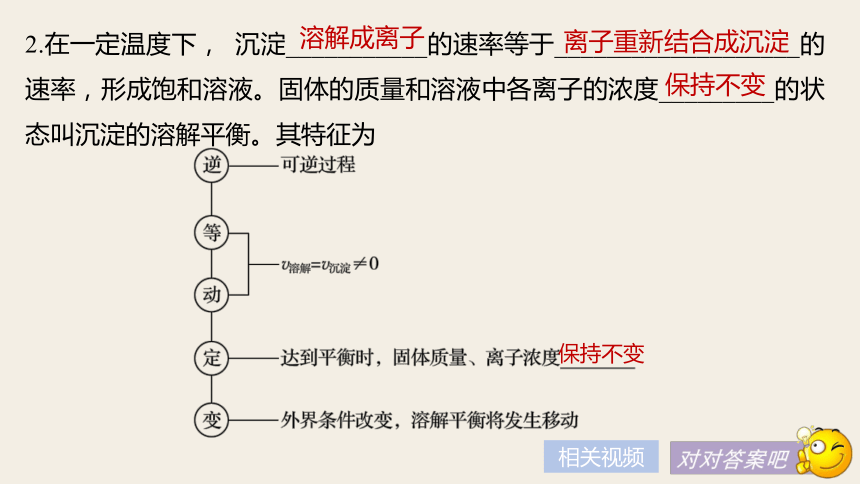
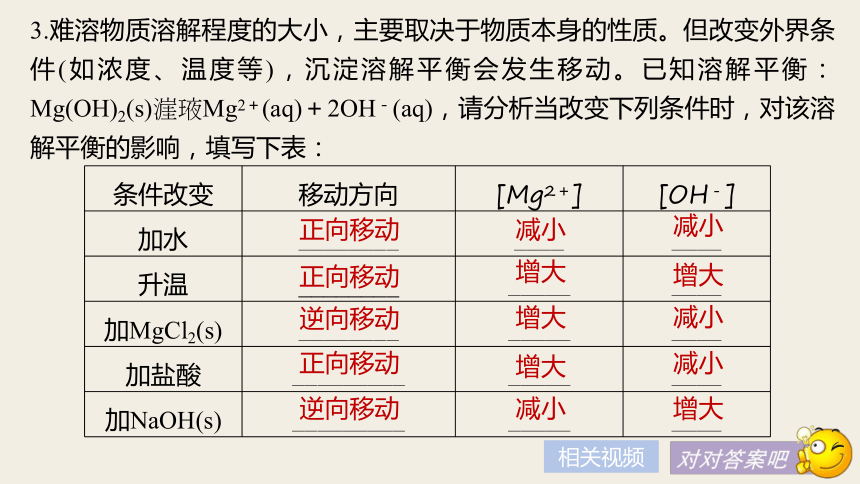
(3)PbI2溶于水的平衡方程式是___________________________。PbI2(s)??Pb2+(aq)+2I-(aq)新知导学色沉淀上层清液中出现黄原上层清液中含有Pb2+,PbI2在水中存在溶解平衡2.在一定温度下, 沉淀___________的速率等于___________________的速率,形成饱和溶液。固体的质量和溶液中各离子的浓度_________的状态叫沉淀的溶解平衡。其特征为溶解成离子离子重新结合成沉淀保持不变保持不变相关视频减小减小3.难溶物质溶解程度的大小,主要取决于物质本身的性质。但改变外界条件(如浓度、温度等),沉淀溶解平衡会发生移动。已知溶解平衡:Mg(OH)2(s)??Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该溶解平衡的影响,填写下表:正向移动增大增大正向移动增大减小逆向移动增大减小正向移动减小增大逆向移动相关视频外界条件改变对溶解平衡的影响
(1)温度升高,多数溶解平衡向溶解的方向移动。
(2)加水稀释,浓度减小,溶解平衡向溶解方向移动。
(3)加入与难溶电解质构成微粒相同的物质,溶解平衡向生成沉淀的方向移动。
(4)加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。 1.把氢氧化钙放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s)??Ca2+(aq)+2OH-(aq),加入以下溶液,可使Ca(OH)2(s)减少的是
A.Na2S溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液活学活用 答案 解析Na2S水解显碱性,增大了溶液中OH-的浓度;
NaOH会提供大量OH-;
CaCl2会增大Ca2+的浓度,所以A、C、D选项都会使溶解平衡向左移动。而AlCl3中的Al3+可与OH-发生反应生成Al(OH)3沉淀,使平衡向右移动,促进Ca(OH)2的溶解。 2.一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol·L-1 KCl溶液 ②30 mL 0.02 mol·L-1 CaCl2溶液 ③40 mL 0.03 mol·L-1 HCl溶液 ④10 mL 蒸馏水 ⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>① 答案 解析AgCl(s)??Ag+(aq)+Cl-(aq),[Cl-]或[Ag+]越大,对AgCl的溶解抑制作用越大,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①[Cl-]=0.01 mol·L-1,②[Cl-]=0.04 mol·L-1,③[Cl-]=0.03 mol·L-1,④[Cl-]=0 mol·L-1,⑤[Ag+]=0.05 mol·L-1;
Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的排列顺序为④>①>③>②>⑤。二 溶度积常数1.在一定温度下,沉淀达溶解平衡后的溶液为_____溶液,其离子浓度_____________,溶液中各离子浓度幂之积为常数,叫做___________(简称_______),用____表示。
2.写出下列沉淀溶解平衡的溶度积常数的表达式
(1)AgCl(s)??Ag+(aq)+Cl-(aq)
Ksp=__________;
(2)Fe(OH)3(s)??Fe3+(aq)+3OH-(aq)
Ksp=____________;
(3)AmBn(s)??mAn+(aq)+nBm-(aq)
Ksp=____________。新知导学[Ag+][Cl-]不再发生变化溶度积常数溶度积Ksp饱和[Fe3+][OH-]3[An+]m[Bm-]n3.溶度积(Ksp)反映了难溶电解质在水中的溶解能力。当化学式所表示的组成中,阴、阳离子个数比相同时,Ksp的数值越大,难溶电解质在水中的溶解能力_____。
常见难溶电解质的溶度积与溶解度(25 ℃)越强由表可知AgCl、AgBr、AgI的溶解度大小顺序为_______________。
BaSO4和CaCO3的溶解度相对大小为_____________。
4.通过比较溶度积与溶液中有关离子浓度幂的乘积——浓度商Q的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Q>Ksp,溶液过饱和,有_____析出,直至溶液_____,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于_________。
(3)QAgBr>AgIBaSO4Ksp大小反映难溶电解质的溶解能力,Ksp越小,说明难溶物越难溶解。
(1)相同类型的物质,溶度积越小,其溶解度越小。
(2)不同类型的电解质,溶度积小的电解质的溶解度不一定比溶度积大的溶解度小。
2.溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关,与浓度无关。 3.在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中活学活用 答案 解析在BaSO4饱和溶液中加入少量的BaCl2溶液,平衡BaSO4(s)??Ba2+(aq)+
(aq)左移,则此时[Ba2+]>[ ];
由于温度未发生改变,所以溶液中Ksp=[Ba2+][ ]不变。 4.已知Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(AgBr)=5.0×10-13 mol2·L-2,Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3。某溶液中含有Cl-、Br-和CrO ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 答案 解析要产生AgCl沉淀,c(Ag+)> mol·L-1=1.8×10-8 mol·L-1;
要产生AgBr沉淀,c(Ag+)> mol·L-1=5.0×10-11 mol·L-1;
要产生Ag2CrO4,需c2(Ag+)c(CrO )>Ksp(Ag2CrO4)=9.0×10-12,
即c(Ag+)> mol·L-1=3.0×10-5 mol·L-1;
显然产生沉淀的先后顺序为Br-、Cl-、 。达标检测 提升技能1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是
A.AgCl沉淀的生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度不变
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 答案 解析√1234AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;
升高温度,AgCl溶解度增大,C错;
向平衡体系中加入NaCl固体,增大了Cl-浓度,溶解平衡左移,AgCl溶解度减小,D错。52.把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)??Ca2+(aq)+2OH-(aq),下列叙述正确的是
A.给溶液加热,溶液的pH升高
B.恒温下向溶液中加入CaO,溶液的pH升高
C.向溶液中加入Na2CO3溶液,Ca(OH)2固体增多
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体增多 答案 解析√1234512345A项,加热时Ca(OH)2溶解度减小,平衡逆向移动,OH-浓度减小,pH
减小;
B项,CaO+H2O===Ca(OH)2,由于保持恒温,Ca(OH)2溶解度不变,OH-浓度不变,因此pH不变;
C项, +Ca2+===CaCO3↓,使平衡正向移动,Ca(OH)2固体减少;
D项,加入NaOH固体时,OH-浓度增大,平衡逆向移动,因此Ca(OH)2固体增多。3.下列说法中正确的是
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定
先生成沉淀
C.难溶盐电解质的Ksp与温度有关
D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 答案√12345 解析Ksp只与难溶电解质的性质和温度有关。4.下列说法正确的是
A.在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的溶度积是一个常数
B.已知AgCl的Ksp=1.8×10-10 mol2·L-2,则在任何含AgCl固体的溶液中,
[Ag+]=[Cl-],且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2
C.Ksp数值越大的难溶电解质在水中的溶解能力越强
D.难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响 解析1234 答案√512345由溶度积常数定义可知,一定温度下Ksp=[Ag+][Cl-]为一常数,A项
正确;
若在含AgCl固体的溶液中溶有NaCl,则[Ag+]<[Cl-],但Ag+与
Cl-浓度的乘积仍等于1.8×10-10 mol2·L-2,B项错误;
当化学式所表示的组成中阴、阳离子个数比相同时,Ksp越大的难溶电解质在水中的溶解能力越强,C项错误;
难溶电解质的溶解度仍然受外界条件的影响,D项错误。5.(1)将AgCl分别投入下列溶液中:
①40 mL 0.03 mol·L-1的HCl溶液
②50 mL 0.03 mol·L-1的AgNO3溶液
③30 mL 0.02 mol·L-1的CaCl2溶液
④10 mL蒸馏水
AgCl的溶解度由大到小的顺序是______________。 答案 解析12345④>①=②>③在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)AgCl(s)??AgCl(aq)===Ag+(aq)+Cl-(aq)(注:s表示未溶解的固体,aq表示已被溶解但未电离的AgCl),当溶液中存在Ag+或者Cl-时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+或Cl-的浓度越大,逆向移动的程度越大,溶解度就越小。
以中性的水为参照,溶解度由大到小的顺序为④>①=②>③。12345(2)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,[Cu2+]=__________mol·L-1
{Ksp[Cu(OH)2]=2.2×10-20mol3·L-3}。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是____mol·L-1。 答案 解析123452.2×10-80.2pH=8时,[OH-]=10-6 mol·L-1,由硫酸铜的沉淀溶解平衡常数可知:Ksp=2.2×10-20 mol3·L-3=10-12 mol2·L-2×[Cu2+],得[Cu2+]=2.2×10-8 mol·L-1;
使Cu2+沉淀完全,已知[Cu2+]=0.1 mol·L-1,根据反应关系式:Cu2+~2H+得[H+]=0.2 mol·L-1。12345本课结束
1.知道沉淀溶解平衡的概念及其影响因素。
2.明确溶度积和浓度商的关系,并由此学会判断反应进行
的方向。一 沉淀溶解平衡及其影响因素二 溶度积常数内容索引达标检测 提升技能一 沉淀溶解平衡及其影响因素1.在装有少量难溶的PbI2黄色固体的试管中,加入约3 mL蒸馏水,充分振荡后静置。
(1)若在上层清液中滴加浓的KI溶液,观察到的现象是________________ _______。
(2)由上述实验得出的结论是______________________________________ _______。
(3)PbI2溶于水的平衡方程式是___________________________。PbI2(s)??Pb2+(aq)+2I-(aq)新知导学色沉淀上层清液中出现黄原上层清液中含有Pb2+,PbI2在水中存在溶解平衡2.在一定温度下, 沉淀___________的速率等于___________________的速率,形成饱和溶液。固体的质量和溶液中各离子的浓度_________的状态叫沉淀的溶解平衡。其特征为溶解成离子离子重新结合成沉淀保持不变保持不变相关视频减小减小3.难溶物质溶解程度的大小,主要取决于物质本身的性质。但改变外界条件(如浓度、温度等),沉淀溶解平衡会发生移动。已知溶解平衡:Mg(OH)2(s)??Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该溶解平衡的影响,填写下表:正向移动增大增大正向移动增大减小逆向移动增大减小正向移动减小增大逆向移动相关视频外界条件改变对溶解平衡的影响
(1)温度升高,多数溶解平衡向溶解的方向移动。
(2)加水稀释,浓度减小,溶解平衡向溶解方向移动。
(3)加入与难溶电解质构成微粒相同的物质,溶解平衡向生成沉淀的方向移动。
(4)加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。 1.把氢氧化钙放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s)??Ca2+(aq)+2OH-(aq),加入以下溶液,可使Ca(OH)2(s)减少的是
A.Na2S溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液活学活用 答案 解析Na2S水解显碱性,增大了溶液中OH-的浓度;
NaOH会提供大量OH-;
CaCl2会增大Ca2+的浓度,所以A、C、D选项都会使溶解平衡向左移动。而AlCl3中的Al3+可与OH-发生反应生成Al(OH)3沉淀,使平衡向右移动,促进Ca(OH)2的溶解。 2.一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol·L-1 KCl溶液 ②30 mL 0.02 mol·L-1 CaCl2溶液 ③40 mL 0.03 mol·L-1 HCl溶液 ④10 mL 蒸馏水 ⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>① 答案 解析AgCl(s)??Ag+(aq)+Cl-(aq),[Cl-]或[Ag+]越大,对AgCl的溶解抑制作用越大,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①[Cl-]=0.01 mol·L-1,②[Cl-]=0.04 mol·L-1,③[Cl-]=0.03 mol·L-1,④[Cl-]=0 mol·L-1,⑤[Ag+]=0.05 mol·L-1;
Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的排列顺序为④>①>③>②>⑤。二 溶度积常数1.在一定温度下,沉淀达溶解平衡后的溶液为_____溶液,其离子浓度_____________,溶液中各离子浓度幂之积为常数,叫做___________(简称_______),用____表示。
2.写出下列沉淀溶解平衡的溶度积常数的表达式
(1)AgCl(s)??Ag+(aq)+Cl-(aq)
Ksp=__________;
(2)Fe(OH)3(s)??Fe3+(aq)+3OH-(aq)
Ksp=____________;
(3)AmBn(s)??mAn+(aq)+nBm-(aq)
Ksp=____________。新知导学[Ag+][Cl-]不再发生变化溶度积常数溶度积Ksp饱和[Fe3+][OH-]3[An+]m[Bm-]n3.溶度积(Ksp)反映了难溶电解质在水中的溶解能力。当化学式所表示的组成中,阴、阳离子个数比相同时,Ksp的数值越大,难溶电解质在水中的溶解能力_____。
常见难溶电解质的溶度积与溶解度(25 ℃)越强由表可知AgCl、AgBr、AgI的溶解度大小顺序为_______________。
BaSO4和CaCO3的溶解度相对大小为_____________。
4.通过比较溶度积与溶液中有关离子浓度幂的乘积——浓度商Q的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Q>Ksp,溶液过饱和,有_____析出,直至溶液_____,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于_________。
(3)Q
(1)相同类型的物质,溶度积越小,其溶解度越小。
(2)不同类型的电解质,溶度积小的电解质的溶解度不一定比溶度积大的溶解度小。
2.溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关,与浓度无关。 3.在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中活学活用 答案 解析在BaSO4饱和溶液中加入少量的BaCl2溶液,平衡BaSO4(s)??Ba2+(aq)+
(aq)左移,则此时[Ba2+]>[ ];
由于温度未发生改变,所以溶液中Ksp=[Ba2+][ ]不变。 4.已知Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(AgBr)=5.0×10-13 mol2·L-2,Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3。某溶液中含有Cl-、Br-和CrO ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 答案 解析要产生AgCl沉淀,c(Ag+)> mol·L-1=1.8×10-8 mol·L-1;
要产生AgBr沉淀,c(Ag+)> mol·L-1=5.0×10-11 mol·L-1;
要产生Ag2CrO4,需c2(Ag+)c(CrO )>Ksp(Ag2CrO4)=9.0×10-12,
即c(Ag+)> mol·L-1=3.0×10-5 mol·L-1;
显然产生沉淀的先后顺序为Br-、Cl-、 。达标检测 提升技能1.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是
A.AgCl沉淀的生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度不变
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 答案 解析√1234AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;
升高温度,AgCl溶解度增大,C错;
向平衡体系中加入NaCl固体,增大了Cl-浓度,溶解平衡左移,AgCl溶解度减小,D错。52.把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)??Ca2+(aq)+2OH-(aq),下列叙述正确的是
A.给溶液加热,溶液的pH升高
B.恒温下向溶液中加入CaO,溶液的pH升高
C.向溶液中加入Na2CO3溶液,Ca(OH)2固体增多
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体增多 答案 解析√1234512345A项,加热时Ca(OH)2溶解度减小,平衡逆向移动,OH-浓度减小,pH
减小;
B项,CaO+H2O===Ca(OH)2,由于保持恒温,Ca(OH)2溶解度不变,OH-浓度不变,因此pH不变;
C项, +Ca2+===CaCO3↓,使平衡正向移动,Ca(OH)2固体减少;
D项,加入NaOH固体时,OH-浓度增大,平衡逆向移动,因此Ca(OH)2固体增多。3.下列说法中正确的是
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定
先生成沉淀
C.难溶盐电解质的Ksp与温度有关
D.同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 答案√12345 解析Ksp只与难溶电解质的性质和温度有关。4.下列说法正确的是
A.在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的溶度积是一个常数
B.已知AgCl的Ksp=1.8×10-10 mol2·L-2,则在任何含AgCl固体的溶液中,
[Ag+]=[Cl-],且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2
C.Ksp数值越大的难溶电解质在水中的溶解能力越强
D.难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响 解析1234 答案√512345由溶度积常数定义可知,一定温度下Ksp=[Ag+][Cl-]为一常数,A项
正确;
若在含AgCl固体的溶液中溶有NaCl,则[Ag+]<[Cl-],但Ag+与
Cl-浓度的乘积仍等于1.8×10-10 mol2·L-2,B项错误;
当化学式所表示的组成中阴、阳离子个数比相同时,Ksp越大的难溶电解质在水中的溶解能力越强,C项错误;
难溶电解质的溶解度仍然受外界条件的影响,D项错误。5.(1)将AgCl分别投入下列溶液中:
①40 mL 0.03 mol·L-1的HCl溶液
②50 mL 0.03 mol·L-1的AgNO3溶液
③30 mL 0.02 mol·L-1的CaCl2溶液
④10 mL蒸馏水
AgCl的溶解度由大到小的顺序是______________。 答案 解析12345④>①=②>③在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)AgCl(s)??AgCl(aq)===Ag+(aq)+Cl-(aq)(注:s表示未溶解的固体,aq表示已被溶解但未电离的AgCl),当溶液中存在Ag+或者Cl-时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+或Cl-的浓度越大,逆向移动的程度越大,溶解度就越小。
以中性的水为参照,溶解度由大到小的顺序为④>①=②>③。12345(2)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,[Cu2+]=__________mol·L-1
{Ksp[Cu(OH)2]=2.2×10-20mol3·L-3}。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是____mol·L-1。 答案 解析123452.2×10-80.2pH=8时,[OH-]=10-6 mol·L-1,由硫酸铜的沉淀溶解平衡常数可知:Ksp=2.2×10-20 mol3·L-3=10-12 mol2·L-2×[Cu2+],得[Cu2+]=2.2×10-8 mol·L-1;
使Cu2+沉淀完全,已知[Cu2+]=0.1 mol·L-1,根据反应关系式:Cu2+~2H+得[H+]=0.2 mol·L-1。12345本课结束
