2017-2018学年鲁科版选修4课件: 第三章 第一节 水溶液(第1课时) 课件(27张)
文档属性
| 名称 | 2017-2018学年鲁科版选修4课件: 第三章 第一节 水溶液(第1课时) 课件(27张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-12-30 00:00:00 | ||
图片预览






文档简介
课件27张PPT。第1节 水溶液
第1课时一、水的电离1、电离方程式: H2O H ++OH- 【思考】请依据化学平衡常数表达式写出 水的电离平衡常数K的表达式在一定温度下, K电离· [H2O]是常数,
则[H+][OH-]也为常数: KW= [H+][OH-]2、水的离子积 KW= [H+][OH-]25℃时,Kw=1×10-14mol2·L-2【探讨】
在水的电离平衡中,哪些因素能影响Kw?【实验探究】
利用数字实验系统,通过pH传感器,测定不同
温度下水的pH 向左移不变向左移不变【结论】(1)加热促进水的电离-----温度
(2)加入酸或碱都抑制水的电离------浓度减少减少加NaOH加热水的电离平衡
移动方向水的电离
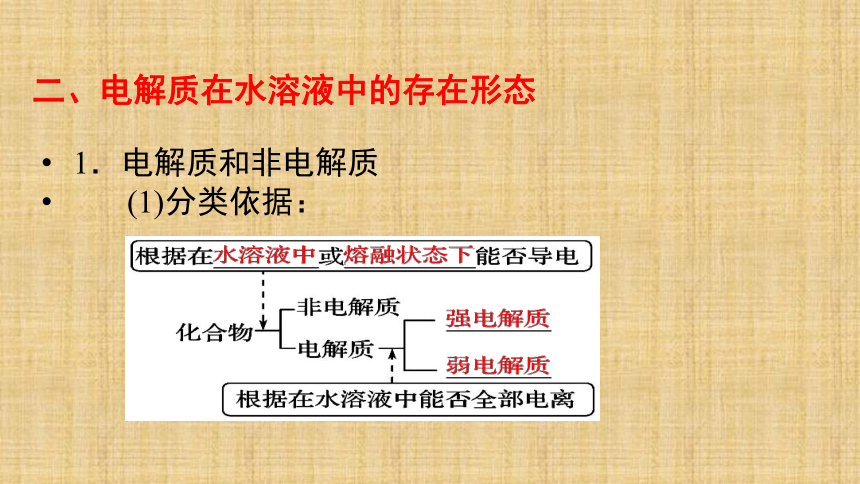
程度加盐酸向右移增大增大【讨论】除了温度之外,哪些因素还能够影响水的电离平衡?3. Kw的影响因素1.电解质和非电解质
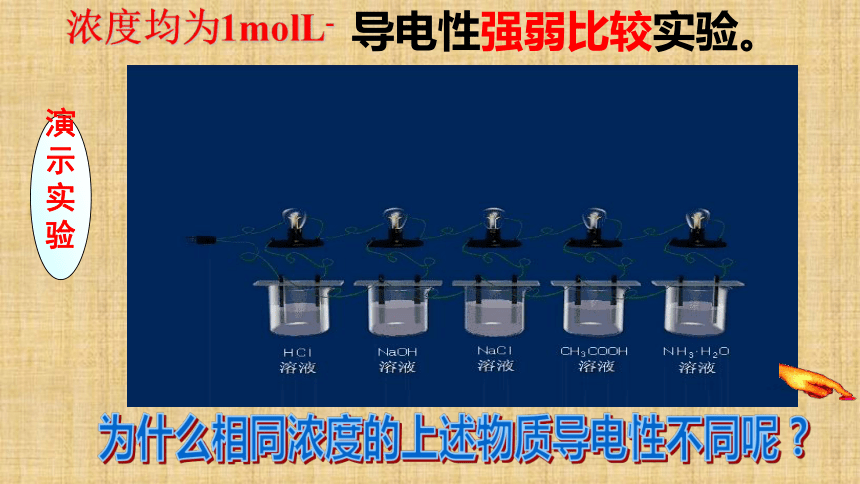
(1)分类依据: 二、电解质在水溶液中的存在形态为什么相同浓度的上述物质导电性不同呢 ? 导电性强弱比较实验。演
示
实
验
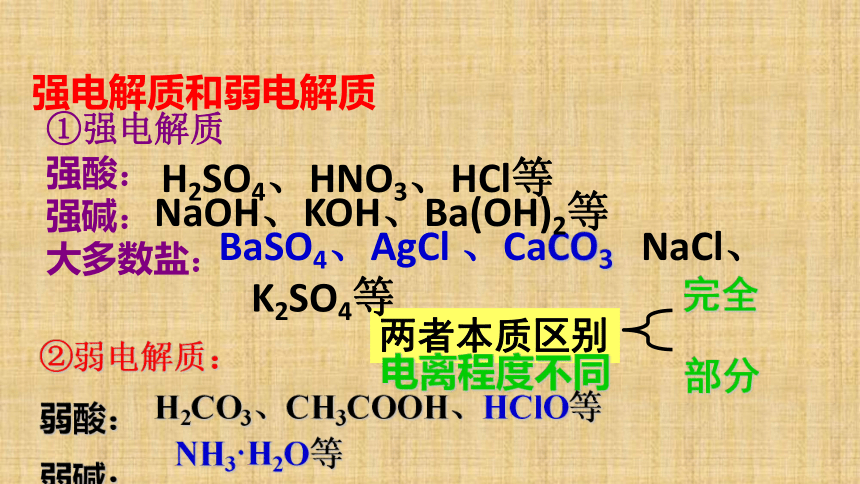
浓度均为1molL- (2)电解质的强弱与物质类别的关系: 强酸 强碱 弱酸 弱碱 水 ①强电解质
强酸:
强碱:
大多数盐:
②弱电解质:
弱酸:
弱碱:强电解质和弱电解质H2SO4、HNO3、HCl等BaSO4、AgCl 、CaCO3 NaCl、K2SO4等NaOH、KOH、Ba(OH)2等电离程度不同完全部分H2CO3、CH3COOH、HClO等NH3·H2O等:强弱电解质比较水溶液全部电离水溶液部分电离完全电离只有部分电离阴、阳离子阴阳离子、未电离的分子强酸、强碱、大部分盐
活泼金属氧化物弱酸、弱碱、水NaCl HCl NaOH醋酸 氨水 水 化合物弱电解质概括·整合[实例]
有下列物质:①硫酸 ②食盐水 ③氯气 ④碳酸钙
⑤酒精 ⑥Al(OH)3 ⑦醋酸 ⑧铜 ⑨Na2O ⑩氨气 ?CO2 ?NaHCO3 ?CH3COONH4 ?H2O2
其中属于电解质的是__________________,属于非电解质的是__________,属于强电解质的是_____________ ,属于弱电解质的是__________。①④⑥⑦⑨??? ⑤⑩? ①④⑨?? ⑥⑦? 2.电解质的电离3.电离方程式的书写
(1)强电解质的电离方程式中,用“______”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“_______”连接。
如Na2SO4:_________________________,
HClO:________________________。
(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如:H2CO3:_________________________,
_________________________;
Fe(OH)3:_________________________。=== (3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。
如NaHSO4水溶液中:_________________________;
NaHCO3水溶液中:_________________________、
______________________________。①单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液。
②电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如铁、铝等金属单质。
③本身电离而导电的化合物才是电解质,如CO2、SO2、NH3的水溶液能导电,但它们属于非电解质。
④电解质的强弱与电解质溶液导电能力的强弱、溶解性大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质。
⑤溶于水或加热熔融破坏的化学键不一样,溶于水破坏离子键和共价键,而加热熔融只破坏离子键。【易错警示】 为了保证人体生理活动的正常进行,需要维持体内的电解质平衡,存在于细胞液和体液中的Na+、K+、Cl-等对这种平衡发挥着重要作用。剧烈运动或天气炎热会引起大量出汗,出现电解质浓度失衡、紊乱,使神经和肌肉的应激受到影响,就会产生恶心、呕吐和肌肉痉挛等症状,因此,在高温环境中工作或从事剧烈运动的人们,要及时补充水分和盐分,以维持体内的水、电解质平衡"电解质与生命”关注生活同步练习答案????A 可燃冰的主要成分是甲烷的水合物,B项错误;氢氧两种元素除组成H2O以外,还能组成H2O2,C项错误;0 ℃时冰的密度比液态水的小,D项错误。A2.下列说法正确的是?( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.电解质溶液的导电过程实质上是电解过程,发生化学变化
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.Cl2、SO2的水溶液能导电,是电解质答案????B 溶液的导电能力与溶液中离子浓度大小有关,与电解质强弱无关,故A错误;电解质强弱与化合物类型无关,共价化合物也可能是强电解质,如HCl等,故C错误;Cl2既不是电解质也不是非电解质,SO2是非电解质,故D错误。B3.下列实验与对应的图像相符的是?( )
?
A.向一定量的CH3COOH溶液中通入NH3至过量
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.C表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B饱和溶液升温至t2℃时,溶质的 质量分数B=A
D.D表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液 的pH大于NaB溶液C答案????C A项,醋酸是弱酸,通入氨气生成醋酸铵,溶液导电能力增大,故A错误;B项,向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,先发生酸碱中和反应,之后铝盐与碱反应生成氢氧化铝,接着氢氧化铝与氢氧化钠反应生成偏铝酸钠,消耗氢氧化钠的物质的量之比是1∶3∶1, 与图像不符,故B错误;C项,t1 ℃时A、B饱和溶液中溶质质量分数相等,升温溶解度都增大,故升温至t2 ℃时,溶质的质量分数不变,故C正确;D项,HB的酸性比HA弱,则同浓度的NaA溶液的pH小于NaB溶液,故D错误。4.有关下列图像的分析正确的是?( )
A.图①表示在N2(g)+3H2(g)? 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
B.图②中a、b曲线一定表示反应H2(g)+I2(g)? 2HI(g)在有催化剂和无催化剂存在下建立平衡
的过程
C.图③说明酸性:HB比HA弱
D.图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况C答案????C 达平衡后,减小NH3浓度的瞬间,v逆减小,v正不变,A不正确;对于反应前后气体体积不变 的反应,增大压强,平衡不移动,图②中曲线可表示不同压强时建立平衡的过程,B不正确;pH相同 的两种酸,同等倍数稀释后,pH改变大的酸性更强,C正确;冰醋酸加水稀释过程中溶液导电能力 先增大后减小,D不正确。思路分析 冰醋酸不导电,加水后CH3COOH发生电离,产生自由移动的离子,导电能力增强;再加 水稀释,溶液体积变大,自由移动离子的浓度减小,导电能力减弱。C再见!
则[H+][OH-]也为常数: KW= [H+][OH-]2、水的离子积 KW= [H+][OH-]25℃时,Kw=1×10-14mol2·L-2【探讨】
在水的电离平衡中,哪些因素能影响Kw?【实验探究】
利用数字实验系统,通过pH传感器,测定不同
温度下水的pH 向左移不变向左移不变【结论】(1)加热促进水的电离-----温度
(2)加入酸或碱都抑制水的电离------浓度减少减少加NaOH加热水的电离平衡
移动方向水的电离
程度加盐酸向右移增大增大【讨论】除了温度之外,哪些因素还能够影响水的电离平衡?3. Kw的影响因素1.电解质和非电解质
(1)分类依据: 二、电解质在水溶液中的存在形态为什么相同浓度的上述物质导电性不同呢 ? 导电性强弱比较实验。演
示
实
验
浓度均为1molL- (2)电解质的强弱与物质类别的关系: 强酸 强碱 弱酸 弱碱 水 ①强电解质
强酸:
强碱:
大多数盐:
②弱电解质:
弱酸:
弱碱:强电解质和弱电解质H2SO4、HNO3、HCl等BaSO4、AgCl 、CaCO3 NaCl、K2SO4等NaOH、KOH、Ba(OH)2等电离程度不同完全部分H2CO3、CH3COOH、HClO等NH3·H2O等:强弱电解质比较水溶液全部电离水溶液部分电离完全电离只有部分电离阴、阳离子阴阳离子、未电离的分子强酸、强碱、大部分盐
活泼金属氧化物弱酸、弱碱、水NaCl HCl NaOH醋酸 氨水 水 化合物弱电解质概括·整合[实例]
有下列物质:①硫酸 ②食盐水 ③氯气 ④碳酸钙
⑤酒精 ⑥Al(OH)3 ⑦醋酸 ⑧铜 ⑨Na2O ⑩氨气 ?CO2 ?NaHCO3 ?CH3COONH4 ?H2O2
其中属于电解质的是__________________,属于非电解质的是__________,属于强电解质的是_____________ ,属于弱电解质的是__________。①④⑥⑦⑨??? ⑤⑩? ①④⑨?? ⑥⑦? 2.电解质的电离3.电离方程式的书写
(1)强电解质的电离方程式中,用“______”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“_______”连接。
如Na2SO4:_________________________,
HClO:________________________。
(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如:H2CO3:_________________________,
_________________________;
Fe(OH)3:_________________________。=== (3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。
如NaHSO4水溶液中:_________________________;
NaHCO3水溶液中:_________________________、
______________________________。①单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液。
②电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如铁、铝等金属单质。
③本身电离而导电的化合物才是电解质,如CO2、SO2、NH3的水溶液能导电,但它们属于非电解质。
④电解质的强弱与电解质溶液导电能力的强弱、溶解性大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质。
⑤溶于水或加热熔融破坏的化学键不一样,溶于水破坏离子键和共价键,而加热熔融只破坏离子键。【易错警示】 为了保证人体生理活动的正常进行,需要维持体内的电解质平衡,存在于细胞液和体液中的Na+、K+、Cl-等对这种平衡发挥着重要作用。剧烈运动或天气炎热会引起大量出汗,出现电解质浓度失衡、紊乱,使神经和肌肉的应激受到影响,就会产生恶心、呕吐和肌肉痉挛等症状,因此,在高温环境中工作或从事剧烈运动的人们,要及时补充水分和盐分,以维持体内的水、电解质平衡"电解质与生命”关注生活同步练习答案????A 可燃冰的主要成分是甲烷的水合物,B项错误;氢氧两种元素除组成H2O以外,还能组成H2O2,C项错误;0 ℃时冰的密度比液态水的小,D项错误。A2.下列说法正确的是?( )
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.电解质溶液的导电过程实质上是电解过程,发生化学变化
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.Cl2、SO2的水溶液能导电,是电解质答案????B 溶液的导电能力与溶液中离子浓度大小有关,与电解质强弱无关,故A错误;电解质强弱与化合物类型无关,共价化合物也可能是强电解质,如HCl等,故C错误;Cl2既不是电解质也不是非电解质,SO2是非电解质,故D错误。B3.下列实验与对应的图像相符的是?( )
?
A.向一定量的CH3COOH溶液中通入NH3至过量
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.C表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B饱和溶液升温至t2℃时,溶质的 质量分数B=A
D.D表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液 的pH大于NaB溶液C答案????C A项,醋酸是弱酸,通入氨气生成醋酸铵,溶液导电能力增大,故A错误;B项,向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,先发生酸碱中和反应,之后铝盐与碱反应生成氢氧化铝,接着氢氧化铝与氢氧化钠反应生成偏铝酸钠,消耗氢氧化钠的物质的量之比是1∶3∶1, 与图像不符,故B错误;C项,t1 ℃时A、B饱和溶液中溶质质量分数相等,升温溶解度都增大,故升温至t2 ℃时,溶质的质量分数不变,故C正确;D项,HB的酸性比HA弱,则同浓度的NaA溶液的pH小于NaB溶液,故D错误。4.有关下列图像的分析正确的是?( )
A.图①表示在N2(g)+3H2(g)? 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
B.图②中a、b曲线一定表示反应H2(g)+I2(g)? 2HI(g)在有催化剂和无催化剂存在下建立平衡
的过程
C.图③说明酸性:HB比HA弱
D.图④中的y表示将冰醋酸加水稀释时溶液导电能力的变化情况C答案????C 达平衡后,减小NH3浓度的瞬间,v逆减小,v正不变,A不正确;对于反应前后气体体积不变 的反应,增大压强,平衡不移动,图②中曲线可表示不同压强时建立平衡的过程,B不正确;pH相同 的两种酸,同等倍数稀释后,pH改变大的酸性更强,C正确;冰醋酸加水稀释过程中溶液导电能力 先增大后减小,D不正确。思路分析 冰醋酸不导电,加水后CH3COOH发生电离,产生自由移动的离子,导电能力增强;再加 水稀释,溶液体积变大,自由移动离子的浓度减小,导电能力减弱。C再见!
