化学方程式[上学期]
图片预览







文档简介
(共57张PPT)
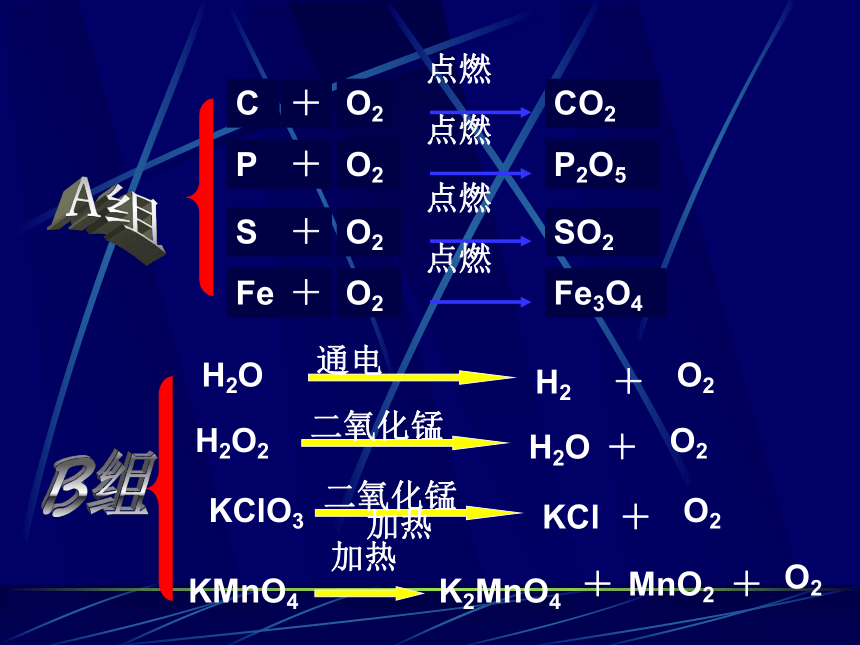
KMnO4
K2MnO4
+
MnO2
+
O2
加热
H2O
H2O2
+
O2
二氧化锰
KCl
KClO3
+
O2
二氧化锰
加热
H2
H2O
+
O2
通电
C
+
O2
点燃
CO2
P
+
O2
点燃
P2O5
S
+
O2
点燃
SO2
Fe
+
O2
点燃
Fe3O4
想一想
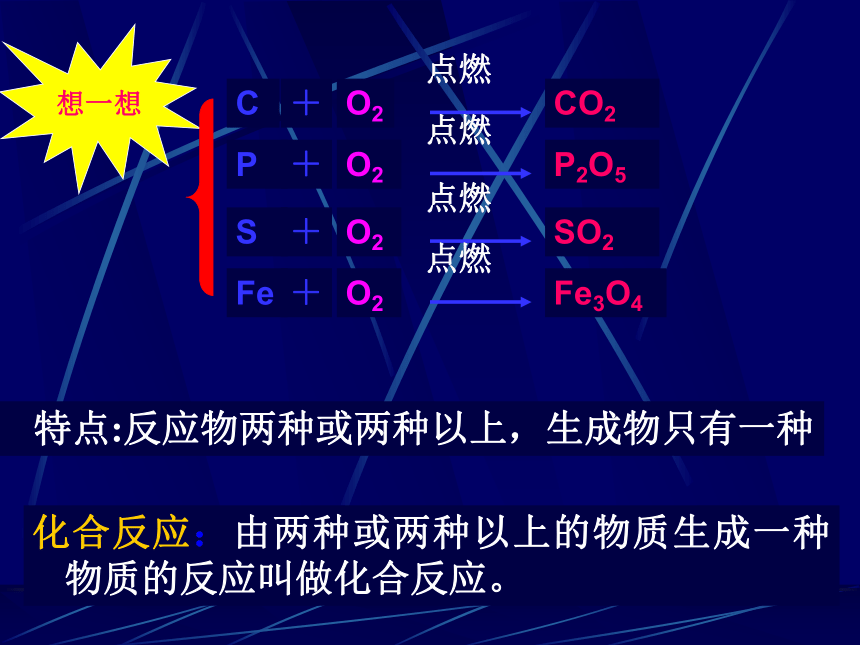
特点:反应物两种或两种以上,生成物只有一种
化合反应:由两种或两种以上的物质生成一种物质的反应叫做化合反应。
C
+
O2
点燃
CO2
P
+
O2
点燃
P2O5
S
+
O2
点燃
SO2
Fe
+
O2
点燃
Fe3O4
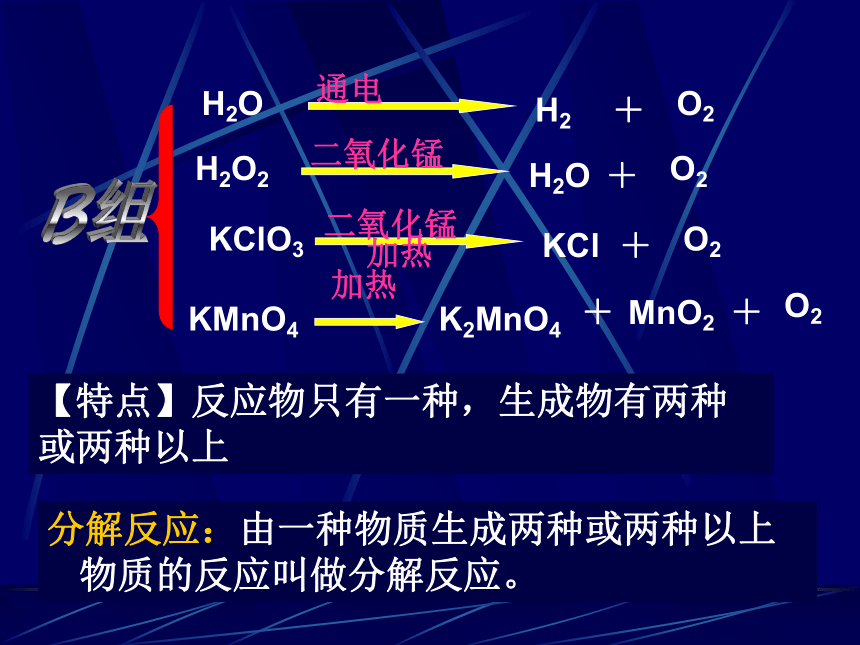
【特点】反应物只有一种,生成物有两种或两种以上
分解反应:由一种物质生成两种或两种以上物质的反应叫做分解反应。
KMnO4
K2MnO4
+
MnO2
+
O2
加热
H2O
H2O2
+
O2
二氧化锰
KCl
KClO3
+
O2
二氧化锰
加热
H2
H2O
+
O2
通电
【讨论】把学过的化学反应写出来,
分析哪些是分解反应,哪些是化合反应,哪些不是?看谁写得最多最完整?
请判断下列变化分别是哪种变化
钢铁生锈 灯泡发光 蜡烛燃烧 火药爆炸 泥沙沉淀 石灰水变浑浊 白糖溶解于水中
【设问】溶液质量=溶剂质量+溶质质量,
那么化学反应中,反应前后物质的质量总和是否相等呢
实验1、白磷燃烧前后质量的测定,
实验
实验现象:白磷燃烧,生成大量的白烟,前后质量没有变化--天平保持平衡。
白磷燃烧前后质量的测定:
(1)在锥形瓶中放一小块白磷
(2)称量锥形瓶内物质的总质量
(3)点燃白磷,观察产生的现象为:
产生大量白烟,放热
(4)冷却后称量锥形瓶内物质的总质量
五氧化二磷
氧气
磷
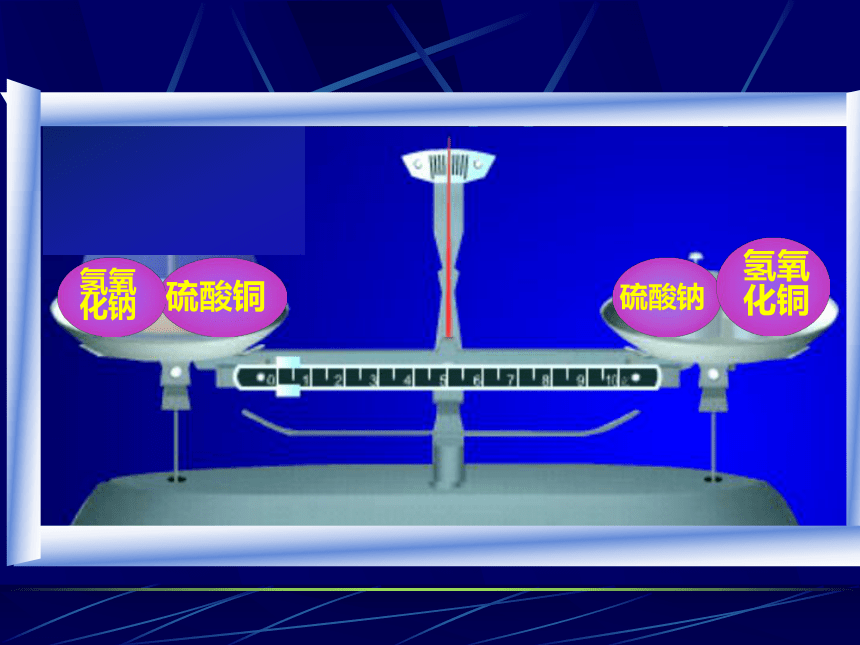
实验现象:两种溶液混合,反应生成蓝色氢氧化铜沉淀。前后质量不变--天平保持平衡。
实验2、氢氧化钠与硫酸铜反应前后
质量的测定,
(1)在烧杯中放入蓝色硫酸铜溶液,
小试管中放入氢氧化钠溶液。
(2)称量烧杯内物质的总质量。
(3)倾斜烧杯,使二者反应。观察。
产生的现象为:产生蓝色沉淀
(4)称量烧杯内物质的总质量。
实验
硫酸铜
硫酸钠
氢氧
化铜
化钠
氢氧
1、参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
质量守恒定律
说明:
说明:
1.必须是真正参加反应的物质
2.各物质的质量总和相等
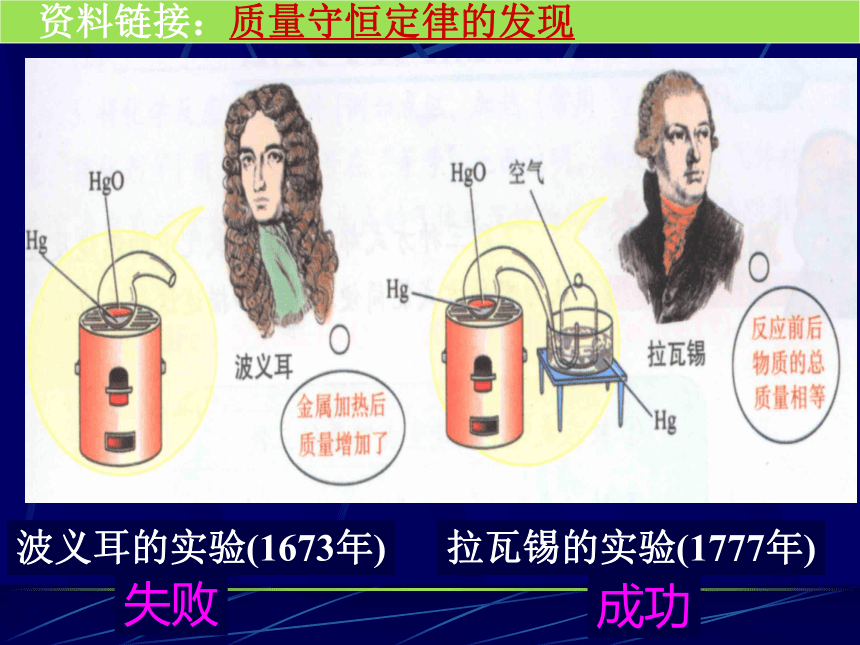
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
失败
成功
想一想
想一想
为什么化学反应前后的各物质的质量总和相等呢?
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
原子数目
原子质量
原子种类
微观
物质的总质量
元素质量
元素种类
六不变
物质的种类
分子的种类
改变
宏观
质量守恒定律的使用范围是什么?学了该定律,对我们有什么用?
质量守恒定律适用于一切化学反应
可运用定律 1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实
原子数目没有增减
原子种类没有改变
原子质量没有变化
推测一些物质的组成
进行有关的计算
解释一些实验事实
内容
内容
原因
原因
应用
应用
质量守恒定律
质量守恒定律
小结
小结
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
无数实验证明:______________的
各物质的________,等于反应后生成的
各物质的_________,这个规律叫做
质量守恒定律。这是因为化学反应前后,
_______ 没有改变, 没有增减,
______ 没有变化,只有反应中的____
重新组合成其它物质。
参加化学反应
巩固练习:
质量总和
质量总和
原子种类
原子数目
原子质量
原子
1、高锰酸钾受热分解后,剩余固体比原反应物轻,这不符合质量守恒定律 。 ( )
练习:
×
2、蜡烛燃烧后剩余固体质量减小,这不符合质量守恒定律 。 ( )
×
3.某化合物通电完全分解后生成氢气(H2)和氧气(O2),试推断该化合物的组成元素中一定有______元素。
氢、氧
用质量守恒定律解释下面两种现象:
1、镁带在空气中燃烧后,生成物的质量比镁带的质量增加了,为什么?
2、煤燃烧后留下的煤灰的质量,比煤的质量减少了,为什么?
练习:
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
2. 6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。
16
3、10克铁在氧气中燃烧后生成固体的质量——10克
1、加热10克氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52克,则生成氧气的质量为_______
2、在化学反应3A+B=2C中,5克A与足量的B反应生成6克C,则参加反应的B的质量是____
A、6克 B、5克 C、3克 D、1克
3、某一物质在空气中燃烧后,生成H2O和CO2,因此该物质一定含有( )
A.氧气 氢气 碳
B.氢气 碳
C.氧元素 氢元素 碳元素
D.氢元素 碳元素
4、已知一反应:2A2+3B2→2C,A、B为两种元素符号,则C的化学式为 _____
A、AB B、A2B3
C、A4B6 D、A3B2
硫在氧气中燃烧
参加反应的硫和氧气的质量总和等于生成的SO2质量
◇上述反应的文字表达式怎样?
S + O2 SO2
点燃
硫
氧气
二氧化硫
点燃
+
化学方程式
一、化学方程式
用元素符号和分子式来表示化学反应的式子叫化学方程式.
2、书写原则
1、定义
◇以客观事实为依据,反应是真实存在的
◇符合质量守恒定律
2、书写原则
3、书写步骤
写
配
注
等
写出反应物和生成物的分子式
配平化学方程式
注明反应条件,生成物的状态
将短线改为等号
◇
◇
◇
◇
左 (短线连接) 右 反应物分子式 生成物分子式
H2O
H2
+
O2
水 氢气 + 氧气
水分解的化学反应方程式
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
?
?
?
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
通电
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
通电
左 (短线连接) 右 反应物分子式 生成物分子式
写
配平依据
配平过程
质量守恒定律
分子式前面配上适当的化学计量数使左右两边的每一种元素的原子总数相等
最小公倍数法、观察法、奇偶法等
配平方法
配
注明反应条件,生成物状态
注
条件符号
加热△
状态符号
气体
沉淀
等
将短线改为等号
例题
写出下列反应的化学方程式
1、碳在氧气中燃烧
2、磷在氧气中燃烧
3、在硫酸铜(CuSO4 )溶液中加入氢氧化钠(NaOH)溶液
1、碳在氧气中燃烧
C
+
O2
CO2
点燃
2、磷在氧气中燃烧
磷+氧气 五氧化二磷
点燃
P
+
O2
P2O5
4
5
2
点燃
3、在硫酸铜(CuSO4 )溶液中加入氢氧化钠(NaOH)溶液
CuSO4
+
NaOH
Cu(OH)2
+
Na2SO4
2
课堂练习
1、铁+氧气 四氧化三铁
2、甲烷+氧气 水+二氧化碳
3、高锰酸钾(KMnO4) 锰酸钾(K2MnO4)+二氧化锰+氧气
点燃
点燃
加热
3Fe+O2 Fe3O4
点燃
CH4+2O2 CO2+2H2O
点燃
2KMnO4 K2MnO4+MnO2+O2
△
二、化学方程式的涵义
1、表示什么物质参加反应,结果生成什么物质。
2、表示各反应物、生成物之间的原子、分子个数之比。
3、表示反应物、生成物各物质之间的质量比
化学方程式的涵义
4P + 5O2 2P2O5
124 160 284
点燃
1、表示磷和氧气参加反应,结果生成五氧化二磷。
2、表示反应物中磷原子、氧分子和生成物中五氧化二磷分子的个数比为4∶5∶2。
3、表示124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。质量比为31∶40∶71
课堂练习2
1、根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe+2O2 Fe3O4
(2)Mg+O2 MgO2
(3)CH4+O2 CO2+H2O
加热
点燃
点燃
全错
点燃
点燃
点燃
高温
高温
课堂练习2
4 3 2
2 2
2 5 2 4
2 2 2
2、配平下列化学方程式
(1) C + CO2 CO
(2) Al + O2 Al2O3
(3) CuO + C Cu + CO2
(4) C2H2 + O2 H2O + CO2
(5) H2S + O2 S + H2O
课堂小结
化学方程式的书写可归纳为:(以反应“ 氯酸钾 氯化钾+氧气”的化学方程式书写为例)
加热
左反右生一横线
配平以后加一线
等号上下注条件
箭号标气或沉淀
KClO3 KCl+ O2
2KClO3 2KCl+ 3O2
2KClO3 2 KCl+ 3 O2
2 KClO3 2KCl+ 3 O2
MnO2
MnO2
△
△
实验室里用分解过氧化氢的方法制取氧气时,各物质之间的质量关系如何?
H2O2
H2O + O2
2
2
MnO2
相对分子质量
(1×2+16×2)×2
(1×2+16) ×2
16×2
68
36
32
各物质质量比
68 : 36 : 32
17 : 9 : 8
各物质的质量
68克 = 36克 + 32克
34克
8克
72克
18克
16克
17克
136克
H2O2
H2O + O2
2
2
MnO2
68 32
2g
=4.25g
四、根据化学方程式的计算
例题:实验室里用分解过氧化氢的方法制取氧气,
现要制得2克氧气,需要多少克过氧化氢?
x
=
x
解:设需要过氧化氢质量为x
答:需要过氧化氢4.25g.
1.设未知量 解:设需要过氧化氢的质量为m
2.写出化学方程式
2H2O2=====2H2O+O2↑
3.写出有关物质的相对分子质量 68 32
4.写出已知量和未知量 m 2克
5.列出量方程、求解 68/m=32/2克 m=68×2克/32=4.25克
6.写出简明答案 答:需要过氧化氢4.25克。
MnO2
4.将24.5克氯酸钾与2克二氧化锰混合加热,直到不再产生气体为止,冷却后,称得剩余固体质量为16.9克,则剩余固体中含_____和________,质量分别为_____克和_____克;生成的氧气质量为_____克。
3.在化学反应A+B=C中,已知3克A与足量的B反应,共生成11克C,问参加反应的B为_____克
KCl
MnO2
14.9
2
9.6
8
练习:试写出下列反应的化学方程式
(1)硫在氧气中燃烧生成二氧化硫
(2)磷在氧气中燃烧生成五氧化二磷
(3)氢气与灼热的氧化铜反应生成铜和水
下列化学方程式是否正确 为什么
(1)C2H2+O2===CO2+H2O
(2) KMnO4====K2MnO4+MnO2+O2
Zn+CuSO4===Cu +ZnSO4
C+O2====CO2
点燃
点燃
例2: 在实验室中用氢气还原氧化铜制取
铜。若制取10克铜,需要氧化铜多少克?
解:设需要氧化铜的质量为X
CuO + H2 == Cu + H2O
63.5+16
63.5
X
10克
63.5+16
X
=
63.5
10克
X = 12.5克
答:需要氧化铜12.5克。
△
由干燥的氯酸钾和二氧化锰组成的混合物的质量为9.9g。把该固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为7.2g。
(1)求原混合物中氯酸钾的质量。
(2)反应后试管中固体物质是什么?它们的质量各是多少?
解:根据质量守恒定律,生成氧气为9.9g-7.2g=2.7g
设原混合物中含氯酸钾质量为x
2KClO3 ==== 2KCl + O2↑
MnO2
△
96
x 2.7g
245 : 96 = x : 2.7g
X=6.9g
则MnO2的质量为9.9g - 6.9g = 3g
剩余固体中KCl的质量为7.2g - 3g = 4.2g
答:略
KMnO4
K2MnO4
+
MnO2
+
O2
加热
H2O
H2O2
+
O2
二氧化锰
KCl
KClO3
+
O2
二氧化锰
加热
H2
H2O
+
O2
通电
C
+
O2
点燃
CO2
P
+
O2
点燃
P2O5
S
+
O2
点燃
SO2
Fe
+
O2
点燃
Fe3O4
想一想
特点:反应物两种或两种以上,生成物只有一种
化合反应:由两种或两种以上的物质生成一种物质的反应叫做化合反应。
C
+
O2
点燃
CO2
P
+
O2
点燃
P2O5
S
+
O2
点燃
SO2
Fe
+
O2
点燃
Fe3O4
【特点】反应物只有一种,生成物有两种或两种以上
分解反应:由一种物质生成两种或两种以上物质的反应叫做分解反应。
KMnO4
K2MnO4
+
MnO2
+
O2
加热
H2O
H2O2
+
O2
二氧化锰
KCl
KClO3
+
O2
二氧化锰
加热
H2
H2O
+
O2
通电
【讨论】把学过的化学反应写出来,
分析哪些是分解反应,哪些是化合反应,哪些不是?看谁写得最多最完整?
请判断下列变化分别是哪种变化
钢铁生锈 灯泡发光 蜡烛燃烧 火药爆炸 泥沙沉淀 石灰水变浑浊 白糖溶解于水中
【设问】溶液质量=溶剂质量+溶质质量,
那么化学反应中,反应前后物质的质量总和是否相等呢
实验1、白磷燃烧前后质量的测定,
实验
实验现象:白磷燃烧,生成大量的白烟,前后质量没有变化--天平保持平衡。
白磷燃烧前后质量的测定:
(1)在锥形瓶中放一小块白磷
(2)称量锥形瓶内物质的总质量
(3)点燃白磷,观察产生的现象为:
产生大量白烟,放热
(4)冷却后称量锥形瓶内物质的总质量
五氧化二磷
氧气
磷
实验现象:两种溶液混合,反应生成蓝色氢氧化铜沉淀。前后质量不变--天平保持平衡。
实验2、氢氧化钠与硫酸铜反应前后
质量的测定,
(1)在烧杯中放入蓝色硫酸铜溶液,
小试管中放入氢氧化钠溶液。
(2)称量烧杯内物质的总质量。
(3)倾斜烧杯,使二者反应。观察。
产生的现象为:产生蓝色沉淀
(4)称量烧杯内物质的总质量。
实验
硫酸铜
硫酸钠
氢氧
化铜
化钠
氢氧
1、参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
质量守恒定律
说明:
说明:
1.必须是真正参加反应的物质
2.各物质的质量总和相等
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
失败
成功
想一想
想一想
为什么化学反应前后的各物质的质量总和相等呢?
元素种类变了吗?
元素质量变了吗?
物质的总质量呢?
化学反应前后
物质种类呢?
分子种类呢?
不变
改变
原子数目
原子质量
原子种类
微观
物质的总质量
元素质量
元素种类
六不变
物质的种类
分子的种类
改变
宏观
质量守恒定律的使用范围是什么?学了该定律,对我们有什么用?
质量守恒定律适用于一切化学反应
可运用定律 1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实
原子数目没有增减
原子种类没有改变
原子质量没有变化
推测一些物质的组成
进行有关的计算
解释一些实验事实
内容
内容
原因
原因
应用
应用
质量守恒定律
质量守恒定律
小结
小结
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
无数实验证明:______________的
各物质的________,等于反应后生成的
各物质的_________,这个规律叫做
质量守恒定律。这是因为化学反应前后,
_______ 没有改变, 没有增减,
______ 没有变化,只有反应中的____
重新组合成其它物质。
参加化学反应
巩固练习:
质量总和
质量总和
原子种类
原子数目
原子质量
原子
1、高锰酸钾受热分解后,剩余固体比原反应物轻,这不符合质量守恒定律 。 ( )
练习:
×
2、蜡烛燃烧后剩余固体质量减小,这不符合质量守恒定律 。 ( )
×
3.某化合物通电完全分解后生成氢气(H2)和氧气(O2),试推断该化合物的组成元素中一定有______元素。
氢、氧
用质量守恒定律解释下面两种现象:
1、镁带在空气中燃烧后,生成物的质量比镁带的质量增加了,为什么?
2、煤燃烧后留下的煤灰的质量,比煤的质量减少了,为什么?
练习:
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
2. 6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有______克氧气参加了反应。
16
3、10克铁在氧气中燃烧后生成固体的质量——10克
1、加热10克氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52克,则生成氧气的质量为_______
2、在化学反应3A+B=2C中,5克A与足量的B反应生成6克C,则参加反应的B的质量是____
A、6克 B、5克 C、3克 D、1克
3、某一物质在空气中燃烧后,生成H2O和CO2,因此该物质一定含有( )
A.氧气 氢气 碳
B.氢气 碳
C.氧元素 氢元素 碳元素
D.氢元素 碳元素
4、已知一反应:2A2+3B2→2C,A、B为两种元素符号,则C的化学式为 _____
A、AB B、A2B3
C、A4B6 D、A3B2
硫在氧气中燃烧
参加反应的硫和氧气的质量总和等于生成的SO2质量
◇上述反应的文字表达式怎样?
S + O2 SO2
点燃
硫
氧气
二氧化硫
点燃
+
化学方程式
一、化学方程式
用元素符号和分子式来表示化学反应的式子叫化学方程式.
2、书写原则
1、定义
◇以客观事实为依据,反应是真实存在的
◇符合质量守恒定律
2、书写原则
3、书写步骤
写
配
注
等
写出反应物和生成物的分子式
配平化学方程式
注明反应条件,生成物的状态
将短线改为等号
◇
◇
◇
◇
左 (短线连接) 右 反应物分子式 生成物分子式
H2O
H2
+
O2
水 氢气 + 氧气
水分解的化学反应方程式
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
?
?
?
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
通电
左 (短线连接) 右 反应物分子式 生成物分子式
水 氢气 + 氧气
H2O
H2
+
O2
2
2
通电
左 (短线连接) 右 反应物分子式 生成物分子式
写
配平依据
配平过程
质量守恒定律
分子式前面配上适当的化学计量数使左右两边的每一种元素的原子总数相等
最小公倍数法、观察法、奇偶法等
配平方法
配
注明反应条件,生成物状态
注
条件符号
加热△
状态符号
气体
沉淀
等
将短线改为等号
例题
写出下列反应的化学方程式
1、碳在氧气中燃烧
2、磷在氧气中燃烧
3、在硫酸铜(CuSO4 )溶液中加入氢氧化钠(NaOH)溶液
1、碳在氧气中燃烧
C
+
O2
CO2
点燃
2、磷在氧气中燃烧
磷+氧气 五氧化二磷
点燃
P
+
O2
P2O5
4
5
2
点燃
3、在硫酸铜(CuSO4 )溶液中加入氢氧化钠(NaOH)溶液
CuSO4
+
NaOH
Cu(OH)2
+
Na2SO4
2
课堂练习
1、铁+氧气 四氧化三铁
2、甲烷+氧气 水+二氧化碳
3、高锰酸钾(KMnO4) 锰酸钾(K2MnO4)+二氧化锰+氧气
点燃
点燃
加热
3Fe+O2 Fe3O4
点燃
CH4+2O2 CO2+2H2O
点燃
2KMnO4 K2MnO4+MnO2+O2
△
二、化学方程式的涵义
1、表示什么物质参加反应,结果生成什么物质。
2、表示各反应物、生成物之间的原子、分子个数之比。
3、表示反应物、生成物各物质之间的质量比
化学方程式的涵义
4P + 5O2 2P2O5
124 160 284
点燃
1、表示磷和氧气参加反应,结果生成五氧化二磷。
2、表示反应物中磷原子、氧分子和生成物中五氧化二磷分子的个数比为4∶5∶2。
3、表示124份质量的磷与160份质量的氧气反应生成284份质量的五氧化二磷。质量比为31∶40∶71
课堂练习2
1、根据已学知识判断下列反应方程式是否正确。如有错误,请指出错误之处。
(1)3Fe+2O2 Fe3O4
(2)Mg+O2 MgO2
(3)CH4+O2 CO2+H2O
加热
点燃
点燃
全错
点燃
点燃
点燃
高温
高温
课堂练习2
4 3 2
2 2
2 5 2 4
2 2 2
2、配平下列化学方程式
(1) C + CO2 CO
(2) Al + O2 Al2O3
(3) CuO + C Cu + CO2
(4) C2H2 + O2 H2O + CO2
(5) H2S + O2 S + H2O
课堂小结
化学方程式的书写可归纳为:(以反应“ 氯酸钾 氯化钾+氧气”的化学方程式书写为例)
加热
左反右生一横线
配平以后加一线
等号上下注条件
箭号标气或沉淀
KClO3 KCl+ O2
2KClO3 2KCl+ 3O2
2KClO3 2 KCl+ 3 O2
2 KClO3 2KCl+ 3 O2
MnO2
MnO2
△
△
实验室里用分解过氧化氢的方法制取氧气时,各物质之间的质量关系如何?
H2O2
H2O + O2
2
2
MnO2
相对分子质量
(1×2+16×2)×2
(1×2+16) ×2
16×2
68
36
32
各物质质量比
68 : 36 : 32
17 : 9 : 8
各物质的质量
68克 = 36克 + 32克
34克
8克
72克
18克
16克
17克
136克
H2O2
H2O + O2
2
2
MnO2
68 32
2g
=4.25g
四、根据化学方程式的计算
例题:实验室里用分解过氧化氢的方法制取氧气,
现要制得2克氧气,需要多少克过氧化氢?
x
=
x
解:设需要过氧化氢质量为x
答:需要过氧化氢4.25g.
1.设未知量 解:设需要过氧化氢的质量为m
2.写出化学方程式
2H2O2=====2H2O+O2↑
3.写出有关物质的相对分子质量 68 32
4.写出已知量和未知量 m 2克
5.列出量方程、求解 68/m=32/2克 m=68×2克/32=4.25克
6.写出简明答案 答:需要过氧化氢4.25克。
MnO2
4.将24.5克氯酸钾与2克二氧化锰混合加热,直到不再产生气体为止,冷却后,称得剩余固体质量为16.9克,则剩余固体中含_____和________,质量分别为_____克和_____克;生成的氧气质量为_____克。
3.在化学反应A+B=C中,已知3克A与足量的B反应,共生成11克C,问参加反应的B为_____克
KCl
MnO2
14.9
2
9.6
8
练习:试写出下列反应的化学方程式
(1)硫在氧气中燃烧生成二氧化硫
(2)磷在氧气中燃烧生成五氧化二磷
(3)氢气与灼热的氧化铜反应生成铜和水
下列化学方程式是否正确 为什么
(1)C2H2+O2===CO2+H2O
(2) KMnO4====K2MnO4+MnO2+O2
Zn+CuSO4===Cu +ZnSO4
C+O2====CO2
点燃
点燃
例2: 在实验室中用氢气还原氧化铜制取
铜。若制取10克铜,需要氧化铜多少克?
解:设需要氧化铜的质量为X
CuO + H2 == Cu + H2O
63.5+16
63.5
X
10克
63.5+16
X
=
63.5
10克
X = 12.5克
答:需要氧化铜12.5克。
△
由干燥的氯酸钾和二氧化锰组成的混合物的质量为9.9g。把该固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为7.2g。
(1)求原混合物中氯酸钾的质量。
(2)反应后试管中固体物质是什么?它们的质量各是多少?
解:根据质量守恒定律,生成氧气为9.9g-7.2g=2.7g
设原混合物中含氯酸钾质量为x
2KClO3 ==== 2KCl + O2↑
MnO2
△
96
x 2.7g
245 : 96 = x : 2.7g
X=6.9g
则MnO2的质量为9.9g - 6.9g = 3g
剩余固体中KCl的质量为7.2g - 3g = 4.2g
答:略
同课章节目录
- 第一章 宇宙的起源与演化
- 1 我们的宇宙
- 2 热大爆炸宇宙模型
- 3 恒星的一生
- 4 星际航行和空间技术
- 第二章 地球的演化和生物圈的形成
- 1 地球的演化
- 2 生命起源
- 3 生物进化
- 4 生态平衡
- 第三章 物质的转化和元素的循环
- 1 物质的转化
- 2 自然界中的碳循环和氧循环
- 3 自然界中的氮循环
- 第四章 健康与保健
- 1 健康、亚健康和疾病
- 2 运动与健康
- 3 免疫与健康
- 4 营养与健康
- 5 卫生与健康
- 6 环境与健康
- 第五章 生物的遗传和变异
- 1 生物的遗传
- 2 生物的变异
- 第六章 能源与社会
- 1 能源和能源的分类
- 2 太阳能的利用
- 3 核能的开发与放射性防护
- 4 新能源与可持续发展
- 第七章 科学与社会发展
- 1 科学就是力量
- 2 科学推动技术发展
- 3 科学技术推动经济增长
- 4 科学技术与可持续发展
