1.1.3 物质的聚集状态课件 (共35张PPT)
文档属性
| 名称 | 1.1.3 物质的聚集状态课件 (共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 769.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-01 13:54:05 | ||
图片预览











文档简介
课件35张PPT。专题一 第一单元 物质的聚集状态
第一课时铁水 钢铁干冰 冰 水蒸汽固态:1、
物质
的
聚集
状态液态:气态:晶体:非晶态:有规则的几何外形固定的熔点没有规则的几何外形没有固定的熔点面粉玻璃石蜡 笔记!一、物质的聚集状态气态液态固态易压缩固定体积固定形状状态不同、性质不同的本质原因:微观结构不同生活经验:FePbH2OH2SO4不同聚集状态物质的特性7.1cm3
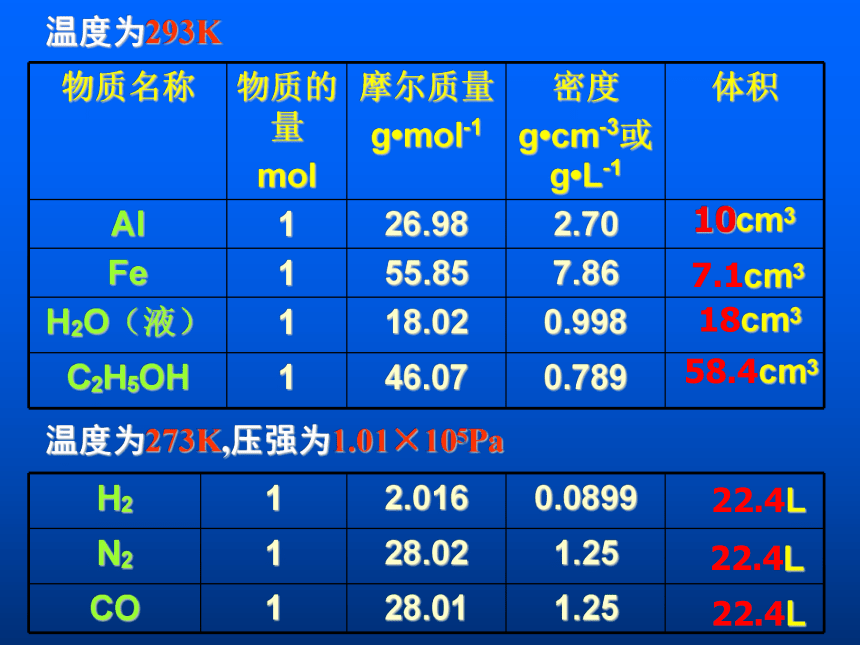
18cm358.4cm322.4L22.4L22.4L温度为293K温度为273K,压强为1.01×105Pa 10cm3二、关于体积的问题1.●1mol 不同的固态、液态物质体积不同T相同●1mol不同的气态物质,体积大约相同T、P相同做笔记的时间到了!仔细对比物质的体积微观模型,你能说出决定物质体积的因素吗?V1V4V2V32、影响物质体积大小的因素:②微粒的数目①微粒的大小③微粒之间的距离固、液气体温度压强p不变
T升高
V增大T不变
p增大
V减小1、1mol固体、液体的体积主要决定于组成它们的微粒大小。2、相同条件下,1mol气体的体积主要决定于分子间的距离。分子间距大约是分子直径的10倍科学证明:在温度和压强一定时,任何气体分子间的
平均距离是相等!叙述气体体积时一定要指明温度和压强!三、气体摩尔体积1.定义:单位物质的量的气体所占的体积。
2.符号:Vm
3.单位:L/mol 或 L·mol-1、m3/mol等
4.对象:任何气体(纯净或混合气体)5.公式:★标准状况( 温度0℃(273K)、压强 1.01×105 Pa)下 1mol任何气体体积约:22.4L笔记答案:气体的体积在气体分子个数、温度、压强一定时,决定于气体的分子间平均距离,而与分子种类无关。
[思考]为什么说气体摩尔体积也适用于混合气体?1. 标准状况下,1mol任何物质的体积都约是22.4L。(错,物质应是气体)2. 1mol气体的体积约为22.4L。(错,应标明条件-标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。(错,未指明气体体积是否在相同条件下测定)5. 标准状况下,气体的摩尔体积都是22.4L。(错,“约为”;单位应为L/mol)6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。(错,不一定)条件:标准状况
对象:任何气体
物质的量:1mol标准状况下的气体摩尔体积的要点:1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。特别提示即时应用
1.下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D气体的体积和物质的量的关系:练习:
1. 标准状况下,1mol的CO2的体积为:_____
2. 标准状况下,0.5mol的H2S的体积为:_____
3. 标准状况下,44.8L的CH4的物质的量为:____
含H的个数为: ______
4. 标准状况下,6.72L的NH3的物质的量为:_____
质量为:_______22.4L11.2L1mol2.408×10240.3mol5.1gmnN÷M×M×NA÷NA×22.4L/mol ÷22.4L/mol[小结](标准状况)v[例 1] 5. 5克氨在标准状况时体积是多少?解: 氨的式量是17,氨的摩尔质量是 17g/mol 。5. 5g17g/mol= 0. 32 mol答:5. 5氨在标准状况时的体积是7. 2LV(NH3) = Vm×n (NH3) = 22. 4L/mol ×0. 32mol = 7. 2L专题一 第一单元 物质的聚集状态
第二课时2、规律:
阿伏加德罗定律中有“四同”:
同温、同压、同体积、同微粒数。
只要有任何“三同”,就可以定出另一同。1、定义:同温同压下,相同体积的任何气体含有
相同数目的分子阿伏加德罗定律
阿伏加德罗定律:三同定一同3、在同温下,两种气体同体积又同分子数,则必然
同压。“四同”:同温、同压、同体积、同微粒数1、同温同压下,同体积的两种气体必含有相同数目
的分子。2、同温同压下,同分子数目的两种气体必同体积。理想气体状态方程pV = nRTp为压强 V为体积
n为物质的量 R为常数
T为温度阿伏加德罗定律的推论1、下列说法中正确的是:A、同温同压下,含有相同分子数的两种气体占有
相同的体积B、同温同压下,相同质量的两种气体含有相同分
子数C、同温同压下,2LO2和N2的混合气体与2LCO2和
CO的混合气体含有相同分子数D、同温同压下,相同物质的量的两种气体占有相同
的体积√√√巩固基础(阿伏加德罗定律): (1)学习“物质的量”之后,化学方程式表示的意义更为广泛,以锌和稀硫酸反应为例:
Zn + H2SO4 === ZnSO4 + H2↑
微粒数 1 1 1 1
物质的量 1 mol 1 mol 1 mol 1 mol
质量 65 g 98 g 161 g 2 g
物质的量应用于化学方程式的计算 Zn + H2SO4 === ZnSO4 + H2↑
物质的量与质量 1 mol 1 mol 1 mol 2 g
物质的量与气体
体积(标准状况) 1 mol 1 mol 1 mol 22.4 L
质量与气体体积
(标准状况) 65 g 98 g 161 g 22.4 L
1. 写出有关的化学方程式或由化学方程式找出关系式2.在方程式下面注明有关的量(注明的量应为纯净物的量),单位要上下相同,左右成比例。3. 列出比例式,计算出结果。
4. 写出答案计算步骤:2.14 g Fe与足量稀盐酸充分混合后,消耗HCl的物质的量
为多少?生成标准状况下的H2多少升?答案:0.5 mol 5.6 L单位应上下一致
左右关系对应65g22.4LV (H2)6.5gV(H2)= 2.24 L=【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求生成H2的体积(标况下)。mnN÷M×M×NA÷NA×22.4L/mol ÷22.4L/mol[小结](标准状况)v变式训练3、把6.5 g锌加入到足量的稀硫酸中充分反应,计算消耗的硫酸的物质的量及产生标准状况下的氢气体积?(要求;有规范的步骤)
解: →将已知量转化成物质的量
→写出正确的化学方程式
→定物质的物质的量关系
→列已知量、未知量
→列比例式计算未知量
→计算出未知量
→转化成需要的物理量n (Zn) = 6.5g /65g/mol = 0.1molZn + H2SO4 = ZnSO4 + H2↑1 1 10.1mol n(H2SO4) n(H2)1/0.1mol= 1/n(H2SO4)=1/n(H2)n(H2SO4)=0.1mol n(H2)=0.1molV (H2)=0.1mol× 22.4L/mol =2.24L
第一课时铁水 钢铁干冰 冰 水蒸汽固态:1、
物质
的
聚集
状态液态:气态:晶体:非晶态:有规则的几何外形固定的熔点没有规则的几何外形没有固定的熔点面粉玻璃石蜡 笔记!一、物质的聚集状态气态液态固态易压缩固定体积固定形状状态不同、性质不同的本质原因:微观结构不同生活经验:FePbH2OH2SO4不同聚集状态物质的特性7.1cm3
18cm358.4cm322.4L22.4L22.4L温度为293K温度为273K,压强为1.01×105Pa 10cm3二、关于体积的问题1.●1mol 不同的固态、液态物质体积不同T相同●1mol不同的气态物质,体积大约相同T、P相同做笔记的时间到了!仔细对比物质的体积微观模型,你能说出决定物质体积的因素吗?V1V4V2V32、影响物质体积大小的因素:②微粒的数目①微粒的大小③微粒之间的距离固、液气体温度压强p不变
T升高
V增大T不变
p增大
V减小1、1mol固体、液体的体积主要决定于组成它们的微粒大小。2、相同条件下,1mol气体的体积主要决定于分子间的距离。分子间距大约是分子直径的10倍科学证明:在温度和压强一定时,任何气体分子间的
平均距离是相等!叙述气体体积时一定要指明温度和压强!三、气体摩尔体积1.定义:单位物质的量的气体所占的体积。
2.符号:Vm
3.单位:L/mol 或 L·mol-1、m3/mol等
4.对象:任何气体(纯净或混合气体)5.公式:★标准状况( 温度0℃(273K)、压强 1.01×105 Pa)下 1mol任何气体体积约:22.4L笔记答案:气体的体积在气体分子个数、温度、压强一定时,决定于气体的分子间平均距离,而与分子种类无关。
[思考]为什么说气体摩尔体积也适用于混合气体?1. 标准状况下,1mol任何物质的体积都约是22.4L。(错,物质应是气体)2. 1mol气体的体积约为22.4L。(错,应标明条件-标准状况)3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。(对,气体体积与分子种类无关)4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。(错,未指明气体体积是否在相同条件下测定)5. 标准状况下,气体的摩尔体积都是22.4L。(错,“约为”;单位应为L/mol)6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。(错,不一定)条件:标准状况
对象:任何气体
物质的量:1mol标准状况下的气体摩尔体积的要点:1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。特别提示即时应用
1.下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D气体的体积和物质的量的关系:练习:
1. 标准状况下,1mol的CO2的体积为:_____
2. 标准状况下,0.5mol的H2S的体积为:_____
3. 标准状况下,44.8L的CH4的物质的量为:____
含H的个数为: ______
4. 标准状况下,6.72L的NH3的物质的量为:_____
质量为:_______22.4L11.2L1mol2.408×10240.3mol5.1gmnN÷M×M×NA÷NA×22.4L/mol ÷22.4L/mol[小结](标准状况)v[例 1] 5. 5克氨在标准状况时体积是多少?解: 氨的式量是17,氨的摩尔质量是 17g/mol 。5. 5g17g/mol= 0. 32 mol答:5. 5氨在标准状况时的体积是7. 2LV(NH3) = Vm×n (NH3) = 22. 4L/mol ×0. 32mol = 7. 2L专题一 第一单元 物质的聚集状态
第二课时2、规律:
阿伏加德罗定律中有“四同”:
同温、同压、同体积、同微粒数。
只要有任何“三同”,就可以定出另一同。1、定义:同温同压下,相同体积的任何气体含有
相同数目的分子阿伏加德罗定律
阿伏加德罗定律:三同定一同3、在同温下,两种气体同体积又同分子数,则必然
同压。“四同”:同温、同压、同体积、同微粒数1、同温同压下,同体积的两种气体必含有相同数目
的分子。2、同温同压下,同分子数目的两种气体必同体积。理想气体状态方程pV = nRTp为压强 V为体积
n为物质的量 R为常数
T为温度阿伏加德罗定律的推论1、下列说法中正确的是:A、同温同压下,含有相同分子数的两种气体占有
相同的体积B、同温同压下,相同质量的两种气体含有相同分
子数C、同温同压下,2LO2和N2的混合气体与2LCO2和
CO的混合气体含有相同分子数D、同温同压下,相同物质的量的两种气体占有相同
的体积√√√巩固基础(阿伏加德罗定律): (1)学习“物质的量”之后,化学方程式表示的意义更为广泛,以锌和稀硫酸反应为例:
Zn + H2SO4 === ZnSO4 + H2↑
微粒数 1 1 1 1
物质的量 1 mol 1 mol 1 mol 1 mol
质量 65 g 98 g 161 g 2 g
物质的量应用于化学方程式的计算 Zn + H2SO4 === ZnSO4 + H2↑
物质的量与质量 1 mol 1 mol 1 mol 2 g
物质的量与气体
体积(标准状况) 1 mol 1 mol 1 mol 22.4 L
质量与气体体积
(标准状况) 65 g 98 g 161 g 22.4 L
1. 写出有关的化学方程式或由化学方程式找出关系式2.在方程式下面注明有关的量(注明的量应为纯净物的量),单位要上下相同,左右成比例。3. 列出比例式,计算出结果。
4. 写出答案计算步骤:2.14 g Fe与足量稀盐酸充分混合后,消耗HCl的物质的量
为多少?生成标准状况下的H2多少升?答案:0.5 mol 5.6 L单位应上下一致
左右关系对应65g22.4LV (H2)6.5gV(H2)= 2.24 L=【例 题 】 实验室用6.5g Zn与足量盐酸完全反应。求生成H2的体积(标况下)。mnN÷M×M×NA÷NA×22.4L/mol ÷22.4L/mol[小结](标准状况)v变式训练3、把6.5 g锌加入到足量的稀硫酸中充分反应,计算消耗的硫酸的物质的量及产生标准状况下的氢气体积?(要求;有规范的步骤)
解: →将已知量转化成物质的量
→写出正确的化学方程式
→定物质的物质的量关系
→列已知量、未知量
→列比例式计算未知量
→计算出未知量
→转化成需要的物理量n (Zn) = 6.5g /65g/mol = 0.1molZn + H2SO4 = ZnSO4 + H2↑1 1 10.1mol n(H2SO4) n(H2)1/0.1mol= 1/n(H2SO4)=1/n(H2)n(H2SO4)=0.1mol n(H2)=0.1molV (H2)=0.1mol× 22.4L/mol =2.24L
