1.1.4 物质的分散系2
图片预览








文档简介
课件32张PPT。专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质
第4课时 物质的分散系泥沙混合液、油水混合液、CuSO4混合液
分散系:把一种(或多种)物质分散
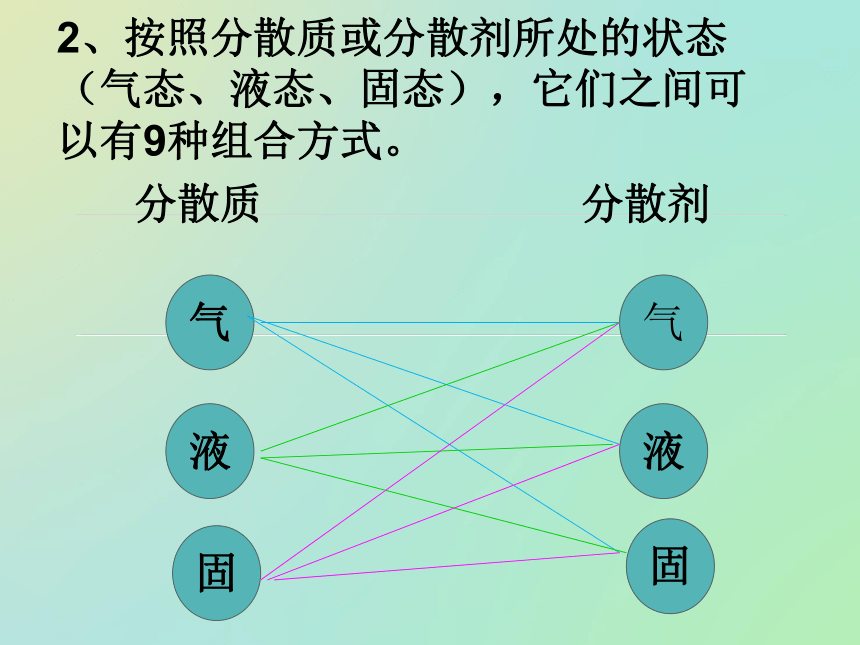
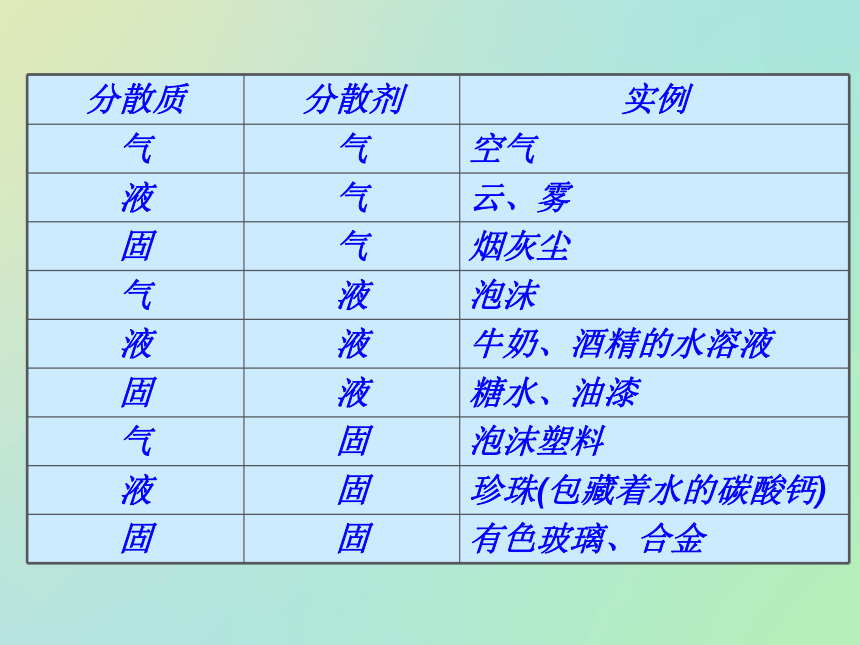
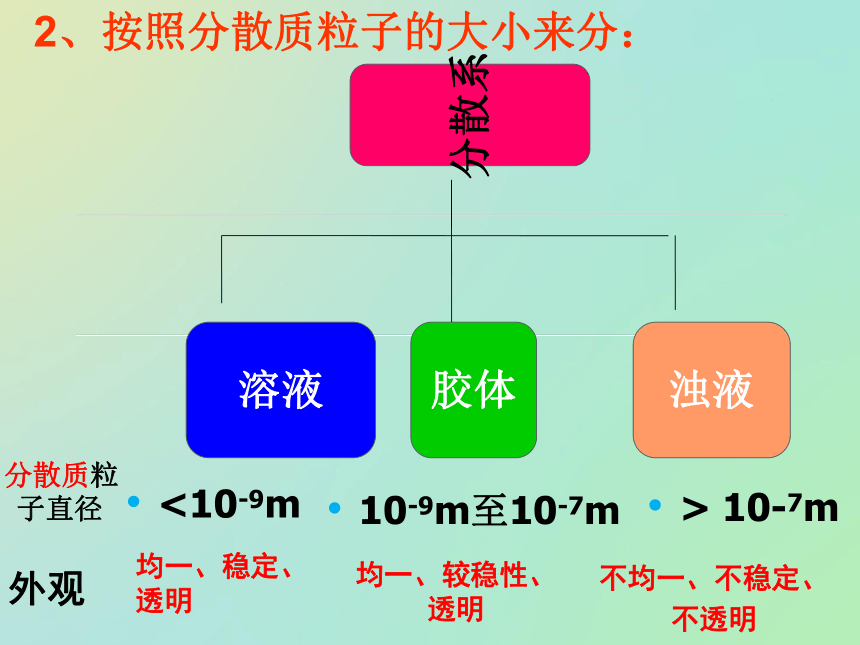
在另一种物质中形成的体系。分散质:被分散的物质。分散剂:微粒分散在其中的物质。一、分散系及其分类1、概念说明:溶质、溶剂概念只适用于溶液,而不能用于其它分散系。2、按照分散质或分散剂所处的状态(气态、液态、固态),它们之间可以有9种组合方式。气液固固液气分散质分散剂浊液溶液10-9m至10-7m> 10-7m<10-9m外观均一、稳定、透明均一、较稳性、透明
不均一、不稳定、
不透明
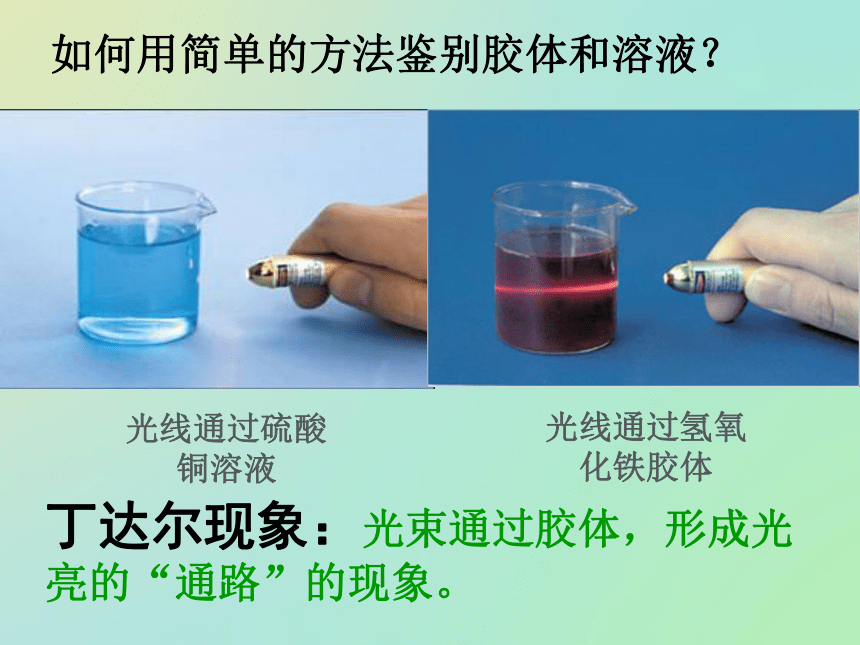
如何用简单的方法鉴别胶体和溶液?丁达尔现象:光束通过胶体,形成光亮的“通路”的现象。光线通过硫酸铜溶液光线通过氢氧化铁胶体二、胶体的概念和性质1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。(1)本质特征:分散质粒子的直径在1~100nm之间.2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体液溶胶:如Fe(OH)3胶体,蛋白质溶液等
2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体液溶胶:如Fe(OH)3胶体,蛋白质溶液等
固溶胶:如有色玻璃等。 总结:能能能否否否<10-9m10-9~10-7m>10-7m均一、
稳定、透明
均一、
较稳性、透明
不均一、不稳定、
不透明
无有无结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够导电,蔗糖和酒精的水溶液不能够导电。溶液的导电性实验活动探究电解质:在水溶液里或熔融状态下能够导电的化合物。非电解质:在水溶液里和熔融状态下均不能够导电的化合物。
如:蔗糖、酒精、CO2、SO2等
电解质
非电解质三、电解质和非电解质如: HCl 、 NaOH、 NaCl、AgCl、BaSO4等
化合物:大多数酸 碱 盐:有机物 非金属氧化物金属导电是因为: 有自由移动的电子交流与讨论:回答下列问题:电解质的溶液导电是因为:熔融的化合物导电是因为:NaCl在水中如何电离的呢?氯化钠溶解的微观过程交流与讨论:回答下列问题:电解质的溶液导电是因为:有自由移动的离子它由分子构成,不能产生自由移动的离子熔融的 NaCl导电是因为:熔融时能产生自由移动的离子液态HCl不导电是因为:固态NaCl不导电是因为:固体时没有自由移动的离子电解质:在水溶液里或熔融状态下能够导电的化合物。非电解质:在水溶液里和熔融状态下均不能够导电的化合物。
如:蔗糖、酒精、CO2、SO2等三、电解质和非电解质如:NaCl、NaOH、HCl、 AgCl、BaSO4等本身能电离出自由移动的离子化合物:电离方程式书写的方法:
4、检验“=”两边是否守恒(原子、电荷)1、写出正确的化学式2、正价——阳离子,负价——阴离子(原子团
不变);离子所带的电荷与相应的化合价相同3、在阴、阳离子的前面配上适当的系数,使
原子个数守恒电离方程式:Na2SO4=2Na++SO42—Ba (OH)2=Ba2++2OH—Al2 (SO4)3=2Al3++2SO42—随堂检测1.用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质粒子的大小和这种纳米粒子大小具有相同的数量级的是( )
A. 溶液 B.悬浊液
C.胶体 D. 乳浊液 C2.区别溶液和胶体的最简单的方法是( )
A. 观察外观 B. 丁达尔效应 C. 加热
3.胶体的最本质的特征是( )
A. 丁达尔效应 B. 可以通过滤纸
C. 分散质粒子的直径在10-9m ~10-7m之间
BC4、以水为分散剂的分散系,按稳定性由弱到强顺序排列的是( )
A、溶液、胶体、浊液 B、浊液、胶体、溶液
C、胶体、浊液、溶液 D、浊液、溶液、胶体B5、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后会出现黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥B练习例1:判断下列说法是否正确。A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C :Cu能导电,所以Cu是电解质;
D :SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电
解质。√××××1、①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2
⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液
(1)上述状态下可导电的是_______________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_________① ② ④ ⑥ ⑧ ⑾ ③ ⑤ ⑩ ⑾⑦ ⑨ ⑿ ⒀③ ⑤ ⑩1【练习】下列物质:
①液态氯化氢 ②硫酸 ③熔融MgCl2 ④胆矾晶体 ⑤食盐水 ⑥酒精
⑦氨水 ⑧液氨 ⑨汞
⑩BaSO4 ⑾SO3 ⑿石墨
其中能导电的物质有 ,
属于电解质的是 ,
属于非电解质的是 。③⑤⑦⑨⑿①②③④⑩⑥⑧⑾分散系举例均一、
稳定、透明
盐水、酒精的水溶液均一、
较稳性、透明
牛奶、豆浆能
不均一、不稳定、
不透明
不能泥水、河水
溶液胶体
浊液
分散质粒子大小能否透过滤纸能当分散剂是水或其它液体物质时:<10-9m10-9~10-7m>10-7m能否透过半透膜能不能不能浊液分散系颗粒直径>100nm胶体分散系1nm<颗粒直径<100nm溶液分散系颗粒直径<1nm
第一单元 丰富多彩的化学物质
第4课时 物质的分散系泥沙混合液、油水混合液、CuSO4混合液
分散系:把一种(或多种)物质分散
在另一种物质中形成的体系。分散质:被分散的物质。分散剂:微粒分散在其中的物质。一、分散系及其分类1、概念说明:溶质、溶剂概念只适用于溶液,而不能用于其它分散系。2、按照分散质或分散剂所处的状态(气态、液态、固态),它们之间可以有9种组合方式。气液固固液气分散质分散剂浊液溶液10-9m至10-7m> 10-7m<10-9m外观均一、稳定、透明均一、较稳性、透明
不均一、不稳定、
不透明
如何用简单的方法鉴别胶体和溶液?丁达尔现象:光束通过胶体,形成光亮的“通路”的现象。光线通过硫酸铜溶液光线通过氢氧化铁胶体二、胶体的概念和性质1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。(1)本质特征:分散质粒子的直径在1~100nm之间.2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体液溶胶:如Fe(OH)3胶体,蛋白质溶液等
2、性质:气溶胶:如雾、云、烟、大气层等。3、分类:根据分散剂状态可分为 (2)胶体表面积大,吸附能力强——用于净水(1)丁达尔现象——区别胶体和溶液(3)不能透过半透膜——分离溶液和胶体液溶胶:如Fe(OH)3胶体,蛋白质溶液等
固溶胶:如有色玻璃等。 总结:能能能否否否<10-9m10-9~10-7m>10-7m均一、
稳定、透明
均一、
较稳性、透明
不均一、不稳定、
不透明
无有无结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够导电,蔗糖和酒精的水溶液不能够导电。溶液的导电性实验活动探究电解质:在水溶液里或熔融状态下能够导电的化合物。非电解质:在水溶液里和熔融状态下均不能够导电的化合物。
如:蔗糖、酒精、CO2、SO2等
电解质
非电解质三、电解质和非电解质如: HCl 、 NaOH、 NaCl、AgCl、BaSO4等
化合物:大多数酸 碱 盐:有机物 非金属氧化物金属导电是因为: 有自由移动的电子交流与讨论:回答下列问题:电解质的溶液导电是因为:熔融的化合物导电是因为:NaCl在水中如何电离的呢?氯化钠溶解的微观过程交流与讨论:回答下列问题:电解质的溶液导电是因为:有自由移动的离子它由分子构成,不能产生自由移动的离子熔融的 NaCl导电是因为:熔融时能产生自由移动的离子液态HCl不导电是因为:固态NaCl不导电是因为:固体时没有自由移动的离子电解质:在水溶液里或熔融状态下能够导电的化合物。非电解质:在水溶液里和熔融状态下均不能够导电的化合物。
如:蔗糖、酒精、CO2、SO2等三、电解质和非电解质如:NaCl、NaOH、HCl、 AgCl、BaSO4等本身能电离出自由移动的离子化合物:电离方程式书写的方法:
4、检验“=”两边是否守恒(原子、电荷)1、写出正确的化学式2、正价——阳离子,负价——阴离子(原子团
不变);离子所带的电荷与相应的化合价相同3、在阴、阳离子的前面配上适当的系数,使
原子个数守恒电离方程式:Na2SO4=2Na++SO42—Ba (OH)2=Ba2++2OH—Al2 (SO4)3=2Al3++2SO42—随堂检测1.用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质粒子的大小和这种纳米粒子大小具有相同的数量级的是( )
A. 溶液 B.悬浊液
C.胶体 D. 乳浊液 C2.区别溶液和胶体的最简单的方法是( )
A. 观察外观 B. 丁达尔效应 C. 加热
3.胶体的最本质的特征是( )
A. 丁达尔效应 B. 可以通过滤纸
C. 分散质粒子的直径在10-9m ~10-7m之间
BC4、以水为分散剂的分散系,按稳定性由弱到强顺序排列的是( )
A、溶液、胶体、浊液 B、浊液、胶体、溶液
C、胶体、浊液、溶液 D、浊液、溶液、胶体B5、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后会出现黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥B练习例1:判断下列说法是否正确。A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C :Cu能导电,所以Cu是电解质;
D :SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电
解质。√××××1、①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2
⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液
(1)上述状态下可导电的是_______________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_________① ② ④ ⑥ ⑧ ⑾ ③ ⑤ ⑩ ⑾⑦ ⑨ ⑿ ⒀③ ⑤ ⑩1【练习】下列物质:
①液态氯化氢 ②硫酸 ③熔融MgCl2 ④胆矾晶体 ⑤食盐水 ⑥酒精
⑦氨水 ⑧液氨 ⑨汞
⑩BaSO4 ⑾SO3 ⑿石墨
其中能导电的物质有 ,
属于电解质的是 ,
属于非电解质的是 。③⑤⑦⑨⑿①②③④⑩⑥⑧⑾分散系举例均一、
稳定、透明
盐水、酒精的水溶液均一、
较稳性、透明
牛奶、豆浆能
不均一、不稳定、
不透明
不能泥水、河水
溶液胶体
浊液
分散质粒子大小能否透过滤纸能当分散剂是水或其它液体物质时:<10-9m10-9~10-7m>10-7m能否透过半透膜能不能不能浊液分散系颗粒直径>100nm胶体分散系1nm<颗粒直径<100nm溶液分散系颗粒直径<1nm
