常见的化合物 中考复习[下学期]
图片预览











文档简介
课件33张PPT。第34课常见的化合物1、常见的三种强酸是盐酸、硫酸和硝酸;酸在水中电离时,生成的阳离子都是相同的一种粒子,这种粒子是氢离子(或H+);家庭厨房的食醋中含有醋酸,人的胃液里含有盐酸。
2.小明同学为了制取氢气,他从废干电池中得到了锌,但此时实验室中只有浓硫酸。为了将浓硫酸稀释,他应把浓硫酸沿着容器壁慢慢地注入水中,并不断搅动,使产生的热量迅速扩散。
3.为了防止硝酸分解,常把硝酸盛放在棕色瓶中,且放置在阴暗、温度堡的地方。实验室中盛放在棕色瓶中的还有一种常见的试剂是硝酸银溶液。4.氢氧化钠(NaOH)俗称烧碱或苛性钠,暴露在空气中容易吸收水分而潮解,并且能与空气中的二氧化碳反应而变质,因此氢氧化钠固体必须密封保存。氢氧化钙的化学式为Ca(OH)2,俗称熟石灰或消石灰,可用来中和酸性土壤;氢氧化钙微溶于水,溶解部分形成的水溶液俗称石灰水。
5.将白醋和肥皂水分别用玻璃棒滴到pH试纸上,然后与标准比色卡对照,测得pH分别为3和10,那么白醋能使紫色石蕊试液变红,肥皂水能使无色酚酞试液变红。
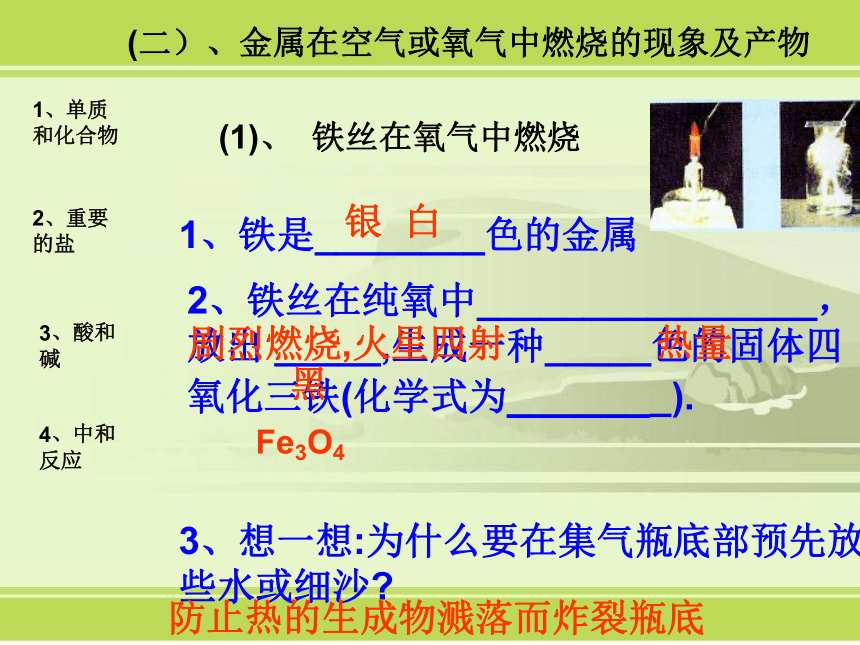
6.纯碱又称苏打,是碳酸钠的俗名,而大理石、石灰石的主要成分是碳酸钙,食盐的化学式是NaCl,小苏打的化学式是NaHCO3,常见的可溶性盐有K+、Na+、NH4+等离子与酸根离子组成的盐;常见的不溶性盐有硫酸盐中的BaSO4等,盐酸盐中的AgCl和大部分的碳酸盐等。 b5)辨认常见的化合物b4)区别单质和化合物a3)描述化合物的概念a2)描述典型金属(镁、铁等)和非金属(硫、磷、氢气等)在空气或氧气中燃烧的现象及产物a1)描述单质的概念 1、单质和化合物a3)描述碳酸钙的主要性质 a2)描述纯碱的性质及用途a1)描述食盐的主要性质及用途 2、重要的盐a1)说出中和反应的特点 4、中和反应a5)描述强酸、强碱的使用注意事项b4)测定溶液的酸碱性a3)举例说明常见的酸、碱的用途和对人类的影响b2)概述酸、碱的共性,并说明原因a1)列举常见的酸、碱的主要的性质 3、酸和碱1、单质和化合物2、重要的盐3、酸和碱4、中和反应 (1)单质:由同种元素组成的纯净物。可分为有机化合物和无机化合物,无机化合物又可分为氧化物、酸、碱和盐。可分为金属、非金属及稀有气体。(2)化合物:由不同种元素组成的纯净物。1.单质和化合物(二)、金属在空气或氧气中燃烧的现象及产物 1、铁是________色的金属2、铁丝在纯氧中________________,放出 _____,生成一种_____色的固体四氧化三铁(化学式为_______).3、想一想:为什么要在集气瓶底部预先放些水或细沙?银 白剧烈燃烧,火星四射热量黑Fe3O4防止热的生成物溅落而炸裂瓶底(1)、 铁丝在氧气中燃烧1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)镁条在空气中燃烧镁条在空气中剧烈燃烧,发出耀眼的强光,生产一种白色的固体物质1、单质和化合物2、重要的盐3、酸和碱4、中和反应(三)、非金属在空气或氧气中燃烧的现象及产物1、硫是____色的固体粉末2、硫在空气中燃烧发出___________色火焰3、硫在纯氧中燃烧发出_____________色火焰,反应后生成一种具有___________气味的二氧化硫手摸集气瓶外壁的感觉是_______,说明硫燃烧能_______热.黄微弱的淡蓝刺激性明亮的蓝紫色热放(1)、硫在氧气中燃烧1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)、红磷在氧气中燃烧的现象:红磷在氧气中燃烧发出白光,冒出白烟,放出热量.(3)氢气在空气中燃烧的现象:纯洁的氢气在空气中能安静的燃烧,发出浅蓝色的火焰, 放出热量.1、单质和化合物2、重要的盐3、酸和碱4、中和反应2、重要的盐1)、什么是盐:是酸与碱中和的产物,能电离出金属阳离子(铵根NH4+ )和酸根阴离子的化合物。1、单质和化合物2、重要的盐3、酸和碱4、中和反应2)描述食盐的主要性质及用途氯化钠(NaCl)俗称:食盐 1.海水、盐湖、盐井和岩矿中都蕴藏着食盐(海盐)(池盐)(井盐.四川)岩盐(含碘少)。 2.粗盐含MgCl2,CaCl2等杂质易潮解,精盐不易潮解。 3.用途:食用,防腐(介绍山区腌菜、鱼),重要化工原料(Na+和Cl-的利用),制0.9%的生理盐水氯化钠(食盐NaCl),用食盐水清洗伤口等。 1、单质和化合物2、重要的盐3、酸和碱4、中和反应(3)碳酸钠(纯碱或苏打Na2CO3) 1.是重要的碳酸盐Na2CO3?10H2O(洗涤碱)易风化。
2.纯碱不是碱,而是盐(名称由来是因为其水溶液呈碱性) 3.碳酸根离子的鉴别方法;用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
Na2CO3+ Ca(OH)2= CaCO3↓+H2O 4.用途:产量一半用于制造玻璃,蒸馒头、煮粥,利用碱性制肥皂,造纸、纺织品等1、单质和化合物2、重要的盐3、酸和碱4、中和反应??????(4)碳酸钙(CaCO3)1.石灰石主要成分为CaCO3(大理石、方解石、白垩,汉白玉,外表不同,化学性质相同)
2.用途:A建筑材料B制水泥和玻璃的原料C炼铁的助熔剂 Ca(OH)2+CO2 = CaCO3↓ +H2O 1、单质和化合物2、重要的盐3、酸和碱4、中和反应(一)列举常见酸的主要的性质食醋——醋酸,胃液——盐酸,柠檬、柑橘等水果中含有柠檬酸。 这些物质在水中电离时,生成的阳离子全部都是氢离子(H+)。酸= H+ + 酸根阴离子1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)、硫酸有哪些性质?Zn + H2SO4 = ZnSO4 + H2 ↑ Fe2O3 + H2SO4= Fe2(SO4)3+ H2 OCuO + H2SO4 =CuSO4+ H2 OCu(OH)2 + H2SO4 = CuSO4 + H2 OBaCI2 + H2SO4 = BaSO4 ↓+ 2HCI1、稀硫酸 + 某些金属 === 硫酸盐 + 氢气2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水3、稀硫酸 + 碱 === 硫酸盐 + 水4、硫酸 + 某些盐 === 硫酸盐 + 另一种酸SO42—的检验方法:滴加氯化钡(或硝酸钡)溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。1、 盐酸能使紫色的石蕊变红,无色酚酞不变色。2、 盐酸 + 碱 〓 盐 + 水 3、盐酸 + 盐 = 新盐 + 新酸4、 盐酸 +金属氧化物= 盐 + 水5、盐酸+金属 = 盐 + 氢气(3)、盐酸的有哪些性质?(化学性质)Cl—的检验方法:滴加硝酸银溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。列举常见碱的主要的性质1.未成熟的柿子中存在碱性物质,家用的洗涤剂中也存在着碱性物质;常见的物质中,NaOH、Ca(OH)2等物质都属于碱。2.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。1、单质和化合物2、重要的盐3、酸和碱4、中和反应1、碱有哪些通性?(1)、碱性物质能使紫色石蕊变蓝,无色酚酞变红.(2)、碱跟酸作用生成盐和水
这种反应也叫中和反应。(3)、非金属氧化物跟碱反应生成盐和水(4)、盐和碱反应生成另一种碱 和另一种盐氢氧化钠极易溶于水、溶解时放出大量的热。氢氧化钠具有强烈的腐蚀性 氢氧化钠俗名:苛性钠、烧碱、火碱氢氧化钠必须密封保存碱的水溶液有滑腻感。羊毛在碱性条件下易发生水解即不耐碱。2、氢氧化钙俗名:熟石灰、消石灰、石灰浆、石灰乳化学反应方程式:Ca(OH )2 + 2HCl = Ca Cl2+ 2H2OCa(OH )2 + H2SO4= Ca SO4+2H2O 碱 + 酸 = 盐 + 水化学反应方程式:Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH 3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2 碱 + 盐 =另一种碱 + 另一种盐 (1)酸碱指示剂
(2)pH试纸
(3)认识溶液酸碱度的意义:①科学实验及化工生产中有许多反应必须在一定的pH溶液中才能反应;②农作物一般适宜在pH接近或等于7的土壤中才能茁壮生长;③测定雨水的pH能了解空气污染程度;④测定人体内排出液体的pH,可以了解人的健康状况。 1、单质和化合物2、重要的盐3、酸和碱4、中和反应5.测定溶液酸碱性的方法酸(或碱)流到实验台上——用适量碳酸氢钠溶液(或稀醋酸)冲洗——水洗——布擦。
碱溶液滴到皮肤上——水洗——涂硼酸
酸溶液滴到皮肤上——水洗——涂3%~5%碳酸氢钠溶液(若是浓硫酸应先布擦再水洗)。6、描述强酸、强碱的使用注意事项1、单质和化合物2、重要的盐3、酸和碱4、中和反应浓硫酸易溶于水,同时放出大量的热,且密度比水大,稀释时应做到:
①一定要注酸入水,万勿注水入酸。
②慢慢地沿玻璃棒(或器壁)倒入。
③不断地搅拌,使产生的热量迅速地扩散。1、单质和化合物2、重要的盐3、酸和碱4、中和反应7、浓硫酸稀释时的注意事项2).中和反应的应用:3)中和反应的实质:
实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O3.中和反应:1)定义:碱跟酸作用生成盐和水的反应叫中和反应。1、单质和化合物2、重要的盐3、酸和碱4、中和反应【课后强化训练】
1.D 2.A 3.D 4.C 5.A 6.A 7.B
8.(1)澄清石灰水 (2)气泡 白色浑浊(3)2HCI+CaCO3=CaCl2+H2O+CO2↑ CO2+Ca(OH)2=CaCO3+H2O
9.酸雨减少含硫燃料的燃烧,减少汽车尾气的排放,在其表面喷防护材料等
10.(1)取少量污水,向其中滴入2—3滴无色酚酞试液,变红,则说明污水呈碱性(其他试剂如紫色石蕊试液pH试纸等都可以);(2)取少量污水,向其中滴加氯化铁溶液或硫酸铜溶液,产生红褐色沉淀或蓝色沉淀,说明污水呈碱性(其他合理答案均可)11.(1)NaCl、NaNO3、Na2SO4、Na2CO3等 (2)Na2SO4 12.D
13. 2NaOH+SO2=Na2SO3+H2O
14.(1)酸碱指示剂可从紫罗兰花瓣中提取;(2)紫罗兰花瓣上某物质与盐酸反应生成红色物质;(3)其它酸溅到紫罗兰花瓣上也能出现红点等。 15.H2SO4或HCl Ca(OH)2或Ba(OH)2 CaCl2或BaCl2等
16.浓硫酸溶于水放热,使白磷的温度达到着火点 铜是热的良导体且不与稀硫酸反应
17.B 18.盐酸具有挥发性
19.C20.(1)烧杯中物质总质量减小的原因是反应放出氢气、HCl逸出、反应放热加速蒸气蒸发等(2)表示小明实验结果的是图中的曲线① (3)图中的曲线②与曲线①不同的原因是曲线②盐酸浓度较大,反应速率较快,所以开始曲线下降较快;曲线②盐酸浓度较大,逸出的HCl较多,所以最后的位置比较低
21.偏高 22.甲:不可行.因盐酸尽管能反应掉Na2CO3,但反应后生成NaCl,引入了新的杂质
乙:可行,因硫酸反应掉Na2CO3,且生成Na2SO4与原物质相同
丙:不可行,因Ba(OH)2在反应掉Na2CO3的同时,也能与Na2SO4反应
23.乙同学的方案不可行。
原因是Ca(OH)2溶液与盐酸反应无明显的现象,则无法确定所加的Ca(OH)2溶液与盐酸是否恰好完全反应。若盐酸过量,溶液呈酸性;若Ca(OH)2溶液过量,则溶液呈碱性;因此很难使溶液恰好变为中性。甲同学的方案可行。加入过量的碳酸钙粉末后,碳酸钙反应掉溶液中的盐酸,而过量的碳酸钙难溶于水,则所得的溶液呈中性24.甲同学的方案不严密,因为含Ag+而不含SO42-的溶液也会出现此方案的现象
乙同学方案严密,因为它可有效排除Ag+干扰的可能性,只有溶液含有SO42-时才能出现此方案的现象
25.B、C
2.小明同学为了制取氢气,他从废干电池中得到了锌,但此时实验室中只有浓硫酸。为了将浓硫酸稀释,他应把浓硫酸沿着容器壁慢慢地注入水中,并不断搅动,使产生的热量迅速扩散。
3.为了防止硝酸分解,常把硝酸盛放在棕色瓶中,且放置在阴暗、温度堡的地方。实验室中盛放在棕色瓶中的还有一种常见的试剂是硝酸银溶液。4.氢氧化钠(NaOH)俗称烧碱或苛性钠,暴露在空气中容易吸收水分而潮解,并且能与空气中的二氧化碳反应而变质,因此氢氧化钠固体必须密封保存。氢氧化钙的化学式为Ca(OH)2,俗称熟石灰或消石灰,可用来中和酸性土壤;氢氧化钙微溶于水,溶解部分形成的水溶液俗称石灰水。
5.将白醋和肥皂水分别用玻璃棒滴到pH试纸上,然后与标准比色卡对照,测得pH分别为3和10,那么白醋能使紫色石蕊试液变红,肥皂水能使无色酚酞试液变红。
6.纯碱又称苏打,是碳酸钠的俗名,而大理石、石灰石的主要成分是碳酸钙,食盐的化学式是NaCl,小苏打的化学式是NaHCO3,常见的可溶性盐有K+、Na+、NH4+等离子与酸根离子组成的盐;常见的不溶性盐有硫酸盐中的BaSO4等,盐酸盐中的AgCl和大部分的碳酸盐等。 b5)辨认常见的化合物b4)区别单质和化合物a3)描述化合物的概念a2)描述典型金属(镁、铁等)和非金属(硫、磷、氢气等)在空气或氧气中燃烧的现象及产物a1)描述单质的概念 1、单质和化合物a3)描述碳酸钙的主要性质 a2)描述纯碱的性质及用途a1)描述食盐的主要性质及用途 2、重要的盐a1)说出中和反应的特点 4、中和反应a5)描述强酸、强碱的使用注意事项b4)测定溶液的酸碱性a3)举例说明常见的酸、碱的用途和对人类的影响b2)概述酸、碱的共性,并说明原因a1)列举常见的酸、碱的主要的性质 3、酸和碱1、单质和化合物2、重要的盐3、酸和碱4、中和反应 (1)单质:由同种元素组成的纯净物。可分为有机化合物和无机化合物,无机化合物又可分为氧化物、酸、碱和盐。可分为金属、非金属及稀有气体。(2)化合物:由不同种元素组成的纯净物。1.单质和化合物(二)、金属在空气或氧气中燃烧的现象及产物 1、铁是________色的金属2、铁丝在纯氧中________________,放出 _____,生成一种_____色的固体四氧化三铁(化学式为_______).3、想一想:为什么要在集气瓶底部预先放些水或细沙?银 白剧烈燃烧,火星四射热量黑Fe3O4防止热的生成物溅落而炸裂瓶底(1)、 铁丝在氧气中燃烧1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)镁条在空气中燃烧镁条在空气中剧烈燃烧,发出耀眼的强光,生产一种白色的固体物质1、单质和化合物2、重要的盐3、酸和碱4、中和反应(三)、非金属在空气或氧气中燃烧的现象及产物1、硫是____色的固体粉末2、硫在空气中燃烧发出___________色火焰3、硫在纯氧中燃烧发出_____________色火焰,反应后生成一种具有___________气味的二氧化硫手摸集气瓶外壁的感觉是_______,说明硫燃烧能_______热.黄微弱的淡蓝刺激性明亮的蓝紫色热放(1)、硫在氧气中燃烧1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)、红磷在氧气中燃烧的现象:红磷在氧气中燃烧发出白光,冒出白烟,放出热量.(3)氢气在空气中燃烧的现象:纯洁的氢气在空气中能安静的燃烧,发出浅蓝色的火焰, 放出热量.1、单质和化合物2、重要的盐3、酸和碱4、中和反应2、重要的盐1)、什么是盐:是酸与碱中和的产物,能电离出金属阳离子(铵根NH4+ )和酸根阴离子的化合物。1、单质和化合物2、重要的盐3、酸和碱4、中和反应2)描述食盐的主要性质及用途氯化钠(NaCl)俗称:食盐 1.海水、盐湖、盐井和岩矿中都蕴藏着食盐(海盐)(池盐)(井盐.四川)岩盐(含碘少)。 2.粗盐含MgCl2,CaCl2等杂质易潮解,精盐不易潮解。 3.用途:食用,防腐(介绍山区腌菜、鱼),重要化工原料(Na+和Cl-的利用),制0.9%的生理盐水氯化钠(食盐NaCl),用食盐水清洗伤口等。 1、单质和化合物2、重要的盐3、酸和碱4、中和反应(3)碳酸钠(纯碱或苏打Na2CO3) 1.是重要的碳酸盐Na2CO3?10H2O(洗涤碱)易风化。
2.纯碱不是碱,而是盐(名称由来是因为其水溶液呈碱性) 3.碳酸根离子的鉴别方法;用稀盐酸和澄清的石灰水。
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
Na2CO3+ Ca(OH)2= CaCO3↓+H2O 4.用途:产量一半用于制造玻璃,蒸馒头、煮粥,利用碱性制肥皂,造纸、纺织品等1、单质和化合物2、重要的盐3、酸和碱4、中和反应??????(4)碳酸钙(CaCO3)1.石灰石主要成分为CaCO3(大理石、方解石、白垩,汉白玉,外表不同,化学性质相同)
2.用途:A建筑材料B制水泥和玻璃的原料C炼铁的助熔剂 Ca(OH)2+CO2 = CaCO3↓ +H2O 1、单质和化合物2、重要的盐3、酸和碱4、中和反应(一)列举常见酸的主要的性质食醋——醋酸,胃液——盐酸,柠檬、柑橘等水果中含有柠檬酸。 这些物质在水中电离时,生成的阳离子全部都是氢离子(H+)。酸= H+ + 酸根阴离子1、单质和化合物2、重要的盐3、酸和碱4、中和反应(2)、硫酸有哪些性质?Zn + H2SO4 = ZnSO4 + H2 ↑ Fe2O3 + H2SO4= Fe2(SO4)3+ H2 OCuO + H2SO4 =CuSO4+ H2 OCu(OH)2 + H2SO4 = CuSO4 + H2 OBaCI2 + H2SO4 = BaSO4 ↓+ 2HCI1、稀硫酸 + 某些金属 === 硫酸盐 + 氢气2、稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水3、稀硫酸 + 碱 === 硫酸盐 + 水4、硫酸 + 某些盐 === 硫酸盐 + 另一种酸SO42—的检验方法:滴加氯化钡(或硝酸钡)溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。1、 盐酸能使紫色的石蕊变红,无色酚酞不变色。2、 盐酸 + 碱 〓 盐 + 水 3、盐酸 + 盐 = 新盐 + 新酸4、 盐酸 +金属氧化物= 盐 + 水5、盐酸+金属 = 盐 + 氢气(3)、盐酸的有哪些性质?(化学性质)Cl—的检验方法:滴加硝酸银溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解。列举常见碱的主要的性质1.未成熟的柿子中存在碱性物质,家用的洗涤剂中也存在着碱性物质;常见的物质中,NaOH、Ca(OH)2等物质都属于碱。2.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。1、单质和化合物2、重要的盐3、酸和碱4、中和反应1、碱有哪些通性?(1)、碱性物质能使紫色石蕊变蓝,无色酚酞变红.(2)、碱跟酸作用生成盐和水
这种反应也叫中和反应。(3)、非金属氧化物跟碱反应生成盐和水(4)、盐和碱反应生成另一种碱 和另一种盐氢氧化钠极易溶于水、溶解时放出大量的热。氢氧化钠具有强烈的腐蚀性 氢氧化钠俗名:苛性钠、烧碱、火碱氢氧化钠必须密封保存碱的水溶液有滑腻感。羊毛在碱性条件下易发生水解即不耐碱。2、氢氧化钙俗名:熟石灰、消石灰、石灰浆、石灰乳化学反应方程式:Ca(OH )2 + 2HCl = Ca Cl2+ 2H2OCa(OH )2 + H2SO4= Ca SO4+2H2O 碱 + 酸 = 盐 + 水化学反应方程式:Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH 3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2 碱 + 盐 =另一种碱 + 另一种盐 (1)酸碱指示剂
(2)pH试纸
(3)认识溶液酸碱度的意义:①科学实验及化工生产中有许多反应必须在一定的pH溶液中才能反应;②农作物一般适宜在pH接近或等于7的土壤中才能茁壮生长;③测定雨水的pH能了解空气污染程度;④测定人体内排出液体的pH,可以了解人的健康状况。 1、单质和化合物2、重要的盐3、酸和碱4、中和反应5.测定溶液酸碱性的方法酸(或碱)流到实验台上——用适量碳酸氢钠溶液(或稀醋酸)冲洗——水洗——布擦。
碱溶液滴到皮肤上——水洗——涂硼酸
酸溶液滴到皮肤上——水洗——涂3%~5%碳酸氢钠溶液(若是浓硫酸应先布擦再水洗)。6、描述强酸、强碱的使用注意事项1、单质和化合物2、重要的盐3、酸和碱4、中和反应浓硫酸易溶于水,同时放出大量的热,且密度比水大,稀释时应做到:
①一定要注酸入水,万勿注水入酸。
②慢慢地沿玻璃棒(或器壁)倒入。
③不断地搅拌,使产生的热量迅速地扩散。1、单质和化合物2、重要的盐3、酸和碱4、中和反应7、浓硫酸稀释时的注意事项2).中和反应的应用:3)中和反应的实质:
实质是酸电离的H+与碱电离的OH-结合成中性的水。
H++OH-=H2O3.中和反应:1)定义:碱跟酸作用生成盐和水的反应叫中和反应。1、单质和化合物2、重要的盐3、酸和碱4、中和反应【课后强化训练】
1.D 2.A 3.D 4.C 5.A 6.A 7.B
8.(1)澄清石灰水 (2)气泡 白色浑浊(3)2HCI+CaCO3=CaCl2+H2O+CO2↑ CO2+Ca(OH)2=CaCO3+H2O
9.酸雨减少含硫燃料的燃烧,减少汽车尾气的排放,在其表面喷防护材料等
10.(1)取少量污水,向其中滴入2—3滴无色酚酞试液,变红,则说明污水呈碱性(其他试剂如紫色石蕊试液pH试纸等都可以);(2)取少量污水,向其中滴加氯化铁溶液或硫酸铜溶液,产生红褐色沉淀或蓝色沉淀,说明污水呈碱性(其他合理答案均可)11.(1)NaCl、NaNO3、Na2SO4、Na2CO3等 (2)Na2SO4 12.D
13. 2NaOH+SO2=Na2SO3+H2O
14.(1)酸碱指示剂可从紫罗兰花瓣中提取;(2)紫罗兰花瓣上某物质与盐酸反应生成红色物质;(3)其它酸溅到紫罗兰花瓣上也能出现红点等。 15.H2SO4或HCl Ca(OH)2或Ba(OH)2 CaCl2或BaCl2等
16.浓硫酸溶于水放热,使白磷的温度达到着火点 铜是热的良导体且不与稀硫酸反应
17.B 18.盐酸具有挥发性
19.C20.(1)烧杯中物质总质量减小的原因是反应放出氢气、HCl逸出、反应放热加速蒸气蒸发等(2)表示小明实验结果的是图中的曲线① (3)图中的曲线②与曲线①不同的原因是曲线②盐酸浓度较大,反应速率较快,所以开始曲线下降较快;曲线②盐酸浓度较大,逸出的HCl较多,所以最后的位置比较低
21.偏高 22.甲:不可行.因盐酸尽管能反应掉Na2CO3,但反应后生成NaCl,引入了新的杂质
乙:可行,因硫酸反应掉Na2CO3,且生成Na2SO4与原物质相同
丙:不可行,因Ba(OH)2在反应掉Na2CO3的同时,也能与Na2SO4反应
23.乙同学的方案不可行。
原因是Ca(OH)2溶液与盐酸反应无明显的现象,则无法确定所加的Ca(OH)2溶液与盐酸是否恰好完全反应。若盐酸过量,溶液呈酸性;若Ca(OH)2溶液过量,则溶液呈碱性;因此很难使溶液恰好变为中性。甲同学的方案可行。加入过量的碳酸钙粉末后,碳酸钙反应掉溶液中的盐酸,而过量的碳酸钙难溶于水,则所得的溶液呈中性24.甲同学的方案不严密,因为含Ag+而不含SO42-的溶液也会出现此方案的现象
乙同学方案严密,因为它可有效排除Ag+干扰的可能性,只有溶液含有SO42-时才能出现此方案的现象
25.B、C
