中考复习-酸碱盐[下学期]
图片预览



文档简介
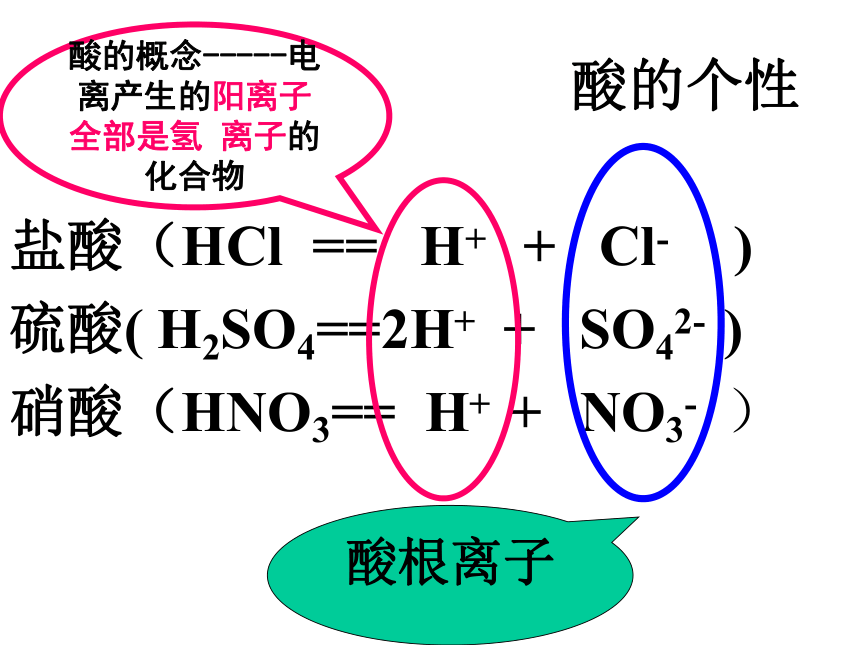
课件31张PPT。酸碱盐酸的个性盐酸(HCl == H+ + Cl- )
硫酸( H2SO4==2H+ + SO42- )
硝酸(HNO3== H+ + NO3- )酸根离子酸的概念-----电离产生的阳离子全部是氢 离子的化合物盐酸(HCl)
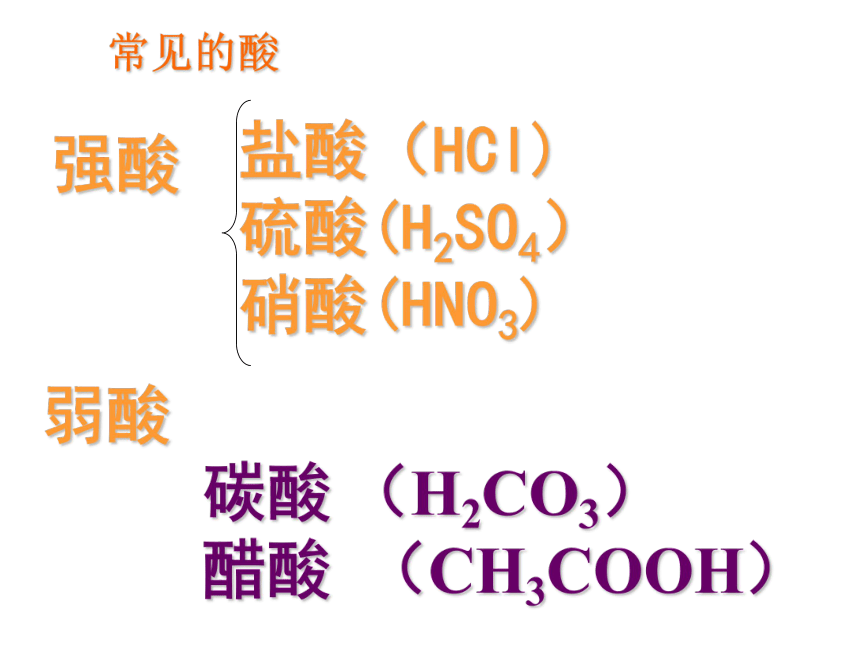
硫酸(H2SO4)
硝酸(HNO3) 弱酸
碳酸 (H2CO3)
醋酸 (CH3COOH)强酸
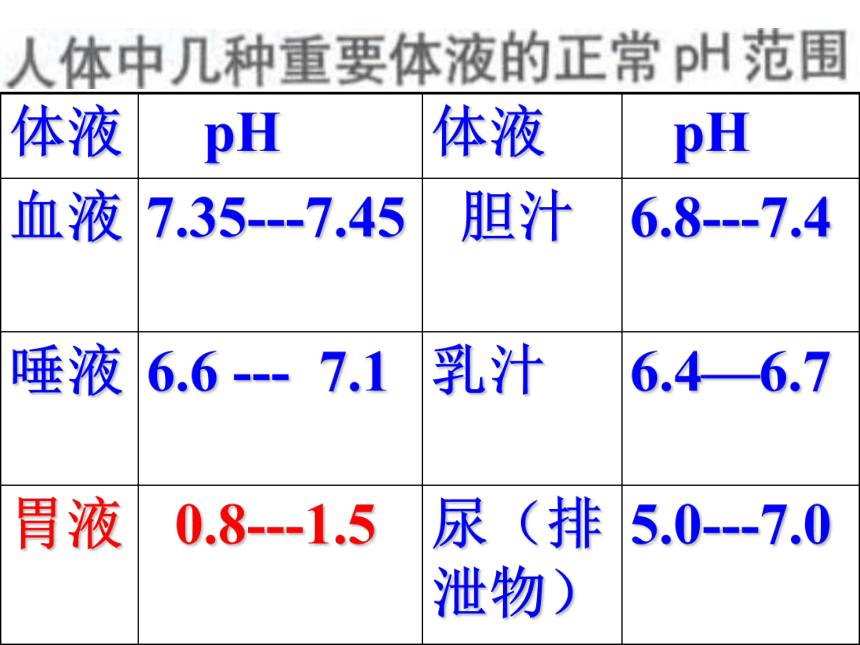
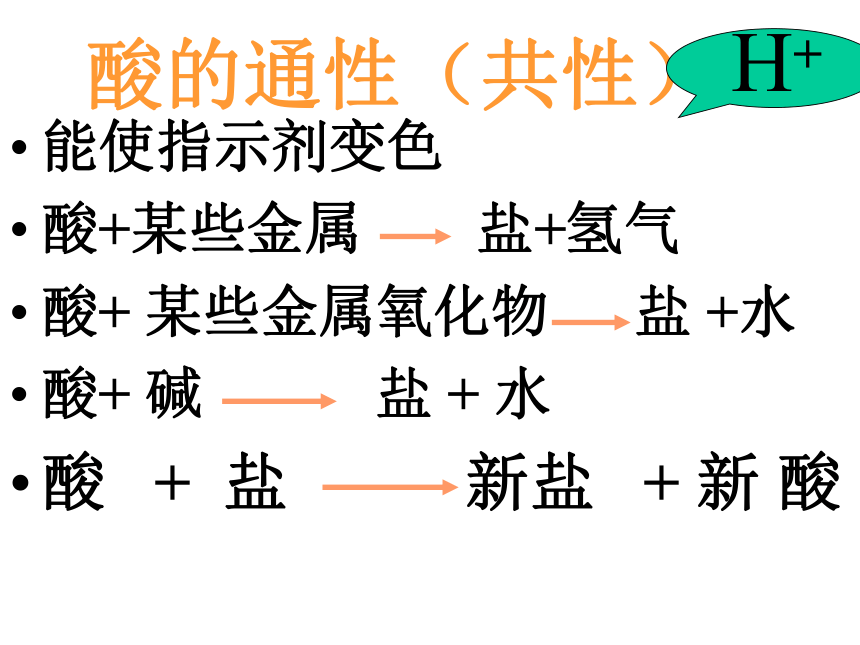
常见的酸检测溶液的酸碱性方法1、pH试纸2、酸碱指示剂酸的通性(共性)能使指示剂变色
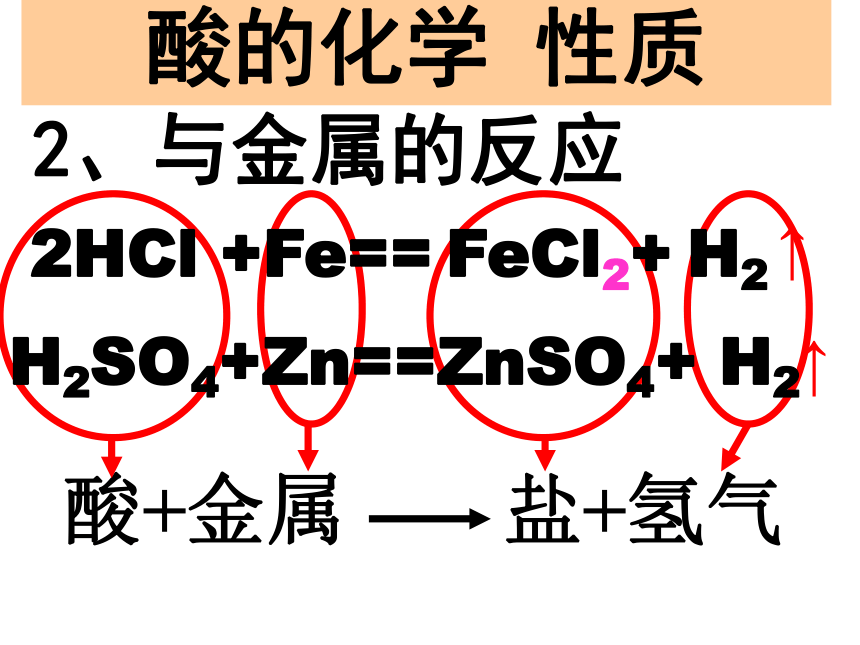
酸+某些金属 盐+氢气
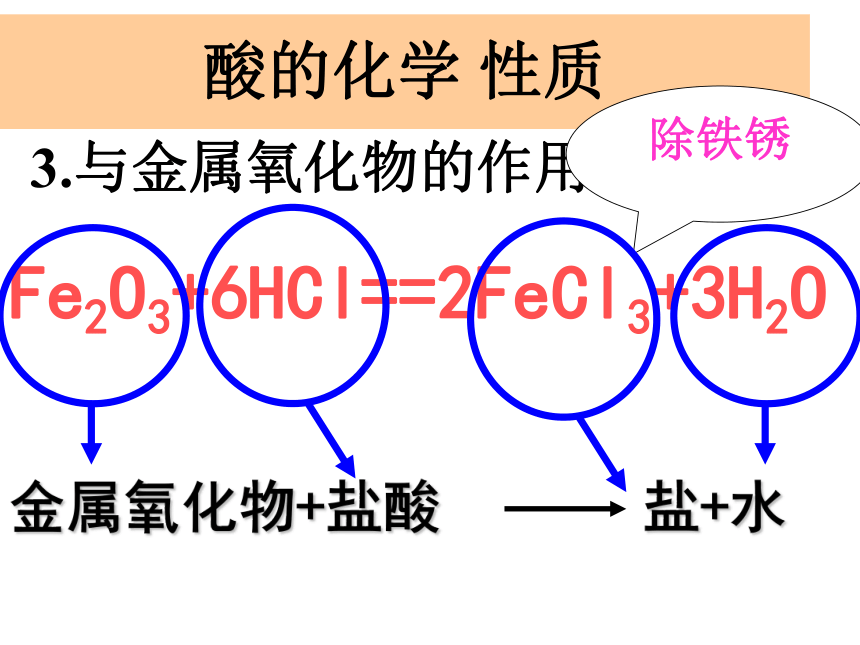
酸+ 某些金属氧化物 盐 +水
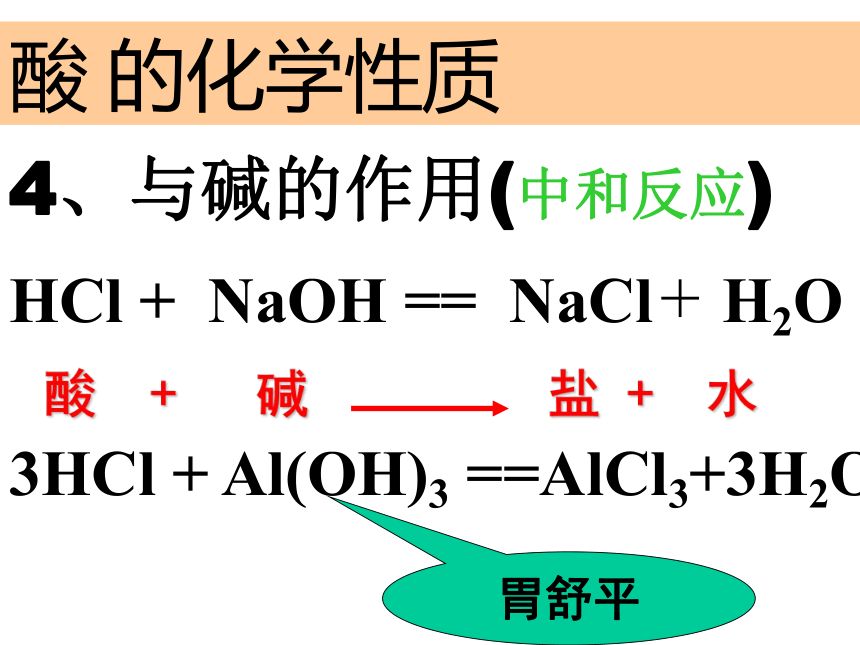
酸+ 碱 盐 + 水
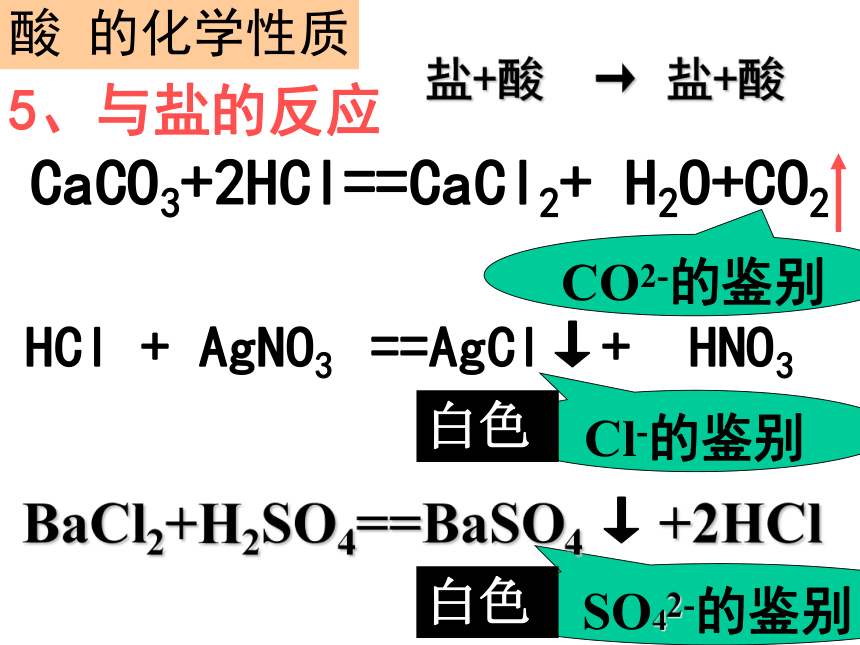
酸 + 盐 新盐 + 新 酸
H+1、使石蕊变红 使酚酞不变色 酸的化学性质酸的化学 性质H2SO4+Zn==ZnSO4+ H2 酸+金属 盐+氢气2HCl +Fe== FeCl2+ H2 2、与金属的反应↑↑Fe2O3+6HCl==2FeCl3+3H2O
3.与金属氧化物的作用金属氧化物+盐酸 盐+水酸的化学 性质除铁锈酸 的化学性质4、与碱的作用(中和反应)
HCl + NaOH == NaCl + H2O 3HCl + Al(OH)3 ==AlCl3+3H2O胃舒平酸 + 碱 盐 + 水SO42-的鉴别
酸 的化学性质5、与盐的反应 盐+酸 → 盐+酸HCl + AgNO3 ==AgCl↓+ HNO3 Cl-的鉴别
白色BaCl2+H2SO4==BaSO4 ↓ +2HCl
白色CO2-的鉴别
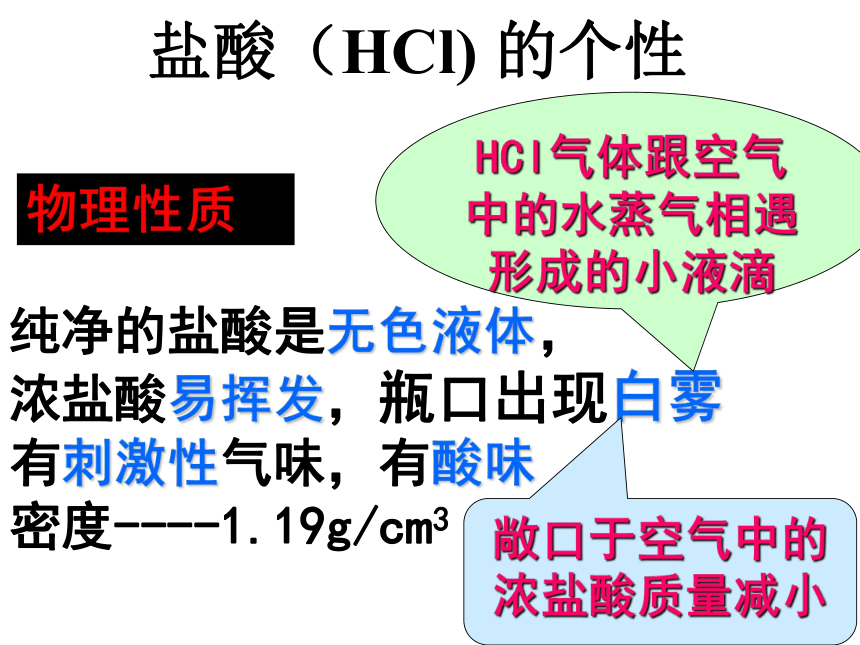
盐酸(HCl) 的个性纯净的盐酸是无色液体,
浓盐酸易挥发,瓶口出现白雾
有刺激性气味,有酸味
密度----1.19g/cm3
HCl气体跟空气中的水蒸气相遇形成的小液滴物理性质敞口于空气中的浓盐酸质量减小硫酸( H2SO4)的个性纯净的硫酸是无色无味的液体,
不易挥发
浓硫酸 ----- 粘稠、油状的液体
密度----1.84g/cm3
物理性质1、浓硫酸的脱水性 ----使纸张、木材变黑,发生碳化 浓硫酸的特性2、浓硫酸的吸水性--浓硫酸的特性敞口于空气中的浓硫酸质量增加作干燥剂例如:可以干燥H2、O2、CO2等气体1、浓硫酸具有很强的腐蚀性,使用时要小心!注意浓硫酸溶于水放出大量的热,且密度大于水的密度2、稀释时一定要把浓硫酸沿着器壁满满地注入水里,并不断搅动,使产生的热量迅速扩散。切不可将水倒进硫酸中
稀释浓硫酸
NaOH === Na+ + OH- Ca(OH)2 ===Ca 2+ + OH-2碱的概念
-------电离产生的阴离子全部是氢氧 根离子的化合物常见的碱
强碱----
氢氧化钠 (NaOH)
氢氧化钙(Ca(OH)2)弱碱----氨水(NH3.H2O)碱 的化学性质 2:与非金属氧化物反应 盐 +水1:与酸碱指示剂反应碱 的化学性质2.与非金属氧化物反应1.与酸碱指示剂反应盐 + 水石蕊试液变蓝、酚酞试液变红建筑业碱 的化学性质NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O3:与酸反应(中和反应)盐 + 水碱的化学性质CuCl2+2NaOH=Cu(OH)2 ↓ +2NaCl FeCl3+3NaOH=Fe(OH)3 +3NaCl蓝色 红褐色4、与盐的反应制取Ca(OH)2+Na2CO3== CaCO3↓+NaOHCu(OH)2===== CuO+ H2O2Fe(OH)3==== Fe2O 3+ 3H2O5. 不溶性碱 金属氧化物+水碱的化学性质可溶性碱的制取
CaO+ H2O=== Ca(OH)2氢氧化钙(Ca(OH)2)的用途制造烧碱改良土壤建筑业氢氧化钠是一种碱性干燥剂干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意:不能干燥酸性气体
(HCl、CO2、 SO2、H2S等)
氢氧化钠(NaOH)的个性物理性质 纯净的氢氧化钠是白色固体,极易溶于水,溶解时放出大量的热,易潮解,水溶液有涩味和滑腻感。物理性质氢氧化钙(Ca(OH)2 的个性物理性质 纯净的氢氧化钙(Ca(OH)2是白色粉末,微溶于水。有强烈的腐蚀性物理性质俗名:熟石灰、消石灰三、常见的盐 NaCl Na2CO3 CuSO4
KNO3 KAl(SO4)2 .12 H2O有金属离子和酸根离子组
成的化合物1、与酸的反应----盐+酸 2、与碱的反应---盐+碱 3、与盐的反应----盐+盐盐的性质二者必须可溶4、与金属的反应CaCO3+2HCl==CaCl2+H2O +CO2↑2HCl+Na2CO3=2NaCl+H2O+CO2↑实验室制取CO2NaCl + AgNO3 ==AgCl↓+ NaNO3
白色
硫酸( H2SO4==2H+ + SO42- )
硝酸(HNO3== H+ + NO3- )酸根离子酸的概念-----电离产生的阳离子全部是氢 离子的化合物盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3) 弱酸
碳酸 (H2CO3)
醋酸 (CH3COOH)强酸
常见的酸检测溶液的酸碱性方法1、pH试纸2、酸碱指示剂酸的通性(共性)能使指示剂变色
酸+某些金属 盐+氢气
酸+ 某些金属氧化物 盐 +水
酸+ 碱 盐 + 水
酸 + 盐 新盐 + 新 酸
H+1、使石蕊变红 使酚酞不变色 酸的化学性质酸的化学 性质H2SO4+Zn==ZnSO4+ H2 酸+金属 盐+氢气2HCl +Fe== FeCl2+ H2 2、与金属的反应↑↑Fe2O3+6HCl==2FeCl3+3H2O
3.与金属氧化物的作用金属氧化物+盐酸 盐+水酸的化学 性质除铁锈酸 的化学性质4、与碱的作用(中和反应)
HCl + NaOH == NaCl + H2O 3HCl + Al(OH)3 ==AlCl3+3H2O胃舒平酸 + 碱 盐 + 水SO42-的鉴别
酸 的化学性质5、与盐的反应 盐+酸 → 盐+酸HCl + AgNO3 ==AgCl↓+ HNO3 Cl-的鉴别
白色BaCl2+H2SO4==BaSO4 ↓ +2HCl
白色CO2-的鉴别
盐酸(HCl) 的个性纯净的盐酸是无色液体,
浓盐酸易挥发,瓶口出现白雾
有刺激性气味,有酸味
密度----1.19g/cm3
HCl气体跟空气中的水蒸气相遇形成的小液滴物理性质敞口于空气中的浓盐酸质量减小硫酸( H2SO4)的个性纯净的硫酸是无色无味的液体,
不易挥发
浓硫酸 ----- 粘稠、油状的液体
密度----1.84g/cm3
物理性质1、浓硫酸的脱水性 ----使纸张、木材变黑,发生碳化 浓硫酸的特性2、浓硫酸的吸水性--浓硫酸的特性敞口于空气中的浓硫酸质量增加作干燥剂例如:可以干燥H2、O2、CO2等气体1、浓硫酸具有很强的腐蚀性,使用时要小心!注意浓硫酸溶于水放出大量的热,且密度大于水的密度2、稀释时一定要把浓硫酸沿着器壁满满地注入水里,并不断搅动,使产生的热量迅速扩散。切不可将水倒进硫酸中
稀释浓硫酸
NaOH === Na+ + OH- Ca(OH)2 ===Ca 2+ + OH-2碱的概念
-------电离产生的阴离子全部是氢氧 根离子的化合物常见的碱
强碱----
氢氧化钠 (NaOH)
氢氧化钙(Ca(OH)2)弱碱----氨水(NH3.H2O)碱 的化学性质 2:与非金属氧化物反应 盐 +水1:与酸碱指示剂反应碱 的化学性质2.与非金属氧化物反应1.与酸碱指示剂反应盐 + 水石蕊试液变蓝、酚酞试液变红建筑业碱 的化学性质NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O3:与酸反应(中和反应)盐 + 水碱的化学性质CuCl2+2NaOH=Cu(OH)2 ↓ +2NaCl FeCl3+3NaOH=Fe(OH)3 +3NaCl蓝色 红褐色4、与盐的反应制取Ca(OH)2+Na2CO3== CaCO3↓+NaOHCu(OH)2===== CuO+ H2O2Fe(OH)3==== Fe2O 3+ 3H2O5. 不溶性碱 金属氧化物+水碱的化学性质可溶性碱的制取
CaO+ H2O=== Ca(OH)2氢氧化钙(Ca(OH)2)的用途制造烧碱改良土壤建筑业氢氧化钠是一种碱性干燥剂干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意:不能干燥酸性气体
(HCl、CO2、 SO2、H2S等)
氢氧化钠(NaOH)的个性物理性质 纯净的氢氧化钠是白色固体,极易溶于水,溶解时放出大量的热,易潮解,水溶液有涩味和滑腻感。物理性质氢氧化钙(Ca(OH)2 的个性物理性质 纯净的氢氧化钙(Ca(OH)2是白色粉末,微溶于水。有强烈的腐蚀性物理性质俗名:熟石灰、消石灰三、常见的盐 NaCl Na2CO3 CuSO4
KNO3 KAl(SO4)2 .12 H2O有金属离子和酸根离子组
成的化合物1、与酸的反应----盐+酸 2、与碱的反应---盐+碱 3、与盐的反应----盐+盐盐的性质二者必须可溶4、与金属的反应CaCO3+2HCl==CaCl2+H2O +CO2↑2HCl+Na2CO3=2NaCl+H2O+CO2↑实验室制取CO2NaCl + AgNO3 ==AgCl↓+ NaNO3
白色
