中考复习:构成物质的微粒[下学期]
图片预览







文档简介
课件23张PPT。构成物质的微粒我们的学校是用什么材料建造的?这些材料又是由哪些粒子构成?一、原子的构成及结构模型的发展史:
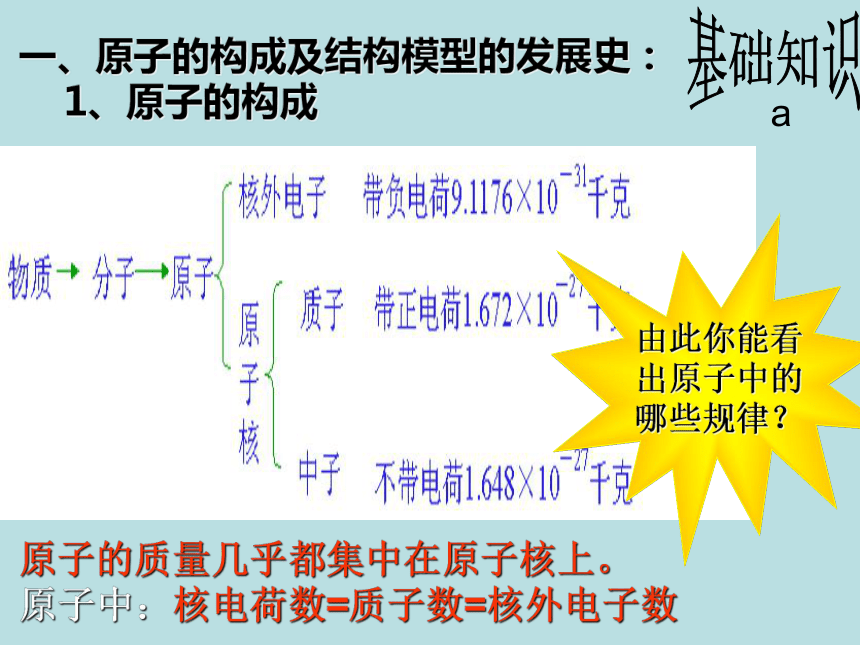
1、原子的构成
原子的质量几乎都集中在原子核上。
原子中:核电荷数=质子数=核外电子数
夸克基础知识a由此你能看出原子中的哪些规律?数的启示? 铅笔留下的黑色的笔迹是碳原子的堆积,一个句号竟有1018个碳原子。2、原子的大小:
原子很小:原子的半径一般在10-10米数量级;原子核的半径:10-15 ~10-14米;原子的质量也非常小一个碳原子的质量约为1.993×10-26千克。(1纳米=10-9米)
原子是如此之小,我们是如何了解它的内部结构的呢?
硅原子的电子隧道显微镜图像。3、原子的结构模型的发展史:
认为原子就是一个不可再分的实心圆球。(实心球模型) 道尔顿模型(1803年)汤姆森原子模型(1897年)
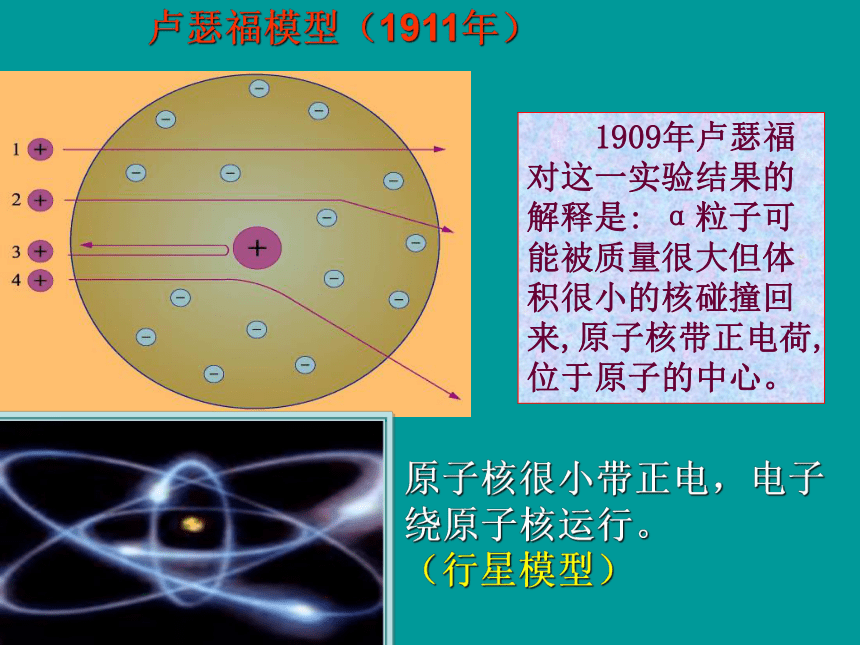
原子是一个平均分布着正电荷的球体(似西瓜肉),带负电荷的电子(似西瓜籽)嵌在中间。(西瓜模型) 1909年卢瑟福对这一实验结果的解释是: α粒子可能被质量很大但体积很小的核碰撞回来,原子核带正电荷,位于原子的中心。卢瑟福模型(1911年)原子核很小带正电,电子绕原子核运行。
(行星模型)电子在固定的轨道上分层运动。(分层模型) 波尔模型(1913年) 试验中发现,电子出现在不同区域的次数不同,像“云雾”一样。 电子云模型(现代)符号与模型:
1、符号:
在科学的学习和研究中不可避免地要用到许多的符号。如量的符号、单位符号。
2、模型:
什么是模型?使用模型有什么优点?
模型主要是抓住了事物的本质,而去忽略次要因素(或对研究问题影响不大的因素)而建立的。 科学研究和学习总是:
从实践到模型再应用到实践的。
1、1803年,英国科学家道尔顿提出来了原子学说,主要包含三个论点:①原子是微小的实心球体;②原子是不能再分的粒子;③同类原子的各种性质和质量都相同。从现代的观点看,你认为三个论点中,不确切的是( )
A、③ B、①③
C、②③ D、①②③
2、卢瑟福在研究原子结构时做了如下实验:取一极薄的金铂,用带正电的α粒子(氦原子核)射击。发现大多数粒子通过了金箔,极少数α粒子发生偏转或被弹回,根据上述现象有同学得出了以下结论,你认为其中合理的是( )
A、金原子是实心球体,紧密结合排列
B、金原子核不带电
C、金原子质量与α粒子相当
D、相对金原子而言金原子核体积很小
练一练DD3、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的最小粒子可表示为( )
A、 B、
C、 D、C二、构成物质的微粒:
分子、原子、离子。1、分子:
是构成物质并保持物质化学性质的一种微粒。
2、原子:
是化学变化中的最小微粒。
物质一般由分子构成,分子由原子构成,但也有很多物质是直接由原子构成。基础知识a分子是由原子构成的水分子一些物质的分子模型氨气分子 臭氧分子 三氧化硫分子 二氯化甲烷分子 二氧化碳分子 甲醛分子 苯分子 水分子 甲烷分子 C60分子下载http://orgchem.nease.net/index.htm (1) 物质除了可以由分子构成,
还可以由原子直接构成,如金属,碳,硅, (2)由分子构成的物质,是先由原子构成分子,再由分子构成物质,这种不是由原子直接构成的,不能认定其为原子构成的温故知新 下列物质哪些由原子构成,哪些由分子构成,由分子构成的又分别是由什么原子构成该分子的氧气铝水碳氢气铁3、离子:
离子是带电的原子或原子团。是原子在失去(或得到)电子后形成的。
原子失去电子形成带正电的阳离子;原子得到电子形成带负电的阴离子。
与分子、原子一样离子也是构成物质的基本粒子。如氯化钠就是由氯离子和钠离子构成的。
4、微粒的特点:
⑴分子、原子、离子都具有质量和体积很小;
⑵总是作永不停息的无规则运动的;
⑶微粒间有一定的间隔。(间隔的大小决定了物质的状态)基础过关1、俗话说:“酒香不怕巷子深”。这句话体现了分子的哪一特点?_____________________。
2、科学研究证实,物质是由微粒构成的,例如铁是由铁原子构成的。请你填写构成下列物质的具体微粒名称:(1)体温计中的汞是由______构成的;(2)用于人工降雨的干冰是由______构成的;(3)用于配制生理盐水的氯化钠晶体是由______构成的。
3、能保持氧气化学性质的微粒是( )
A、氧离子 B、氧原子
C、氧分子 D、氧元素分子是运动的原子分子离子C能力提高 1、1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是( )
A、化学变化中反应物分子的分解
B、反应中原子的运动
C、化学变中反应物分子的形成
D、原子核的内部结构
2、下列现象或事实说明了分子的哪些性质?
(1)100ml的水和100ml的酒精混合后,体积小于200
ml__________________________。
(2)一滴水中大约有1.67×1021个水分子_________。
(3)水在通电的条件下能分解成氢气和氧气
_____________________________________。D分子间有间隙分子很小在化学反应中分子可分,原子不可分3、美国复威夷联全天文中心的科学家发现了新型氢微粒,这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考。对这种微粒,下列说法中错误的是( )
A、它的组成可以用H3+表示
B、它比1个普通氢分子多1个氢原子核
C、它一定含有3个中子
D、可以推测它的化学性质与H2不同
4、我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦-3,氦-3原子核是由1个中子和2个质子构成的,其原子核外电子数为( )
A、1 B、2
C、3 D、6CB三、纳米材料及其应用前景纳米材料是指晶粒直径为纳米级的(10-9米)的超细材料。它的微粒尺寸大于原子簇,小于通常的微粒,一般为0.1---100nm。2、纳米材料研究及应用前景(1)纳米材料研究是目前材料科学研究的一个热点,纳米技术被公认为21世纪最具有前途的科研领域。 (2)纳米技术在陶瓷领域、生物工程、化工领域、医学、分子组装等方面应用前景广阔。1 、概念基础知识a1、下列关于纳米的叙述错误的是( )
A、纳米是一个长度单位
B、人们在纳米尺度内发现很多新的现象,给技术上带来很多新进展
C、纳米技术是现代科学技术的前沿,我国在这方面的研究具有世界先进水平
D、所有的高科技产品都与纳米技术有关
2.纳米材料颗粒尺寸为l纳米~10纳米 (1纳米=10 - 9 米),其材料能表现出许多特殊的性质。譬如,用铝粉加工成的纳米铝,遇到空气极易爆炸。试写出纳米铝与空气中的氧气混合发生爆炸生成氧化铝(Al2O3)的化学方程式 。D练一练4Al+3O2 == 2Al2O3 归纳小结:分子、原子与离子的比较分子是保持物质化学性质的最小粒子。在化学反应中分裂,重新组成新物质的分子
原子是化学变化中的最小粒子。在化学反应中不可再分,化学反应后没有变成其他原子
离子是化学变化中的最小微粒,在化学变化中通过得失电子转变为原子或组合成新的分子。质量和体积都 非常小,彼此间有间隙,总是在不停地运动,同种分子(或原子、离子)的化学性质相同,不同种分子(或原子、离子)的化学性质各异,都具有种类和数量的含义。
分子分裂成原子,原子组成分子(分子由原子构成),都可以构成物质。离子可以通过得失电子转变为原子或组合成新的分子分子比构成分子本身的原子大,但不能说原子一定比分子小。
再见
1、原子的构成
原子的质量几乎都集中在原子核上。
原子中:核电荷数=质子数=核外电子数
夸克基础知识a由此你能看出原子中的哪些规律?数的启示? 铅笔留下的黑色的笔迹是碳原子的堆积,一个句号竟有1018个碳原子。2、原子的大小:
原子很小:原子的半径一般在10-10米数量级;原子核的半径:10-15 ~10-14米;原子的质量也非常小一个碳原子的质量约为1.993×10-26千克。(1纳米=10-9米)
原子是如此之小,我们是如何了解它的内部结构的呢?
硅原子的电子隧道显微镜图像。3、原子的结构模型的发展史:
认为原子就是一个不可再分的实心圆球。(实心球模型) 道尔顿模型(1803年)汤姆森原子模型(1897年)
原子是一个平均分布着正电荷的球体(似西瓜肉),带负电荷的电子(似西瓜籽)嵌在中间。(西瓜模型) 1909年卢瑟福对这一实验结果的解释是: α粒子可能被质量很大但体积很小的核碰撞回来,原子核带正电荷,位于原子的中心。卢瑟福模型(1911年)原子核很小带正电,电子绕原子核运行。
(行星模型)电子在固定的轨道上分层运动。(分层模型) 波尔模型(1913年) 试验中发现,电子出现在不同区域的次数不同,像“云雾”一样。 电子云模型(现代)符号与模型:
1、符号:
在科学的学习和研究中不可避免地要用到许多的符号。如量的符号、单位符号。
2、模型:
什么是模型?使用模型有什么优点?
模型主要是抓住了事物的本质,而去忽略次要因素(或对研究问题影响不大的因素)而建立的。 科学研究和学习总是:
从实践到模型再应用到实践的。
1、1803年,英国科学家道尔顿提出来了原子学说,主要包含三个论点:①原子是微小的实心球体;②原子是不能再分的粒子;③同类原子的各种性质和质量都相同。从现代的观点看,你认为三个论点中,不确切的是( )
A、③ B、①③
C、②③ D、①②③
2、卢瑟福在研究原子结构时做了如下实验:取一极薄的金铂,用带正电的α粒子(氦原子核)射击。发现大多数粒子通过了金箔,极少数α粒子发生偏转或被弹回,根据上述现象有同学得出了以下结论,你认为其中合理的是( )
A、金原子是实心球体,紧密结合排列
B、金原子核不带电
C、金原子质量与α粒子相当
D、相对金原子而言金原子核体积很小
练一练DD3、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的最小粒子可表示为( )
A、 B、
C、 D、C二、构成物质的微粒:
分子、原子、离子。1、分子:
是构成物质并保持物质化学性质的一种微粒。
2、原子:
是化学变化中的最小微粒。
物质一般由分子构成,分子由原子构成,但也有很多物质是直接由原子构成。基础知识a分子是由原子构成的水分子一些物质的分子模型氨气分子 臭氧分子 三氧化硫分子 二氯化甲烷分子 二氧化碳分子 甲醛分子 苯分子 水分子 甲烷分子 C60分子下载http://orgchem.nease.net/index.htm (1) 物质除了可以由分子构成,
还可以由原子直接构成,如金属,碳,硅, (2)由分子构成的物质,是先由原子构成分子,再由分子构成物质,这种不是由原子直接构成的,不能认定其为原子构成的温故知新 下列物质哪些由原子构成,哪些由分子构成,由分子构成的又分别是由什么原子构成该分子的氧气铝水碳氢气铁3、离子:
离子是带电的原子或原子团。是原子在失去(或得到)电子后形成的。
原子失去电子形成带正电的阳离子;原子得到电子形成带负电的阴离子。
与分子、原子一样离子也是构成物质的基本粒子。如氯化钠就是由氯离子和钠离子构成的。
4、微粒的特点:
⑴分子、原子、离子都具有质量和体积很小;
⑵总是作永不停息的无规则运动的;
⑶微粒间有一定的间隔。(间隔的大小决定了物质的状态)基础过关1、俗话说:“酒香不怕巷子深”。这句话体现了分子的哪一特点?_____________________。
2、科学研究证实,物质是由微粒构成的,例如铁是由铁原子构成的。请你填写构成下列物质的具体微粒名称:(1)体温计中的汞是由______构成的;(2)用于人工降雨的干冰是由______构成的;(3)用于配制生理盐水的氯化钠晶体是由______构成的。
3、能保持氧气化学性质的微粒是( )
A、氧离子 B、氧原子
C、氧分子 D、氧元素分子是运动的原子分子离子C能力提高 1、1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是( )
A、化学变化中反应物分子的分解
B、反应中原子的运动
C、化学变中反应物分子的形成
D、原子核的内部结构
2、下列现象或事实说明了分子的哪些性质?
(1)100ml的水和100ml的酒精混合后,体积小于200
ml__________________________。
(2)一滴水中大约有1.67×1021个水分子_________。
(3)水在通电的条件下能分解成氢气和氧气
_____________________________________。D分子间有间隙分子很小在化学反应中分子可分,原子不可分3、美国复威夷联全天文中心的科学家发现了新型氢微粒,这种氢微粒是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考。对这种微粒,下列说法中错误的是( )
A、它的组成可以用H3+表示
B、它比1个普通氢分子多1个氢原子核
C、它一定含有3个中子
D、可以推测它的化学性质与H2不同
4、我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦-3,氦-3原子核是由1个中子和2个质子构成的,其原子核外电子数为( )
A、1 B、2
C、3 D、6CB三、纳米材料及其应用前景纳米材料是指晶粒直径为纳米级的(10-9米)的超细材料。它的微粒尺寸大于原子簇,小于通常的微粒,一般为0.1---100nm。2、纳米材料研究及应用前景(1)纳米材料研究是目前材料科学研究的一个热点,纳米技术被公认为21世纪最具有前途的科研领域。 (2)纳米技术在陶瓷领域、生物工程、化工领域、医学、分子组装等方面应用前景广阔。1 、概念基础知识a1、下列关于纳米的叙述错误的是( )
A、纳米是一个长度单位
B、人们在纳米尺度内发现很多新的现象,给技术上带来很多新进展
C、纳米技术是现代科学技术的前沿,我国在这方面的研究具有世界先进水平
D、所有的高科技产品都与纳米技术有关
2.纳米材料颗粒尺寸为l纳米~10纳米 (1纳米=10 - 9 米),其材料能表现出许多特殊的性质。譬如,用铝粉加工成的纳米铝,遇到空气极易爆炸。试写出纳米铝与空气中的氧气混合发生爆炸生成氧化铝(Al2O3)的化学方程式 。D练一练4Al+3O2 == 2Al2O3 归纳小结:分子、原子与离子的比较分子是保持物质化学性质的最小粒子。在化学反应中分裂,重新组成新物质的分子
原子是化学变化中的最小粒子。在化学反应中不可再分,化学反应后没有变成其他原子
离子是化学变化中的最小微粒,在化学变化中通过得失电子转变为原子或组合成新的分子。质量和体积都 非常小,彼此间有间隙,总是在不停地运动,同种分子(或原子、离子)的化学性质相同,不同种分子(或原子、离子)的化学性质各异,都具有种类和数量的含义。
分子分裂成原子,原子组成分子(分子由原子构成),都可以构成物质。离子可以通过得失电子转变为原子或组合成新的分子分子比构成分子本身的原子大,但不能说原子一定比分子小。
再见
