中考复习微粒化学式方程[下学期]
图片预览







文档简介
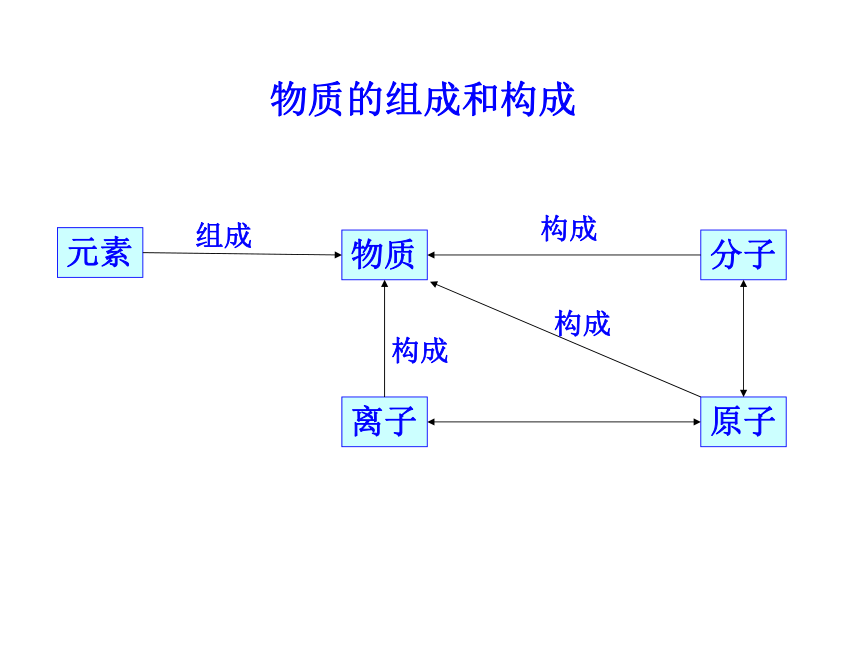
课件46张PPT。物质的组成和构成组成构成构成构成学习目标
原子的概念
原子的结构
相对原子量
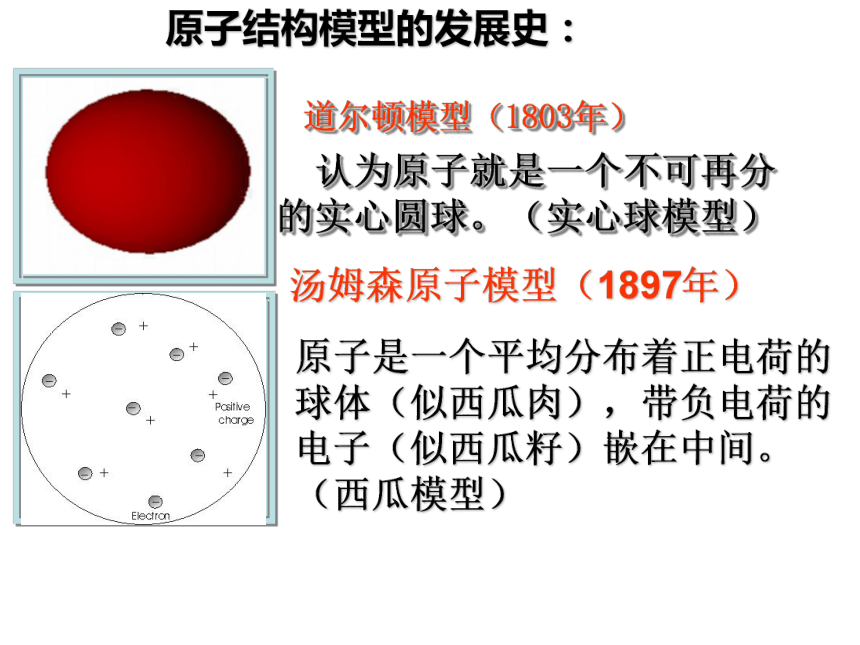
原子模型的发展水通电分解原子原子核核外电子 带负电 1/1840质子 带正电 1中子 不带电 1不显电性原子序数=核电荷数=核内质子数=核外电子数 只有氕原子没有中子.原子的结构夸克构成原子的质量主要集中在原子核上. 原子量≈质子数+中子数电性相对质量以一种碳原子(C-12)质量(1.993*10-26千克)的1/12为标准(1.66* 10-26千克),其他与的质量跟它相比较所得的比.原子量的单位是1.某原子的相 对原子质量=相对原子质量:甲原子与乙原子的质量比为a:b,而乙原子与一个碳原子的质量 比为c:d,则甲的原子量为多少?12ac/bd原子结构模型的发展史: 认为原子就是一个不可再分的实心圆球。(实心球模型) 道尔顿模型(1803年)汤姆森原子模型(1897年)
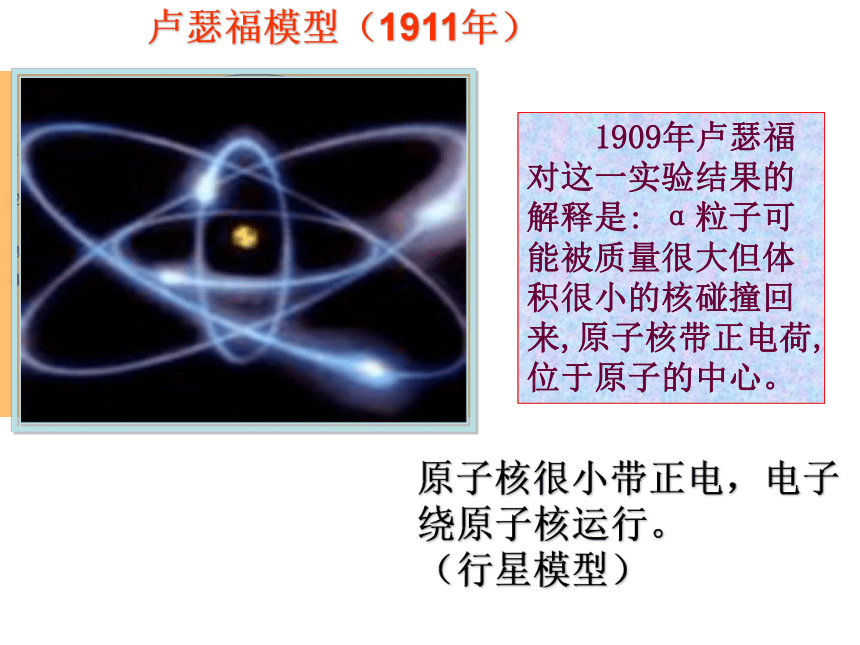
原子是一个平均分布着正电荷的球体(似西瓜肉),带负电荷的电子(似西瓜籽)嵌在中间。(西瓜模型) 1909年卢瑟福对这一实验结果的解释是: α粒子可能被质量很大但体积很小的核碰撞回来,原子核带正电荷,位于原子的中心。卢瑟福模型(1911年)原子核很小带正电,电子绕原子核运行。
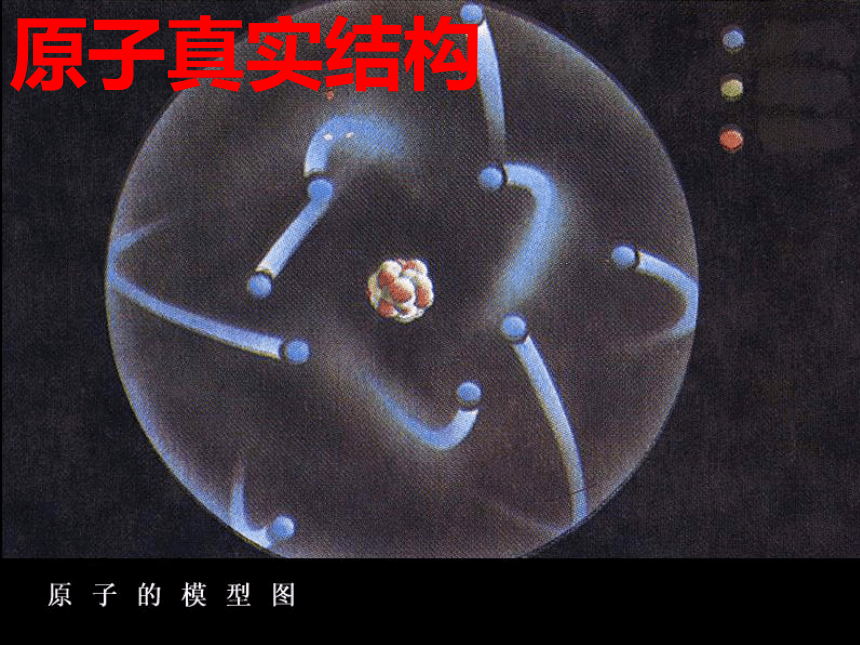
(行星模型)电子在固定的轨道上 分层运动(分层模型) 波尔模型(1913年) 电子出现在不同区 域的机率不同。 电子云模型(现代)原子真实结构分子分子的概念
分子的基本性质
分子量分子的概念分子是构成物质并保持物质化学性质的一种微粒。如水分子构成水这种物质。
液态水、冰、水蒸气都由水分子构成,它们的化学性质相同,但物理性质不同,如密度、比热都不同。
构成物质的微粒还有原子、离子。
对于由分子构成的物质来说,由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物。分子和原子的关系都能构成物质相同点在化学变化中,分子可分,原子不可分不同点联系分子是由原子构成的分子模型 NH3氨气 O3臭氧 SO3三氧化硫 CO2 二氧化碳水分子 甲烷分子 C60分子1 、分子之间有空隙2、分子在不停地作无规则的的运动。3、分子之间存在引力和斥力分子的基本性质混合液的体积 (大于、小于、等于)水和酒精的体积。 说明水分子和酒精分子之间存在着空隙分子之间有空隙小于 现象: A中烧杯的液体变红氨分子不断运动说明:浓氨水酚酞试剂扩散现象表明: 分子在做永不停息的无规则运动 扩散
两种物质互相接触,彼此进入对方的现象。
固体、液体、气体之间都会发生扩散现象。1、概念:离子是带电的原子或原子集团。 带正电的离子叫阳离子, 带负电的离子叫阴离子。
2、有些物质是由离子构成的。如氯化钠。
3、离子与分子或原子的根本区别是离子带电。
离子Na和Cl原子形成NaCl离子也是构成物质的一种微粒失1点击运行
元素元素的概念
元素符号
化学式
化学方程式
元素:具有相同的质子数的同一类原子的总称。
如 S和 S2- 及 S3- 都是硫元素。说明:元素是宏观概念,只能讲种类,不 能讲个数。判断: (1)水是由一个氢元素和一个氧元素组成 (2)水是由氢、氧两种元素的组成一、元素及元素符号 元素的分布(1)宇宙中存在最丰富的元素是氢元素
(2)生物细胞中含量最多的是氧,其次是碳。
(3)地壳中的顺序是氧、硅、铝、铁。
(4)大气中元素的含量由大到小是氮、氧。
(5)海洋中最多的元素是氧、氢。
3、现在科学家已发现一百多种元素,不过初中阶段主要掌握以下二十几种常见元素:外加 锌 铁 锰 铜 汞 银 钡 金 溴 Zn Fe Mn Cu Hg Ag Ba Au Br 氢 氦 H He锂 铍 硼 碳 氮 氧 氟 氖 Li Be B C N O F Ne钠 镁 铝 硅 磷 硫 氯 氬 Na Mg Al Si P S Cl Ar钾 钙 K Ca元素符号元素符号用相应拉丁文的第一个字母大写表示。
如果有两种以上元素的第一外字母相同,则用第二个字母小写来区分。如铜Cu、钙Ca。元素符号的意义表示一种元素
表示这种元素的一个原子
表示相对原子质量
可能表示单质
例:Cu 表示铜元素; 表示一个铜原子 表示铜的原子量64 表示铜这种单质
元素符号周围数字的意义前面的数字表示微粒的个数。
正上方的数字表示化合价。
右上角的数字表示一个离子所带的电荷数。
右下角的数字表示一个分子(或原子团)中某种原子的个数。 例:2H表示2个氢原子; CaO表示氧的化合价为-2; Al3+表示每个铝离子带3个正电荷; H2O表示每个水分子中有两个氢原子。 -2元素的分类金属元素的原子容易失去电子成为阳离子; 非金属元素的原子容易得到电子成为阳离子; 稀有气体元素的原子化学性质稳定,一般不参加反应。物质的分类物质纯净物混合物单质化合物氧化物酸碱盐无机化合物有机化合物氧化物金属氧化物非金属氧化物无机物单质无机化合物合金化学式用元素符号来表示物质化学组成的式子 单质化学式的写法元素符号直接表示元素符号右下角加2如:碘(I2)溴(Br2)惰性气体单质气体金属、碳、硅、磷、硫某些非金属单质固体、液体如:氧气(O2)氢气(H2)如:He,Ne ,Ar (1)原则:
正价元素在前,负价元素在后, 氧元素在最
后,原子个数写在该原子的右下角。
(2)各原子个数的确定方法:
各元素的化合价之和为零
(3)步骤:排序、标价、约简、交叉化合物化学式的写法正一钾钠银和氢 氟氯溴碘皆负一
钙镁钡锌正二价 通常氧为负二价
一二铜汞二三铁 二四六硫二四碳
三铝四硅四七锰 单质化合价为零 正一 NH4
负一 OH NO3
负二 CO3 SO4
负三 PO4 常见元素的化学价常见原子团的化合价注:以元素符号直接表示的化学式,有六种意义:例 .以C例 a .碳元素b .一个碳原子 c.碳的原子量是12
d.炭这种物质e.炭是由碳元素组成的 f.炭是由碳原子构成的 化学式表示的意义,如H2O=2H+S+4O
=2× 1+32× 1+16× 4
=98如H2SO4 相对分子质量式量的计算配平下列化学方程式
⑴ Fe2O3 + CO= Fe + CO2
⑵ Al + CuSO4= Al2(SO4)3 + Cu
⑶ C2H2 + O2= H2O + CO212331323化学方程式化学方程式表示的意义:分子个数比 2 2 1
质量比 36 4 32 个数比 2 1 1 1
质量比316 197 87 322H2O == 2H2 + O2[例15]下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是
A.N2 B.Mg C.2O2 D.H
[例16]下列几个化学方程式完全正确的是
A.C+CuO==Cu+CO2↑
B.2KMnO4==K2MnO4+MnO2+O2↑
C.2Fe+6HCl==2FeCl3+3H2↑
D.Mg+H2SO4==MgSO4+ H2↑
[例17]下列电离方程式正确的是
A.Ba(OH)2==Ba2++(OH)2- B.Na2SO4==Na++SO42-
C.Na2CO3==Na++CO32- D.Ca(NO3)2==Ca2++2NO3- 例14 下图中, 表示某种原子,表示另一种原子。下列反应中,能用该图表示其反应实质的是
A.H2+Cl2==2HCl
B.N2+3H2==2NH3
C.2CO+O2==2CO2 D.2H2+O2==2H2O[例15]下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是
A.N2 B.Mg C.2O2 D.H
[例16]下列几个化学方程式完全正确的是
A.C+CuO==Cu+CO2↑
B.2KMnO4==K2MnO4+MnO2+O2↑
C.2Fe+6HCl==2FeCl3+3H2↑
D.Mg+H2SO4==MgSO4+ H2↑
[例17]下列电离方程式正确的是
A.Ba(OH)2==Ba2++(OH)2- B.Na2SO4==Na++SO42-
C.Na2CO3==Na++CO32- D.Ca(NO3)2==Ca2++2NO3- [例20]药品说明书中标明:本品含碘15mg、镁65mg、铜2mg、锌1.5mg、锰1mg。这里标明的各种成分是指
A.分子 B.原子 C.元素 D.单质
[例21]医药上的阿司匹林的式量为180,其中含4.5%的氢、35.5%氧、60%碳(以上均为质量分数),则阿司匹林的化学式是 (从左到右按C、H、O顺序)。 [例22] 有化学反应A+2B=C+2D,假设反应前A的质量为12g,B的质量为8g,反应生成10gC。其中A物质全部反应,B物质尚有2g未参加反应,则反应生成D的质量是多少?
[思考题]将上例中的求解改为:求反应中生成物C、D的质量比和生成物C与D的相对分子质量之比,如何思考?
[例23]某化合物(用X表示其化学式)燃烧时发出的反应为X+3O2=2CO2+3H2O,试判断X的化学式是
A.C2H6 B.C2H6O C.C2H4 D.C2H4O1、1803年,英国科学家道尔顿提出来了原子学说,主要包含三个论点:①原子是微小的实心球体;②原子是不能再分的粒子;③同类原子的各种性质和质量都相同。从现代的观点看,你认为三个论点中,不确切的是( )
A、③ B、①③
C、②③ D、①②③
2、卢瑟福在研究原子结构时做了如下实验:取一极薄的金铂,用带正电的α粒子(氦原子核)射击。发现大多数粒子通过了金箔,极少数α粒子发生偏转或被弹回,根据上述现象有同学得出了以下结论,你认为其中合理的是( )
A、金原子是实心球体,紧密结合排列
B、金原子核不带电
C、金原子质量与α粒子相当
D、相对金原子而言金原子核体积很小
DD3、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的最小粒子可表示为( )
A、 B、
C、 D、C
原子的概念
原子的结构
相对原子量
原子模型的发展水通电分解原子原子核核外电子 带负电 1/1840质子 带正电 1中子 不带电 1不显电性原子序数=核电荷数=核内质子数=核外电子数 只有氕原子没有中子.原子的结构夸克构成原子的质量主要集中在原子核上. 原子量≈质子数+中子数电性相对质量以一种碳原子(C-12)质量(1.993*10-26千克)的1/12为标准(1.66* 10-26千克),其他与的质量跟它相比较所得的比.原子量的单位是1.某原子的相 对原子质量=相对原子质量:甲原子与乙原子的质量比为a:b,而乙原子与一个碳原子的质量 比为c:d,则甲的原子量为多少?12ac/bd原子结构模型的发展史: 认为原子就是一个不可再分的实心圆球。(实心球模型) 道尔顿模型(1803年)汤姆森原子模型(1897年)
原子是一个平均分布着正电荷的球体(似西瓜肉),带负电荷的电子(似西瓜籽)嵌在中间。(西瓜模型) 1909年卢瑟福对这一实验结果的解释是: α粒子可能被质量很大但体积很小的核碰撞回来,原子核带正电荷,位于原子的中心。卢瑟福模型(1911年)原子核很小带正电,电子绕原子核运行。
(行星模型)电子在固定的轨道上 分层运动(分层模型) 波尔模型(1913年) 电子出现在不同区 域的机率不同。 电子云模型(现代)原子真实结构分子分子的概念
分子的基本性质
分子量分子的概念分子是构成物质并保持物质化学性质的一种微粒。如水分子构成水这种物质。
液态水、冰、水蒸气都由水分子构成,它们的化学性质相同,但物理性质不同,如密度、比热都不同。
构成物质的微粒还有原子、离子。
对于由分子构成的物质来说,由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物。分子和原子的关系都能构成物质相同点在化学变化中,分子可分,原子不可分不同点联系分子是由原子构成的分子模型 NH3氨气 O3臭氧 SO3三氧化硫 CO2 二氧化碳水分子 甲烷分子 C60分子1 、分子之间有空隙2、分子在不停地作无规则的的运动。3、分子之间存在引力和斥力分子的基本性质混合液的体积 (大于、小于、等于)水和酒精的体积。 说明水分子和酒精分子之间存在着空隙分子之间有空隙小于 现象: A中烧杯的液体变红氨分子不断运动说明:浓氨水酚酞试剂扩散现象表明: 分子在做永不停息的无规则运动 扩散
两种物质互相接触,彼此进入对方的现象。
固体、液体、气体之间都会发生扩散现象。1、概念:离子是带电的原子或原子集团。 带正电的离子叫阳离子, 带负电的离子叫阴离子。
2、有些物质是由离子构成的。如氯化钠。
3、离子与分子或原子的根本区别是离子带电。
离子Na和Cl原子形成NaCl离子也是构成物质的一种微粒失1点击运行
元素元素的概念
元素符号
化学式
化学方程式
元素:具有相同的质子数的同一类原子的总称。
如 S和 S2- 及 S3- 都是硫元素。说明:元素是宏观概念,只能讲种类,不 能讲个数。判断: (1)水是由一个氢元素和一个氧元素组成 (2)水是由氢、氧两种元素的组成一、元素及元素符号 元素的分布(1)宇宙中存在最丰富的元素是氢元素
(2)生物细胞中含量最多的是氧,其次是碳。
(3)地壳中的顺序是氧、硅、铝、铁。
(4)大气中元素的含量由大到小是氮、氧。
(5)海洋中最多的元素是氧、氢。
3、现在科学家已发现一百多种元素,不过初中阶段主要掌握以下二十几种常见元素:外加 锌 铁 锰 铜 汞 银 钡 金 溴 Zn Fe Mn Cu Hg Ag Ba Au Br 氢 氦 H He锂 铍 硼 碳 氮 氧 氟 氖 Li Be B C N O F Ne钠 镁 铝 硅 磷 硫 氯 氬 Na Mg Al Si P S Cl Ar钾 钙 K Ca元素符号元素符号用相应拉丁文的第一个字母大写表示。
如果有两种以上元素的第一外字母相同,则用第二个字母小写来区分。如铜Cu、钙Ca。元素符号的意义表示一种元素
表示这种元素的一个原子
表示相对原子质量
可能表示单质
例:Cu 表示铜元素; 表示一个铜原子 表示铜的原子量64 表示铜这种单质
元素符号周围数字的意义前面的数字表示微粒的个数。
正上方的数字表示化合价。
右上角的数字表示一个离子所带的电荷数。
右下角的数字表示一个分子(或原子团)中某种原子的个数。 例:2H表示2个氢原子; CaO表示氧的化合价为-2; Al3+表示每个铝离子带3个正电荷; H2O表示每个水分子中有两个氢原子。 -2元素的分类金属元素的原子容易失去电子成为阳离子; 非金属元素的原子容易得到电子成为阳离子; 稀有气体元素的原子化学性质稳定,一般不参加反应。物质的分类物质纯净物混合物单质化合物氧化物酸碱盐无机化合物有机化合物氧化物金属氧化物非金属氧化物无机物单质无机化合物合金化学式用元素符号来表示物质化学组成的式子 单质化学式的写法元素符号直接表示元素符号右下角加2如:碘(I2)溴(Br2)惰性气体单质气体金属、碳、硅、磷、硫某些非金属单质固体、液体如:氧气(O2)氢气(H2)如:He,Ne ,Ar (1)原则:
正价元素在前,负价元素在后, 氧元素在最
后,原子个数写在该原子的右下角。
(2)各原子个数的确定方法:
各元素的化合价之和为零
(3)步骤:排序、标价、约简、交叉化合物化学式的写法正一钾钠银和氢 氟氯溴碘皆负一
钙镁钡锌正二价 通常氧为负二价
一二铜汞二三铁 二四六硫二四碳
三铝四硅四七锰 单质化合价为零 正一 NH4
负一 OH NO3
负二 CO3 SO4
负三 PO4 常见元素的化学价常见原子团的化合价注:以元素符号直接表示的化学式,有六种意义:例 .以C例 a .碳元素b .一个碳原子 c.碳的原子量是12
d.炭这种物质e.炭是由碳元素组成的 f.炭是由碳原子构成的 化学式表示的意义,如H2O=2H+S+4O
=2× 1+32× 1+16× 4
=98如H2SO4 相对分子质量式量的计算配平下列化学方程式
⑴ Fe2O3 + CO= Fe + CO2
⑵ Al + CuSO4= Al2(SO4)3 + Cu
⑶ C2H2 + O2= H2O + CO212331323化学方程式化学方程式表示的意义:分子个数比 2 2 1
质量比 36 4 32 个数比 2 1 1 1
质量比316 197 87 322H2O == 2H2 + O2[例15]下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是
A.N2 B.Mg C.2O2 D.H
[例16]下列几个化学方程式完全正确的是
A.C+CuO==Cu+CO2↑
B.2KMnO4==K2MnO4+MnO2+O2↑
C.2Fe+6HCl==2FeCl3+3H2↑
D.Mg+H2SO4==MgSO4+ H2↑
[例17]下列电离方程式正确的是
A.Ba(OH)2==Ba2++(OH)2- B.Na2SO4==Na++SO42-
C.Na2CO3==Na++CO32- D.Ca(NO3)2==Ca2++2NO3- 例14 下图中, 表示某种原子,表示另一种原子。下列反应中,能用该图表示其反应实质的是
A.H2+Cl2==2HCl
B.N2+3H2==2NH3
C.2CO+O2==2CO2 D.2H2+O2==2H2O[例15]下列化学用语中,既可以表示元素,又可以表示这种元素的一个原子,还可以表示由这种元素组成的单质的是
A.N2 B.Mg C.2O2 D.H
[例16]下列几个化学方程式完全正确的是
A.C+CuO==Cu+CO2↑
B.2KMnO4==K2MnO4+MnO2+O2↑
C.2Fe+6HCl==2FeCl3+3H2↑
D.Mg+H2SO4==MgSO4+ H2↑
[例17]下列电离方程式正确的是
A.Ba(OH)2==Ba2++(OH)2- B.Na2SO4==Na++SO42-
C.Na2CO3==Na++CO32- D.Ca(NO3)2==Ca2++2NO3- [例20]药品说明书中标明:本品含碘15mg、镁65mg、铜2mg、锌1.5mg、锰1mg。这里标明的各种成分是指
A.分子 B.原子 C.元素 D.单质
[例21]医药上的阿司匹林的式量为180,其中含4.5%的氢、35.5%氧、60%碳(以上均为质量分数),则阿司匹林的化学式是 (从左到右按C、H、O顺序)。 [例22] 有化学反应A+2B=C+2D,假设反应前A的质量为12g,B的质量为8g,反应生成10gC。其中A物质全部反应,B物质尚有2g未参加反应,则反应生成D的质量是多少?
[思考题]将上例中的求解改为:求反应中生成物C、D的质量比和生成物C与D的相对分子质量之比,如何思考?
[例23]某化合物(用X表示其化学式)燃烧时发出的反应为X+3O2=2CO2+3H2O,试判断X的化学式是
A.C2H6 B.C2H6O C.C2H4 D.C2H4O1、1803年,英国科学家道尔顿提出来了原子学说,主要包含三个论点:①原子是微小的实心球体;②原子是不能再分的粒子;③同类原子的各种性质和质量都相同。从现代的观点看,你认为三个论点中,不确切的是( )
A、③ B、①③
C、②③ D、①②③
2、卢瑟福在研究原子结构时做了如下实验:取一极薄的金铂,用带正电的α粒子(氦原子核)射击。发现大多数粒子通过了金箔,极少数α粒子发生偏转或被弹回,根据上述现象有同学得出了以下结论,你认为其中合理的是( )
A、金原子是实心球体,紧密结合排列
B、金原子核不带电
C、金原子质量与α粒子相当
D、相对金原子而言金原子核体积很小
DD3、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的最小粒子可表示为( )
A、 B、
C、 D、C
