中考复习第二讲水和溶液[下学期]
图片预览









文档简介
课件30张PPT。第二讲 水6.饱和溶液和不饱和溶液、溶解度、溶解度
表 (1)说出溶液的组成,辨认溶质和溶剂
(2)说出饱和溶液的概念
(3)知道浓溶液、稀溶液、饱和溶液、不饱和溶
液的联系、区别和转化
(4)列举影响物质溶解性的一些因素
(5)描述物质的溶解度的含义
(6)会查看溶解度表和简单的固体溶解度曲线图 考试细则:7.外界条件对物质性质的影响 了解温度对物质的溶解性的影响 1.水的组成和主要性质、水对生命体和经济
发展的影响、水及其他常见的溶剂 (1)说出水电解后的产物
(2)描述水的组成
(3)知道水的主要物理性质和化学性质
(4)举例说明水对生命体的影响
(5)举例说明水对经济发展的影响
(6)说出水是良好的溶剂,并能列举其他常见的
溶剂 (二)水2.悬浊液、溶液和乳浊液(1)辨认溶液、悬浊液和乳浊液
(2)说出溶液的特点
(3)列举一些常见的悬浊液和乳浊液 3.溶液的溶质质量分数、配制一定溶质质量分数的溶液(1)说明溶液中溶质质量分数的意义
(2)用公式进行溶质质量分数的简单计算
(3)说出配制一定溶质质量分数的溶液的一般 步骤与操作方法
(4)按要求配制溶液,说明有关配制方案 4.水资源和水污染 (1)描述地球上水体的名称及大致比例
(2)描述我国的水资源概况
(3)说明常见水污染的种类、原因及危害
(4)列举水污染的防治措施
(5)说出水的一些净化方法——蒸馏、活
性炭、明矾的净水作用
(6)体会水是生命之源的观点,说出一些
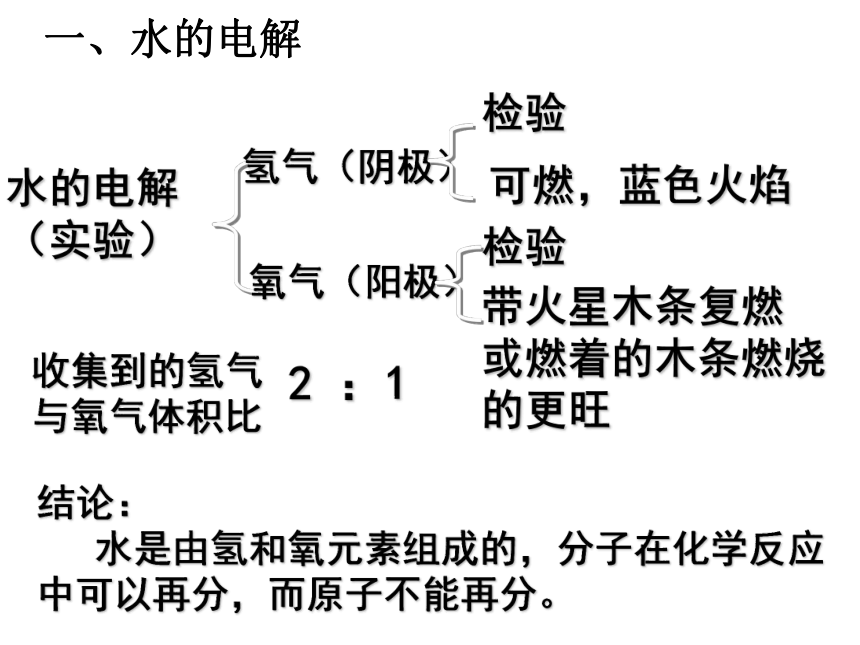
水中矿物质对健康的影响 氢气(阴极)氧气(阳极)检验检验可燃,蓝色火焰带火星木条复燃
或燃着的木条燃烧的更旺水的电解
(实验)收集到的氢气与氧气体积比2 :1结论:
水是由氢和氧元素组成的,分子在化学反应
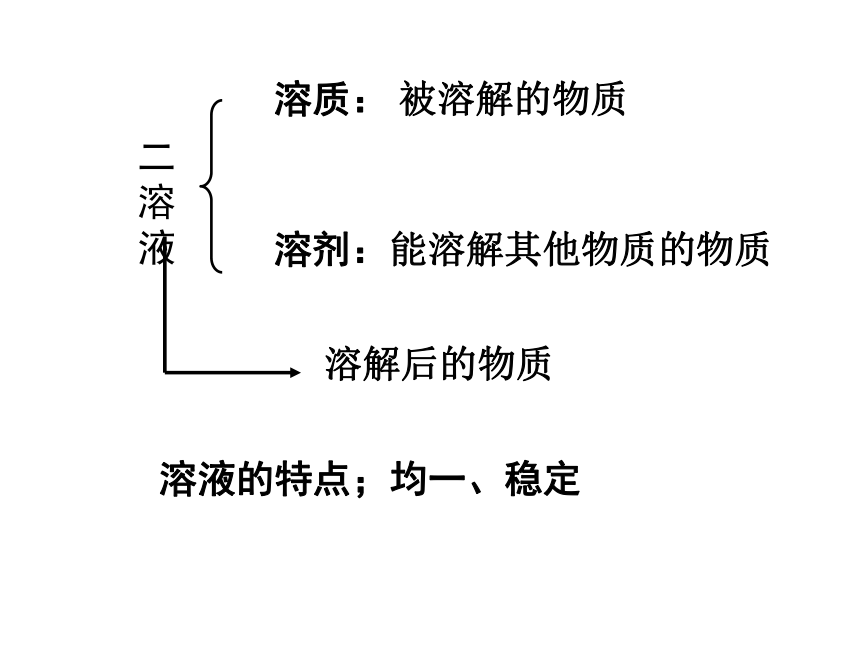
中可以再分,而原子不能再分。一、水的电解二溶液溶质: 被溶解的物质溶剂:能溶解其他物质的物质溶液的特点;均一、稳定溶解后的物质注意:a、溶液不一定无色,
如CuSO4 蓝色
FeSO4 浅绿色
Fe2(SO4)3 黄色
b、溶质可以是固体、液体或气体;
水是最常用的溶剂
c、溶液的质量 = 溶质的质量 + 溶剂的质量
溶液的体积 ≠ 溶质的体积 + 溶剂的体积
d、溶液的名称:溶质的溶剂溶液
(如:碘酒——碘的酒精溶液)
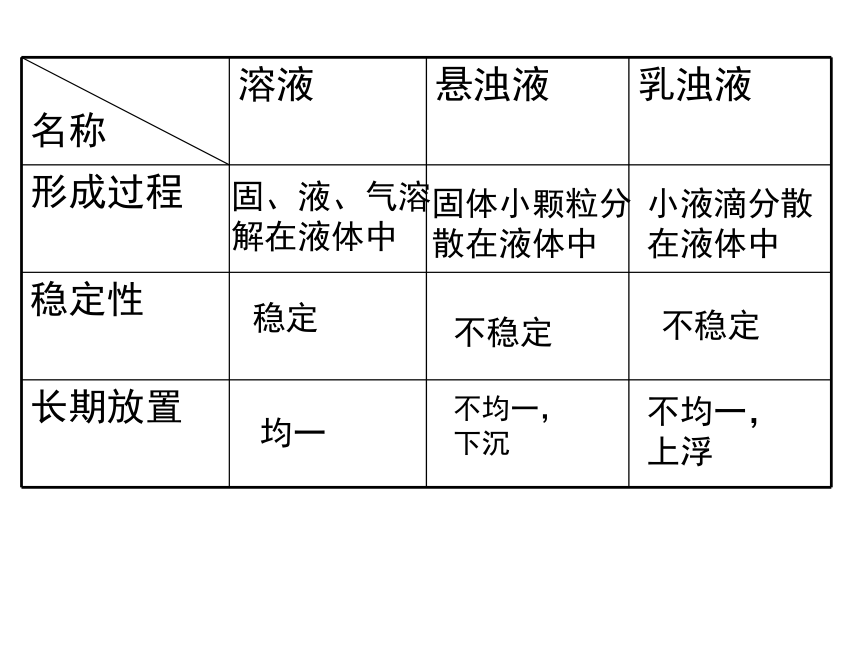
悬浊液:
浊液浊液的特点:不均一、不稳定固体小颗粒悬浮在液体里
而形成的混合物。小液滴分散在液体里形成的混
合物乳浊液:固、液、气溶解在液体中固体小颗粒分散在液体中小液滴分散在液体中稳定不稳定不稳定均一不均一,下沉不均一,上浮三、饱和溶液和不饱和溶液:在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液,叫做饱和溶液; 还能继续溶解某种溶质的溶液,叫做不饱和溶液。1、概念:四、饱和溶液和不饱和溶液的相互转化:对大多数溶液来说:饱和溶液不饱和溶液升温或增加溶剂降温.减少溶剂.加溶质对少数溶液来说:饱和石灰水不饱和石灰水降温.加溶剂升温.减少溶剂.加溶质浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液
(如饱和的石灰水溶液就是稀溶液)
③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓
二、溶解度(通常用 S 表示)1、定义: 在一定温度下,某物质在100克溶剂中达到饱和状态时所溶解的溶质质量,叫做这种物质在这种溶剂里的溶解度。一定温度100克溶剂(一般指水)饱和状态质量(克)固体溶解度的四要素:例:蔗糖在20℃时的溶解度是203.9g。含义是?在20℃时,100g水中最多可溶解203.9g蔗糖。在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。 3.影响固体溶解度的因素
①溶质、溶剂的性质(种类)
②温度:
少数固体物质的溶解度受温度的影响很
小;如NaCl
极少数物质溶解度随温度升高而降低。
如Ca(OH)2
大多数固体物的溶解度随温度升高而升高;
如KNO3
t 2 时,C 物质溶解度为m克
Bt 1 时,Q 点A、B、C三者的溶解度相等
A、B、C
曲线的意义1. 曲线上的点表示某温度下某溶质的溶解度
2. 曲线的交点,表示在该温度下物质的溶解度相等 3. 倾斜程度表示物质的溶解度受温度变化影响的大小
4. 比较某一温度下各种物质溶解度的大小
一、溶质的质量分数(a%)溶质的质量分数定义式:定义:溶质的质量与溶液的质量之比。说明:没有单位,是一个比值;常用百分数表示
㈢溶液稀释或浓缩的计算原理:溶液稀释前后,溶质的质量不变
m质浓 = m质稀 即 m液浓 A浓% = m液稀 A稀%例3 把50g 98%的浓硫酸稀释成20%的硫酸,需要水多少毫升?浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数m水=稀溶液的质量--浓溶液的质量 20℃时,食盐的溶解度为36克,
计算此温度下饱和食盐水的食盐的质量分数?二、溶液中溶质的质量分数计算 =26.5%㈠计算配制溶液所需溶质和溶剂的质量 例2:配制溶质的质量分数为10%的氯化钠溶液50克,问需要氯化钠多少克?水多少克?配制过程:A、计算 B、称量 C、溶解 解:
溶质=50克×10%=5克
水的质量=50克-5克=45克方法2:适用于所有的饱和溶液适用于溶解度随温度的升高而增大的饱和溶液方法1:蒸发溶剂二、? 晶体的形成 冷却热饱和溶液我国水资源分布特点 1、 夏秋季丰富,冬春季短缺,且降水年际变化很大。东南部多,西北部少。 2、我国人均水资源是世界水平的1/4。是世界的缺水国家之一。 A、沉淀法B、过滤法C、蒸馏法四、水的净化 过滤法的要求“一贴、二低、三靠” 一贴滤纸要紧贴漏斗内壁 二低滤纸边缘低于漏斗边缘漏斗里液面必须低于滤纸边缘。三靠倾倒液体时,烧杯靠着玻璃棒玻璃棒末端轻轻靠在三层滤纸一端 漏斗紧靠接收液体的容器内壁 加热,蒸馏、冷凝分离或提纯液态混合物液体的沸点不同溶解,过滤悬浊液物质的溶解性不同加入明矾等凝聚剂,搅拌后静置悬浊液物质溶解性不同除去水中已溶解的物质(直接饮用)除去水中的悬浮微粒悬浮微粒凝聚而沉淀操作返回操作返回返回蒸馏
表 (1)说出溶液的组成,辨认溶质和溶剂
(2)说出饱和溶液的概念
(3)知道浓溶液、稀溶液、饱和溶液、不饱和溶
液的联系、区别和转化
(4)列举影响物质溶解性的一些因素
(5)描述物质的溶解度的含义
(6)会查看溶解度表和简单的固体溶解度曲线图 考试细则:7.外界条件对物质性质的影响 了解温度对物质的溶解性的影响 1.水的组成和主要性质、水对生命体和经济
发展的影响、水及其他常见的溶剂 (1)说出水电解后的产物
(2)描述水的组成
(3)知道水的主要物理性质和化学性质
(4)举例说明水对生命体的影响
(5)举例说明水对经济发展的影响
(6)说出水是良好的溶剂,并能列举其他常见的
溶剂 (二)水2.悬浊液、溶液和乳浊液(1)辨认溶液、悬浊液和乳浊液
(2)说出溶液的特点
(3)列举一些常见的悬浊液和乳浊液 3.溶液的溶质质量分数、配制一定溶质质量分数的溶液(1)说明溶液中溶质质量分数的意义
(2)用公式进行溶质质量分数的简单计算
(3)说出配制一定溶质质量分数的溶液的一般 步骤与操作方法
(4)按要求配制溶液,说明有关配制方案 4.水资源和水污染 (1)描述地球上水体的名称及大致比例
(2)描述我国的水资源概况
(3)说明常见水污染的种类、原因及危害
(4)列举水污染的防治措施
(5)说出水的一些净化方法——蒸馏、活
性炭、明矾的净水作用
(6)体会水是生命之源的观点,说出一些
水中矿物质对健康的影响 氢气(阴极)氧气(阳极)检验检验可燃,蓝色火焰带火星木条复燃
或燃着的木条燃烧的更旺水的电解
(实验)收集到的氢气与氧气体积比2 :1结论:
水是由氢和氧元素组成的,分子在化学反应
中可以再分,而原子不能再分。一、水的电解二溶液溶质: 被溶解的物质溶剂:能溶解其他物质的物质溶液的特点;均一、稳定溶解后的物质注意:a、溶液不一定无色,
如CuSO4 蓝色
FeSO4 浅绿色
Fe2(SO4)3 黄色
b、溶质可以是固体、液体或气体;
水是最常用的溶剂
c、溶液的质量 = 溶质的质量 + 溶剂的质量
溶液的体积 ≠ 溶质的体积 + 溶剂的体积
d、溶液的名称:溶质的溶剂溶液
(如:碘酒——碘的酒精溶液)
悬浊液:
浊液浊液的特点:不均一、不稳定固体小颗粒悬浮在液体里
而形成的混合物。小液滴分散在液体里形成的混
合物乳浊液:固、液、气溶解在液体中固体小颗粒分散在液体中小液滴分散在液体中稳定不稳定不稳定均一不均一,下沉不均一,上浮三、饱和溶液和不饱和溶液:在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液,叫做饱和溶液; 还能继续溶解某种溶质的溶液,叫做不饱和溶液。1、概念:四、饱和溶液和不饱和溶液的相互转化:对大多数溶液来说:饱和溶液不饱和溶液升温或增加溶剂降温.减少溶剂.加溶质对少数溶液来说:饱和石灰水不饱和石灰水降温.加溶剂升温.减少溶剂.加溶质浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液
(如饱和的石灰水溶液就是稀溶液)
③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓
二、溶解度(通常用 S 表示)1、定义: 在一定温度下,某物质在100克溶剂中达到饱和状态时所溶解的溶质质量,叫做这种物质在这种溶剂里的溶解度。一定温度100克溶剂(一般指水)饱和状态质量(克)固体溶解度的四要素:例:蔗糖在20℃时的溶解度是203.9g。含义是?在20℃时,100g水中最多可溶解203.9g蔗糖。在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱和。 3.影响固体溶解度的因素
①溶质、溶剂的性质(种类)
②温度:
少数固体物质的溶解度受温度的影响很
小;如NaCl
极少数物质溶解度随温度升高而降低。
如Ca(OH)2
大多数固体物的溶解度随温度升高而升高;
如KNO3
t 2 时,C 物质溶解度为m克
Bt 1 时,Q 点A、B、C三者的溶解度相等
A、B、C
曲线的意义1. 曲线上的点表示某温度下某溶质的溶解度
2. 曲线的交点,表示在该温度下物质的溶解度相等 3. 倾斜程度表示物质的溶解度受温度变化影响的大小
4. 比较某一温度下各种物质溶解度的大小
一、溶质的质量分数(a%)溶质的质量分数定义式:定义:溶质的质量与溶液的质量之比。说明:没有单位,是一个比值;常用百分数表示
㈢溶液稀释或浓缩的计算原理:溶液稀释前后,溶质的质量不变
m质浓 = m质稀 即 m液浓 A浓% = m液稀 A稀%例3 把50g 98%的浓硫酸稀释成20%的硫酸,需要水多少毫升?浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数m水=稀溶液的质量--浓溶液的质量 20℃时,食盐的溶解度为36克,
计算此温度下饱和食盐水的食盐的质量分数?二、溶液中溶质的质量分数计算 =26.5%㈠计算配制溶液所需溶质和溶剂的质量 例2:配制溶质的质量分数为10%的氯化钠溶液50克,问需要氯化钠多少克?水多少克?配制过程:A、计算 B、称量 C、溶解 解:
溶质=50克×10%=5克
水的质量=50克-5克=45克方法2:适用于所有的饱和溶液适用于溶解度随温度的升高而增大的饱和溶液方法1:蒸发溶剂二、? 晶体的形成 冷却热饱和溶液我国水资源分布特点 1、 夏秋季丰富,冬春季短缺,且降水年际变化很大。东南部多,西北部少。 2、我国人均水资源是世界水平的1/4。是世界的缺水国家之一。 A、沉淀法B、过滤法C、蒸馏法四、水的净化 过滤法的要求“一贴、二低、三靠” 一贴滤纸要紧贴漏斗内壁 二低滤纸边缘低于漏斗边缘漏斗里液面必须低于滤纸边缘。三靠倾倒液体时,烧杯靠着玻璃棒玻璃棒末端轻轻靠在三层滤纸一端 漏斗紧靠接收液体的容器内壁 加热,蒸馏、冷凝分离或提纯液态混合物液体的沸点不同溶解,过滤悬浊液物质的溶解性不同加入明矾等凝聚剂,搅拌后静置悬浊液物质溶解性不同除去水中已溶解的物质(直接饮用)除去水中的悬浮微粒悬浮微粒凝聚而沉淀操作返回操作返回返回蒸馏
