★中考总复习--物质科学常见的化合物07.3.10[上下学期通用]
文档属性
| 名称 | ★中考总复习--物质科学常见的化合物07.3.10[上下学期通用] |

|
|
| 格式 | rar | ||
| 文件大小 | 148.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2007-03-22 00:00:00 | ||
图片预览











文档简介
课件64张PPT。科学中考总复习常见的化合物温州二中廖继聪单质和化合物【中考要求】【导学体系】一.单质和化合物的概念
单质:由同种元素组成的纯净物,如H2、O2、I2、臭氧O3、金刚石C。
化合物:由不同种元素组成的纯净物,如NaCl、CaCO3、CuSO4
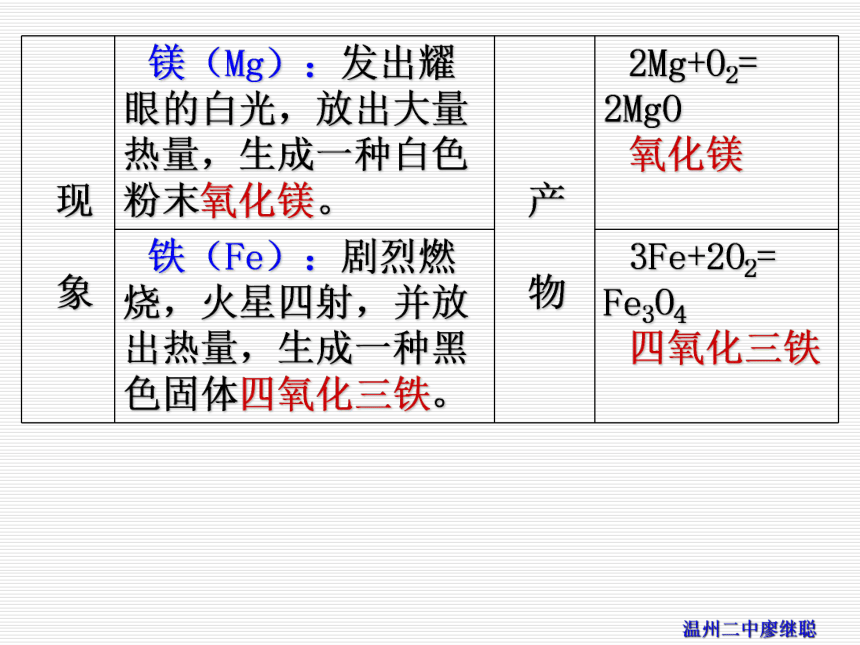
二.典型金属与非金属在空气(氧气)中燃烧的现象及产物。
1.金属与氧气反应2.非金属与氧气反应【考点导学】例1:下列实验现象的描述,错误的是( )
A.木炭在氧气里燃烧比在空气里燃烧得更旺,发出白光,并放出热量
B.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
C.红磷在氧气中燃烧,产生大量白雾
D.镁条在空气中燃烧,发出耀眼白光,生成白色粉末
C例2:如图,根据这个实验的现象,可以得到有关二氧化碳的性质的是 ( )
A.密度比空气大
B.不支持燃烧
C.不能燃烧
D.以上答案都对D【达标训练】1.下列各选项中,属于化合物的是 ( )
A.干冰 B.金刚石
C.液氧 D.碘酒A2.下列有关实验现象的描述,错误的是 ( )
A.细铁丝在氧气中能剧烈燃烧,火星四射
B.镁带在空气中燃烧会生成一种白色固态物质氧化镁
C.把燃着的火柴放在集满CO2的瓶口,火焰熄灭
D.硫粉在氧气中燃烧会发出明亮的黄色火焰D3.下列物质属于氧化物的是 ( )
A.高锰酸钾 B.氧气
C.双氧水 D.盐水
4.有些非金属氧化物可与水反应生成酸,比如CO2+H2O==H2CO3;同样也有些金属氧化物可与水反应生成碱。下列各氧化物中,不能与水直接发生反应生成相应的酸或碱的是 ( )
A.氧化钠 B.氧化钙
C.二氧化硅 D.二氧化碳CC5.要除去CO2气体中混有的少量CO,应采用的方法是 ( )
A.将混合气体通过澄清石灰水 B.将混合气体通过灼热的氧化铜
C.将混合气体通过灼热的木炭 D.将混合气体点燃
6.合金是一种 ( )
A.单质 B.化合物
C.混合物 D.金属氧化物CB7.下列反应的产物不会污染空气的是 ( )
A.硫在空气中燃烧
B.氢气在空气中燃烧
C.煤的燃烧
D.在影院等公共场所大量吸烟B8.如下图所示,甲、乙两个集气瓶中的燃烧匙内分别盛有适量的红磷和硫粉,已知甲、乙两个集气
瓶的体积相等,
内部充满空气,
当红磷和硫粉完
全燃烧并冷却至室温,再同时打开两边的活塞,可以看到的现象是( )
A.水由导管同时进入甲、乙两个集气瓶中 B.甲、乙两个集气瓶看不出变化 C.水从导管进入甲瓶、乙瓶中几乎无变化 D.水从导管进乙入瓶、甲瓶中无变化C9.已知铁丝在氧气中可以发生的反应是:铁+氧气点燃四氧化三铁,试回答:
⑴判断铁丝在氧气中燃烧是化学变化的根本依据是 ( )
A.反应中火星四射 B.有燃烧现象发生
C.有大量的热产生
D.有与铁完全不同的黑色固体生成
⑵在“氧气的制取和性质”实验中,有同学取一段纱窗上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验。结果没有观察到“火星四射”的现象,请分析实验失败的原因可能是 。D铁丝表面已被氧化生成氧化铁10.酸雨是指pH低于5.6的大气降水,目前我国有20多个省、市、自治区出现程度不同的酸雨,目前酸雨已成为我国严重的区域性环境问题。通常形成酸雨的物质是含硫或含氮的氧化物,其中燃烧化石燃料(石油、天然气、煤炭)产生的硫、氮氧化物是造成酸雨的主要原因。但有些植物如广玉兰、枫树、夹竹桃等,在它们能忍受的浓度下,可以吸收这种有害气体。
⑴你认为该种含硫氧化物的有害气体是 。
⑵请写出酸雨形成的原因(用化学方程式表示)
。SO2 + H2O = H2SO3二氧化硫11.一氧化氮是大气的主要污染物之一。近几年来又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4X+5O2==4NO+6H20,根据质量守恒定律可以推出X的化学式为 。汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理方法是在尾气的排气管上装一个催化转化器,在催化剂的作用下,一氧化氮和一氧化碳可生成二氧化碳和氮气,该反应的化学方程式为 。2NO+2CO=N2+2CO2NH3重要的盐【中考要求】【导学体系】1、常见盐的性质与用途食盐(NaCl)性质:主要来自海水,能与硝酸银溶液反应,生成白色不溶于稀硝酸的沉淀AgCl用途:是人类不可缺少的食物,也是重要的化工原料。0.9%的氯化钠溶液即生理盐水用于医学上纯碱(Na2CO3)性质:又称苏打,水溶液呈碱性用途:重要的化工工业原材料之一,广泛地应用于玻璃、化工工业。碳酸钙(CaCO3)性质:一种难溶的盐,是碳酸和氢氧化钙中和反应的产物,能与酸反应生成二氧化碳。用途:重要的建筑材料,也可用于造纸、塑料、人造橡胶、食品、等领域。2、碳酸根离子的鉴别:
CaCO3与HCl反应生成CO2这一反应不但可以制备CO2,还可以用来鉴别CO32-的存在。含有CO32-的盐跟HCl反应能生成CO2,将生成的CO2气体通入澄清石灰水,澄清石灰水变浑浊,则该盐中一定含有CO32-。3、掌握盐的溶解性是学习盐的化学性质及复分解反应的重要条件。记住盐的溶解性表至关重要,否则很难书信正确的化学方程式。盐溶解性表可用韵语记忆法记忆:钾、钠、铵、硝酸(盐)溶;硫酸(盐)除钡溶;盐酸(盐)除银溶;碳酸(盐)只溶钾、钠、铵。 例1:根据下列物质的名称或俗称,判断属于同一种物质的一组是 ( )
A.氢氧化钙、氯化钠
B.食盐、氯化钠
C.氧化钙、熟石灰
D.烧碱、纯碱【考点导学】B例2 有一包白色固体混合物,可能有CuSO4、NaCl、KCl、Na2SO4、KNO3、NaNO3、Na2CO3、MgCl2,进行了如下实验:混合物溶于水得到无色透明溶液;取少量上述溶液分成两份,其中一份滴加BaCl2溶液,即产生白色沉淀,再加入稀硝酸,沉淀没有溶解,也无气体产生;另一份滴加NaOH溶液,有白色沉淀产生。根据以上实验现象回答:①混合物中肯定没有 。
②肯定有 。
③可能有 。CuSO4、Na2CO3Na2SO4、MgCl2NaCl、KCl、KNO3、NaNO3【达标训练】1.盐是一类物质的总称,而不仅仅指食盐。下列物质中属于盐的是 ( )
A.H2CO3 B.CaO C.Cu(OH)2 D.NH4HSO4
2.在蔬菜的生长过程中,常喷洒农药防治病虫害。据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药毒性降低。因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间,浸泡蔬菜时可加入适量的 ( )
A.纯碱 B.白酒 C.白糖 D.食醋DA3.有一种含钾的医用化合物水溶液,加入硝酸银溶液能生成白色沉淀,加入稀硝酸后,白色沉淀不溶解,则这种医用化合物是 ( )
A.K2CO3 B.KNO3 C.KCl D.KOH C4.油条是一种常见的小吃,可作早点食用。在面粉中加入碱面、盐溶液及水揉和并切成条状,放油锅内一炸就会不断产生二氧化碳,使油条膨胀并浮出油面。制作过程其中“碱面”必不可少,它可以使油条变得疏松多孔,更加香脆。根据以上信息,“碱面”这种物质是 ( )
A.NaOH B.Na2CO3 C.K2CO3 D.NaClB5.下列物质中,难溶于水的是( )
A.CuSO4 B.K2CO3 C.AgNO3 D.AgCl
6.在氯化钠中混有少量的硫酸钠,欲除去少量的硫酸钠,又不引入新的杂质,所加的试剂为 ( )
A.加入适量的氯化钡溶液
B.加入适量的硝酸钡溶液
C.加入适量氢氧化钡
D.加入适量盐酸DA7.检验碳酸盐最简单的方法是
( )
A.加入BaCl2溶液,产生白色沉淀
B.加入AgNO3溶液,产生白色沉淀
C.加入稀盐酸,产生使石灰水变浑浊的气体
D.放入水中不溶解的是碳酸钙C8.某盐溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀。过滤后向滤液中加入NaOH溶液,生成蓝色沉淀。这种盐是 ( )
A.Fe2(SO4)3 B.CuCl2 C.CuSO4 D.AgNO3C9.Na2CO3在工业上叫做 ,俗称 。其晶体的化学式为 ,它暴露在干燥的空气里易 ,而逐渐失去结晶水,最后变成粉末。Na2CO3·10H2O 风化苏打纯碱10.有一包白色固体,可能是氯化钙和碳酸钠的混合物,也可能只含有一种物质。为鉴别它,做了下列实验:
a.取一些白色固体溶解在水里,有白色沉淀生成,经过滤,滤液无色。b.滤出的沉淀加入盐酸,有无色气体生成,该气体能使澄清石灰水变浑浊。c.在滤液里加入硝酸银溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。根据上述实验现象判断:
①这一包白色固体是什么物质?
②操作a中,滤出的白色沉淀是什么物质?
③滤液里有哪些溶质离子?Na+、Cl-氯化钙和碳酸钠的混合物碳酸钙酸、碱及中和反应【中考要求】【导学体系】一、酸
1.酸:电离时生产的阳离子全部是氢离子的化合物,如:盐酸、硫酸、硝酸等。
2.常见的酸(盐酸和硫酸)
3.浓硫酸的稀释方法:在不断搅拌下把浓硫酸慢慢注入水中,而不能用相反的方式进行。物理性质:①浓盐酸中HCl的质量分数约为37%-38%,密度是1.19g/cm3②低沸点、易挥发的酸,浓盐酸在空气中会形成白雾化学性质:①与指示剂的作用:使紫色石蕊试液变红,无色酚酞试液不变色
②与活泼金属反应放出氢气
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑盐酸(HCl)③与碱性氧化物反应生成盐和水
CuO+2HCl=CuCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
④与碱反应生成盐和水
NaOH+HCl=NaCl+H2O
Fe(OH)3+3HCl=FeCl3+3H2O
⑤与某些盐反应生成另一种酸和另一种盐
CaCO3+2HCl=CaCl2+H2O+CO2↑
AgNO3+HCl=AgCl↓+HNO3检验方法:在盐酸和可溶性的盐酸盐(既电离时能产生Cl-的化合物)的水溶液中滴加AgNO3溶液,若有不溶于稀硝酸的白色沉淀产生,则证明有Cl-存在。用途:是重要的化工产品,用于金属
表面的除锈,也可以用于制取某些药
物。人的胃液里含有少量盐酸,可以
帮助消化。硫酸(H2SO4)物理性质:①纯净的硫酸是无色、粘稠、油壮的液体②浓硫酸中H2SO4的质量分数约为98%,密度是1.84g/cm3③高沸点、难挥发的酸。①与指示剂的作用:稀硫酸能使紫色石蕊试液变红,无色酚酞试液不变色
②稀硫酸与活泼金属反应放出氢气
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑化学性质:③稀硫酸与碱性氧化物反应生成盐和水
CuO+H2SO4=CuSO4+H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④稀硫酸与碱反应生成盐和水
2NaOH+H2SO4=Na2SO4+2H2O
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
⑤稀硫酸与某些盐反应生成另一种酸和另一种盐
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3用途:是重要的化工原料,广泛应用于化肥、农药、火药、染料以及金属去锈等方面。检验方法:在硫酸和可溶性的硫酸盐(既电离时能产生SO42-的化合物)的水溶液中滴加BaCl2或Ba(NO3)2溶液,若有不溶于稀硝酸的白色沉淀产生,则证明有SO42-存在。①电离时生产的阳离子全部是氢离子。
HCl=H-+Cl- H2SO4=2H++SO42-
②均能与指示剂的作用,使紫色石蕊试液变红,无色酚酞试液不变色。
③其稀酸均与能与活泼金属反应放出氢气;均与能与与碱及碱性氧化物反应生成盐和水;均与能与与某些盐反应生成另一种酸和另一种盐区分:在其稀溶液中滴加Ba(NO3)2溶液,
若有不溶于稀硝酸的白色沉淀产生,则证
明是稀H2SO4,否则是稀HCl。盐酸和硫酸共性二、碱
1.碱:电离时生产的阴离子全部是氢氧根离子的化合物,如:氢氧化钠、氢氧化钙。
2.常见的碱(氢氧化钠和氢氧化钙)三、溶液的酸碱性
1.用酸碱指示剂判断溶液的酸碱性:2.溶液的酸碱性的定量表示方法(酸碱度)—— pH值:
pH的数值是反映物质酸碱性强弱的指标,它的范围通常在0~14之间。pH的数值越低,酸性越强;pH的数值越高,碱性越强,pH的数值等于7的物质呈中性。0 酸性增强 7 碱性增强143. 溶液的酸碱性的测定:
测定溶液酸碱性强弱的最常用、最简单的方法是使用pH试纸。测定的方法是用洁净的玻璃棒蘸取被测试的溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪一种颜色最接近,从而确定被测溶液的pH值。
4.酸雨:
pH低于5.6的酸性降水。酸雨中主要的有害物质是硫酸和硝酸,其原因是空气中含有较多的二氧化硫、氮氧化合物等。中和反应
1.特点:酸和碱作用生成盐和水。
2.意义:广泛应用于工农业生产、生活中。如:用熟石灰来降低土壤的酸性、精制石油时用氢氧化钠来中和过量的酸等。例1:如图在大烧瓶中收集满二氧化碳,烧瓶用长导管的胶塞塞紧,伸入烧瓶的导管一端,先绑好一个气球,当拔开胶塞倒入浓氢氧化钠
溶液后,立即塞紧、振荡。
可看到的现象是 ,
原因是 (用
化学方程式表示)。【考点导学】气球变大2NaOH+CO2=Na2CO3+H2O例2:如右图所示,横坐标表示加入物质的质量,纵坐标表示溶液的PH变化,能用该图像表达的实验是 ( )
A.向盐酸中逐渐加入蒸馏水
B.向水中不断通入二氧化碳
C.向稀硫酸中逐渐加入
氢氧化钠至刚好完全中和
D.向氢氧化钠溶液中逐滴
加入稀盐酸至刚好完全中和D 【达标训练】1.下列物质中,不属于酸的是( )
A.H2CO3 B.H3PO4 C.HNO3 D.KHSO4
2.土壤的酸碱度直接影响农作物的生长。已知某地区土壤显微酸性,参照下表,从土壤酸碱性考虑,在该地区不适宜种植的作物是 ( )
A.西瓜 B.甘草 C.小麦 D.油菜DB3.下列有关酸的说法中正确的是( )
A.盐酸可以除去铁钉表面的铁锈,并生成氯化铁溶液
B.实验室可以利用块状大理石与稀硫酸来制取CO2气体
C.浓硫酸能腐蚀植物纤维、人体皮肤使其便黑,是因为它有强吸水性
D.用加热蒸发溶剂的方法,可以使稀盐酸变成浓盐酸
4.下列物质中pH小于7的是 ( )
A.NaOH溶液 B.NaCl溶液
C.稀盐酸 D.石灰水AC5.下列酸敞口放置,质量增大的是
( )
A.浓盐酸 B.浓硫酸
C.碳酸 D.浓硝酸
6.下列溶液酸性最强的是 ( )
A.pH=0 B.pH=1
C.pH=7 D.pH=14BA7.实验室常用浓硫酸作某些气体的干燥剂,这是利用浓硫酸的 ( )
A.吸水性 B.脱水性 C.酸性 D.难挥发性
8.为了验证长期暴露在空气中的氢氧化钠溶液是否已变质,某同学取2ml溶液于试管中进行实验,其中不能达到验证目的的是
( )
A.加入足量盐酸
B.加入适量澄清石灰水
C.加入氯化钡溶液
D.通入二氧化碳气体DA9.下列变化能通过一步反应实现的是 ( )
A.Na2CO3→NaOH
B.CuO→Cu(OH)2
C.CaCO3→Ca(OH)2
D.Fe2O3→Fe(OH)2A10.许多植物的花果茎叶中都含有某些显色的物质,它们在酸性溶液或碱性溶液里会显示不同的颜色,可以用作酸碱指示剂。右下表是月季花浸出液在不同条件下的显色情况。在肥皂水(pH为9.5~10.5)中滴加月季花浸出液会显示 ( )
A.无色 B.红色 C.黄色 D.橙色C11.下列各组溶液的pH由小到大排列的是 ( )
A.苛性钠、水、碳酸氢钠、硫酸
B.盐酸、氢氧化钠、水、碳酸钠
C.盐酸、食盐、石灰水
D.硝酸、苛性钠、水、纯碱C12.下列各组物质反应后,没有沉淀生成的是 ( )
A.Ba(NO3)2溶液和稀硫酸
B.CO2气体和石灰水
C.AgNO3溶液和盐酸
D.NaOH溶液和稀硝酸D13.在NaOH溶液中加入1~2滴酚酞试液,然后逐滴滴入稀硫酸,直至反应完成。在这个过程中溶液颜色的变化为 ( )
A.红色→无色→无色
B.无色→蓝色→红色
C.无色→蓝色→无色
D.红色→无色→红色A14.把盛有NaOH溶液的小试管倒置在盛有NaOH溶液的水槽中(如图),用导气管往试管中缓缓通入混有少量CO2和O2的混合气体,最后在试管内可收集到的气体是 ,
原因是 。CO2+NaOH=Na2CO3+H2O O2CO2能与NaOH反应15.稀释浓硫酸时,一定要把
沿着容器壁慢慢地注入
中,并不断 ,使产生的热量迅速地扩散。搅拌浓硫酸水16.根据题目要求,将适当物质的名称填在横线上。
⑴为证明甲烷燃烧产物中有CO2,可将产物通入 。
⑵为证明生石灰与水反应生成可溶性碱,可向生成物中滴入无色 ,若呈红色,证明生成了碱。酚酞澄清石灰水17.苛性钠(NaOH)在实验中常常可以作一些气体的干燥剂,这是利用苛性钠的 性质。下列一些气体中不能用它作干燥剂的是 ,理由是(写出反应式) 。
A.O2 B.CO2 C.H2 D.NH32NaOH+CO2==Na2CO3+H20吸水B
单质:由同种元素组成的纯净物,如H2、O2、I2、臭氧O3、金刚石C。
化合物:由不同种元素组成的纯净物,如NaCl、CaCO3、CuSO4
二.典型金属与非金属在空气(氧气)中燃烧的现象及产物。
1.金属与氧气反应2.非金属与氧气反应【考点导学】例1:下列实验现象的描述,错误的是( )
A.木炭在氧气里燃烧比在空气里燃烧得更旺,发出白光,并放出热量
B.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
C.红磷在氧气中燃烧,产生大量白雾
D.镁条在空气中燃烧,发出耀眼白光,生成白色粉末
C例2:如图,根据这个实验的现象,可以得到有关二氧化碳的性质的是 ( )
A.密度比空气大
B.不支持燃烧
C.不能燃烧
D.以上答案都对D【达标训练】1.下列各选项中,属于化合物的是 ( )
A.干冰 B.金刚石
C.液氧 D.碘酒A2.下列有关实验现象的描述,错误的是 ( )
A.细铁丝在氧气中能剧烈燃烧,火星四射
B.镁带在空气中燃烧会生成一种白色固态物质氧化镁
C.把燃着的火柴放在集满CO2的瓶口,火焰熄灭
D.硫粉在氧气中燃烧会发出明亮的黄色火焰D3.下列物质属于氧化物的是 ( )
A.高锰酸钾 B.氧气
C.双氧水 D.盐水
4.有些非金属氧化物可与水反应生成酸,比如CO2+H2O==H2CO3;同样也有些金属氧化物可与水反应生成碱。下列各氧化物中,不能与水直接发生反应生成相应的酸或碱的是 ( )
A.氧化钠 B.氧化钙
C.二氧化硅 D.二氧化碳CC5.要除去CO2气体中混有的少量CO,应采用的方法是 ( )
A.将混合气体通过澄清石灰水 B.将混合气体通过灼热的氧化铜
C.将混合气体通过灼热的木炭 D.将混合气体点燃
6.合金是一种 ( )
A.单质 B.化合物
C.混合物 D.金属氧化物CB7.下列反应的产物不会污染空气的是 ( )
A.硫在空气中燃烧
B.氢气在空气中燃烧
C.煤的燃烧
D.在影院等公共场所大量吸烟B8.如下图所示,甲、乙两个集气瓶中的燃烧匙内分别盛有适量的红磷和硫粉,已知甲、乙两个集气
瓶的体积相等,
内部充满空气,
当红磷和硫粉完
全燃烧并冷却至室温,再同时打开两边的活塞,可以看到的现象是( )
A.水由导管同时进入甲、乙两个集气瓶中 B.甲、乙两个集气瓶看不出变化 C.水从导管进入甲瓶、乙瓶中几乎无变化 D.水从导管进乙入瓶、甲瓶中无变化C9.已知铁丝在氧气中可以发生的反应是:铁+氧气点燃四氧化三铁,试回答:
⑴判断铁丝在氧气中燃烧是化学变化的根本依据是 ( )
A.反应中火星四射 B.有燃烧现象发生
C.有大量的热产生
D.有与铁完全不同的黑色固体生成
⑵在“氧气的制取和性质”实验中,有同学取一段纱窗上的细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验。结果没有观察到“火星四射”的现象,请分析实验失败的原因可能是 。D铁丝表面已被氧化生成氧化铁10.酸雨是指pH低于5.6的大气降水,目前我国有20多个省、市、自治区出现程度不同的酸雨,目前酸雨已成为我国严重的区域性环境问题。通常形成酸雨的物质是含硫或含氮的氧化物,其中燃烧化石燃料(石油、天然气、煤炭)产生的硫、氮氧化物是造成酸雨的主要原因。但有些植物如广玉兰、枫树、夹竹桃等,在它们能忍受的浓度下,可以吸收这种有害气体。
⑴你认为该种含硫氧化物的有害气体是 。
⑵请写出酸雨形成的原因(用化学方程式表示)
。SO2 + H2O = H2SO3二氧化硫11.一氧化氮是大气的主要污染物之一。近几年来又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:4X+5O2==4NO+6H20,根据质量守恒定律可以推出X的化学式为 。汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理方法是在尾气的排气管上装一个催化转化器,在催化剂的作用下,一氧化氮和一氧化碳可生成二氧化碳和氮气,该反应的化学方程式为 。2NO+2CO=N2+2CO2NH3重要的盐【中考要求】【导学体系】1、常见盐的性质与用途食盐(NaCl)性质:主要来自海水,能与硝酸银溶液反应,生成白色不溶于稀硝酸的沉淀AgCl用途:是人类不可缺少的食物,也是重要的化工原料。0.9%的氯化钠溶液即生理盐水用于医学上纯碱(Na2CO3)性质:又称苏打,水溶液呈碱性用途:重要的化工工业原材料之一,广泛地应用于玻璃、化工工业。碳酸钙(CaCO3)性质:一种难溶的盐,是碳酸和氢氧化钙中和反应的产物,能与酸反应生成二氧化碳。用途:重要的建筑材料,也可用于造纸、塑料、人造橡胶、食品、等领域。2、碳酸根离子的鉴别:
CaCO3与HCl反应生成CO2这一反应不但可以制备CO2,还可以用来鉴别CO32-的存在。含有CO32-的盐跟HCl反应能生成CO2,将生成的CO2气体通入澄清石灰水,澄清石灰水变浑浊,则该盐中一定含有CO32-。3、掌握盐的溶解性是学习盐的化学性质及复分解反应的重要条件。记住盐的溶解性表至关重要,否则很难书信正确的化学方程式。盐溶解性表可用韵语记忆法记忆:钾、钠、铵、硝酸(盐)溶;硫酸(盐)除钡溶;盐酸(盐)除银溶;碳酸(盐)只溶钾、钠、铵。 例1:根据下列物质的名称或俗称,判断属于同一种物质的一组是 ( )
A.氢氧化钙、氯化钠
B.食盐、氯化钠
C.氧化钙、熟石灰
D.烧碱、纯碱【考点导学】B例2 有一包白色固体混合物,可能有CuSO4、NaCl、KCl、Na2SO4、KNO3、NaNO3、Na2CO3、MgCl2,进行了如下实验:混合物溶于水得到无色透明溶液;取少量上述溶液分成两份,其中一份滴加BaCl2溶液,即产生白色沉淀,再加入稀硝酸,沉淀没有溶解,也无气体产生;另一份滴加NaOH溶液,有白色沉淀产生。根据以上实验现象回答:①混合物中肯定没有 。
②肯定有 。
③可能有 。CuSO4、Na2CO3Na2SO4、MgCl2NaCl、KCl、KNO3、NaNO3【达标训练】1.盐是一类物质的总称,而不仅仅指食盐。下列物质中属于盐的是 ( )
A.H2CO3 B.CaO C.Cu(OH)2 D.NH4HSO4
2.在蔬菜的生长过程中,常喷洒农药防治病虫害。据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药毒性降低。因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间,浸泡蔬菜时可加入适量的 ( )
A.纯碱 B.白酒 C.白糖 D.食醋DA3.有一种含钾的医用化合物水溶液,加入硝酸银溶液能生成白色沉淀,加入稀硝酸后,白色沉淀不溶解,则这种医用化合物是 ( )
A.K2CO3 B.KNO3 C.KCl D.KOH C4.油条是一种常见的小吃,可作早点食用。在面粉中加入碱面、盐溶液及水揉和并切成条状,放油锅内一炸就会不断产生二氧化碳,使油条膨胀并浮出油面。制作过程其中“碱面”必不可少,它可以使油条变得疏松多孔,更加香脆。根据以上信息,“碱面”这种物质是 ( )
A.NaOH B.Na2CO3 C.K2CO3 D.NaClB5.下列物质中,难溶于水的是( )
A.CuSO4 B.K2CO3 C.AgNO3 D.AgCl
6.在氯化钠中混有少量的硫酸钠,欲除去少量的硫酸钠,又不引入新的杂质,所加的试剂为 ( )
A.加入适量的氯化钡溶液
B.加入适量的硝酸钡溶液
C.加入适量氢氧化钡
D.加入适量盐酸DA7.检验碳酸盐最简单的方法是
( )
A.加入BaCl2溶液,产生白色沉淀
B.加入AgNO3溶液,产生白色沉淀
C.加入稀盐酸,产生使石灰水变浑浊的气体
D.放入水中不溶解的是碳酸钙C8.某盐溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀。过滤后向滤液中加入NaOH溶液,生成蓝色沉淀。这种盐是 ( )
A.Fe2(SO4)3 B.CuCl2 C.CuSO4 D.AgNO3C9.Na2CO3在工业上叫做 ,俗称 。其晶体的化学式为 ,它暴露在干燥的空气里易 ,而逐渐失去结晶水,最后变成粉末。Na2CO3·10H2O 风化苏打纯碱10.有一包白色固体,可能是氯化钙和碳酸钠的混合物,也可能只含有一种物质。为鉴别它,做了下列实验:
a.取一些白色固体溶解在水里,有白色沉淀生成,经过滤,滤液无色。b.滤出的沉淀加入盐酸,有无色气体生成,该气体能使澄清石灰水变浑浊。c.在滤液里加入硝酸银溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。根据上述实验现象判断:
①这一包白色固体是什么物质?
②操作a中,滤出的白色沉淀是什么物质?
③滤液里有哪些溶质离子?Na+、Cl-氯化钙和碳酸钠的混合物碳酸钙酸、碱及中和反应【中考要求】【导学体系】一、酸
1.酸:电离时生产的阳离子全部是氢离子的化合物,如:盐酸、硫酸、硝酸等。
2.常见的酸(盐酸和硫酸)
3.浓硫酸的稀释方法:在不断搅拌下把浓硫酸慢慢注入水中,而不能用相反的方式进行。物理性质:①浓盐酸中HCl的质量分数约为37%-38%,密度是1.19g/cm3②低沸点、易挥发的酸,浓盐酸在空气中会形成白雾化学性质:①与指示剂的作用:使紫色石蕊试液变红,无色酚酞试液不变色
②与活泼金属反应放出氢气
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑盐酸(HCl)③与碱性氧化物反应生成盐和水
CuO+2HCl=CuCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
④与碱反应生成盐和水
NaOH+HCl=NaCl+H2O
Fe(OH)3+3HCl=FeCl3+3H2O
⑤与某些盐反应生成另一种酸和另一种盐
CaCO3+2HCl=CaCl2+H2O+CO2↑
AgNO3+HCl=AgCl↓+HNO3检验方法:在盐酸和可溶性的盐酸盐(既电离时能产生Cl-的化合物)的水溶液中滴加AgNO3溶液,若有不溶于稀硝酸的白色沉淀产生,则证明有Cl-存在。用途:是重要的化工产品,用于金属
表面的除锈,也可以用于制取某些药
物。人的胃液里含有少量盐酸,可以
帮助消化。硫酸(H2SO4)物理性质:①纯净的硫酸是无色、粘稠、油壮的液体②浓硫酸中H2SO4的质量分数约为98%,密度是1.84g/cm3③高沸点、难挥发的酸。①与指示剂的作用:稀硫酸能使紫色石蕊试液变红,无色酚酞试液不变色
②稀硫酸与活泼金属反应放出氢气
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑化学性质:③稀硫酸与碱性氧化物反应生成盐和水
CuO+H2SO4=CuSO4+H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④稀硫酸与碱反应生成盐和水
2NaOH+H2SO4=Na2SO4+2H2O
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
⑤稀硫酸与某些盐反应生成另一种酸和另一种盐
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3用途:是重要的化工原料,广泛应用于化肥、农药、火药、染料以及金属去锈等方面。检验方法:在硫酸和可溶性的硫酸盐(既电离时能产生SO42-的化合物)的水溶液中滴加BaCl2或Ba(NO3)2溶液,若有不溶于稀硝酸的白色沉淀产生,则证明有SO42-存在。①电离时生产的阳离子全部是氢离子。
HCl=H-+Cl- H2SO4=2H++SO42-
②均能与指示剂的作用,使紫色石蕊试液变红,无色酚酞试液不变色。
③其稀酸均与能与活泼金属反应放出氢气;均与能与与碱及碱性氧化物反应生成盐和水;均与能与与某些盐反应生成另一种酸和另一种盐区分:在其稀溶液中滴加Ba(NO3)2溶液,
若有不溶于稀硝酸的白色沉淀产生,则证
明是稀H2SO4,否则是稀HCl。盐酸和硫酸共性二、碱
1.碱:电离时生产的阴离子全部是氢氧根离子的化合物,如:氢氧化钠、氢氧化钙。
2.常见的碱(氢氧化钠和氢氧化钙)三、溶液的酸碱性
1.用酸碱指示剂判断溶液的酸碱性:2.溶液的酸碱性的定量表示方法(酸碱度)—— pH值:
pH的数值是反映物质酸碱性强弱的指标,它的范围通常在0~14之间。pH的数值越低,酸性越强;pH的数值越高,碱性越强,pH的数值等于7的物质呈中性。0 酸性增强 7 碱性增强143. 溶液的酸碱性的测定:
测定溶液酸碱性强弱的最常用、最简单的方法是使用pH试纸。测定的方法是用洁净的玻璃棒蘸取被测试的溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪一种颜色最接近,从而确定被测溶液的pH值。
4.酸雨:
pH低于5.6的酸性降水。酸雨中主要的有害物质是硫酸和硝酸,其原因是空气中含有较多的二氧化硫、氮氧化合物等。中和反应
1.特点:酸和碱作用生成盐和水。
2.意义:广泛应用于工农业生产、生活中。如:用熟石灰来降低土壤的酸性、精制石油时用氢氧化钠来中和过量的酸等。例1:如图在大烧瓶中收集满二氧化碳,烧瓶用长导管的胶塞塞紧,伸入烧瓶的导管一端,先绑好一个气球,当拔开胶塞倒入浓氢氧化钠
溶液后,立即塞紧、振荡。
可看到的现象是 ,
原因是 (用
化学方程式表示)。【考点导学】气球变大2NaOH+CO2=Na2CO3+H2O例2:如右图所示,横坐标表示加入物质的质量,纵坐标表示溶液的PH变化,能用该图像表达的实验是 ( )
A.向盐酸中逐渐加入蒸馏水
B.向水中不断通入二氧化碳
C.向稀硫酸中逐渐加入
氢氧化钠至刚好完全中和
D.向氢氧化钠溶液中逐滴
加入稀盐酸至刚好完全中和D 【达标训练】1.下列物质中,不属于酸的是( )
A.H2CO3 B.H3PO4 C.HNO3 D.KHSO4
2.土壤的酸碱度直接影响农作物的生长。已知某地区土壤显微酸性,参照下表,从土壤酸碱性考虑,在该地区不适宜种植的作物是 ( )
A.西瓜 B.甘草 C.小麦 D.油菜DB3.下列有关酸的说法中正确的是( )
A.盐酸可以除去铁钉表面的铁锈,并生成氯化铁溶液
B.实验室可以利用块状大理石与稀硫酸来制取CO2气体
C.浓硫酸能腐蚀植物纤维、人体皮肤使其便黑,是因为它有强吸水性
D.用加热蒸发溶剂的方法,可以使稀盐酸变成浓盐酸
4.下列物质中pH小于7的是 ( )
A.NaOH溶液 B.NaCl溶液
C.稀盐酸 D.石灰水AC5.下列酸敞口放置,质量增大的是
( )
A.浓盐酸 B.浓硫酸
C.碳酸 D.浓硝酸
6.下列溶液酸性最强的是 ( )
A.pH=0 B.pH=1
C.pH=7 D.pH=14BA7.实验室常用浓硫酸作某些气体的干燥剂,这是利用浓硫酸的 ( )
A.吸水性 B.脱水性 C.酸性 D.难挥发性
8.为了验证长期暴露在空气中的氢氧化钠溶液是否已变质,某同学取2ml溶液于试管中进行实验,其中不能达到验证目的的是
( )
A.加入足量盐酸
B.加入适量澄清石灰水
C.加入氯化钡溶液
D.通入二氧化碳气体DA9.下列变化能通过一步反应实现的是 ( )
A.Na2CO3→NaOH
B.CuO→Cu(OH)2
C.CaCO3→Ca(OH)2
D.Fe2O3→Fe(OH)2A10.许多植物的花果茎叶中都含有某些显色的物质,它们在酸性溶液或碱性溶液里会显示不同的颜色,可以用作酸碱指示剂。右下表是月季花浸出液在不同条件下的显色情况。在肥皂水(pH为9.5~10.5)中滴加月季花浸出液会显示 ( )
A.无色 B.红色 C.黄色 D.橙色C11.下列各组溶液的pH由小到大排列的是 ( )
A.苛性钠、水、碳酸氢钠、硫酸
B.盐酸、氢氧化钠、水、碳酸钠
C.盐酸、食盐、石灰水
D.硝酸、苛性钠、水、纯碱C12.下列各组物质反应后,没有沉淀生成的是 ( )
A.Ba(NO3)2溶液和稀硫酸
B.CO2气体和石灰水
C.AgNO3溶液和盐酸
D.NaOH溶液和稀硝酸D13.在NaOH溶液中加入1~2滴酚酞试液,然后逐滴滴入稀硫酸,直至反应完成。在这个过程中溶液颜色的变化为 ( )
A.红色→无色→无色
B.无色→蓝色→红色
C.无色→蓝色→无色
D.红色→无色→红色A14.把盛有NaOH溶液的小试管倒置在盛有NaOH溶液的水槽中(如图),用导气管往试管中缓缓通入混有少量CO2和O2的混合气体,最后在试管内可收集到的气体是 ,
原因是 。CO2+NaOH=Na2CO3+H2O O2CO2能与NaOH反应15.稀释浓硫酸时,一定要把
沿着容器壁慢慢地注入
中,并不断 ,使产生的热量迅速地扩散。搅拌浓硫酸水16.根据题目要求,将适当物质的名称填在横线上。
⑴为证明甲烷燃烧产物中有CO2,可将产物通入 。
⑵为证明生石灰与水反应生成可溶性碱,可向生成物中滴入无色 ,若呈红色,证明生成了碱。酚酞澄清石灰水17.苛性钠(NaOH)在实验中常常可以作一些气体的干燥剂,这是利用苛性钠的 性质。下列一些气体中不能用它作干燥剂的是 ,理由是(写出反应式) 。
A.O2 B.CO2 C.H2 D.NH32NaOH+CO2==Na2CO3+H20吸水B
