碱的复习课[上学期]
图片预览





文档简介
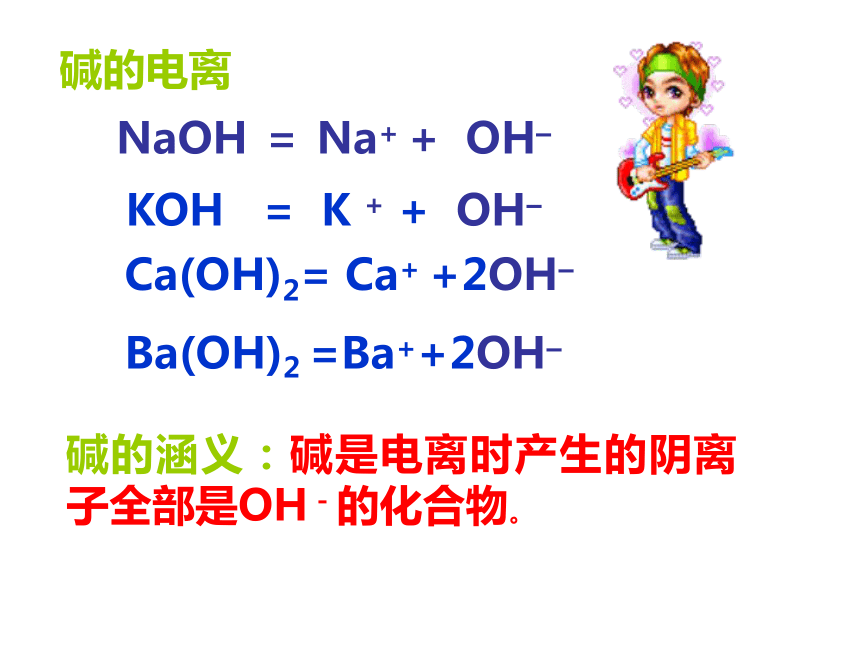
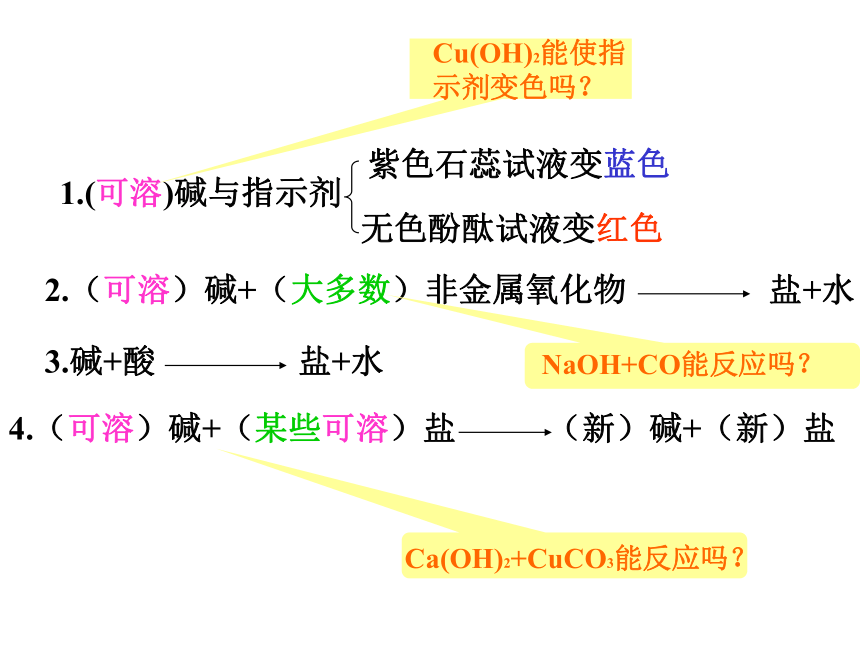
课件24张PPT。NaOH = Na+ + OH– Ca(OH)2= Ca+ +2OH– Ba(OH)2 =Ba++2OH– KOH = K + + OH–碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。碱的电离碱有哪些通性?1)、碱性物质能使紫色石蕊变蓝,无色酚酞变红.2)、碱跟酸作用生成盐和水
这种反应也叫中和反应。3)、非金属氧化物跟碱反应生成盐和水4)、盐和碱反应生成另一种碱 和另一种盐碱的化学性质要注意哪些事项?⑴只有可溶性碱才能满足以上四条性质,难溶性碱只能满足第2条
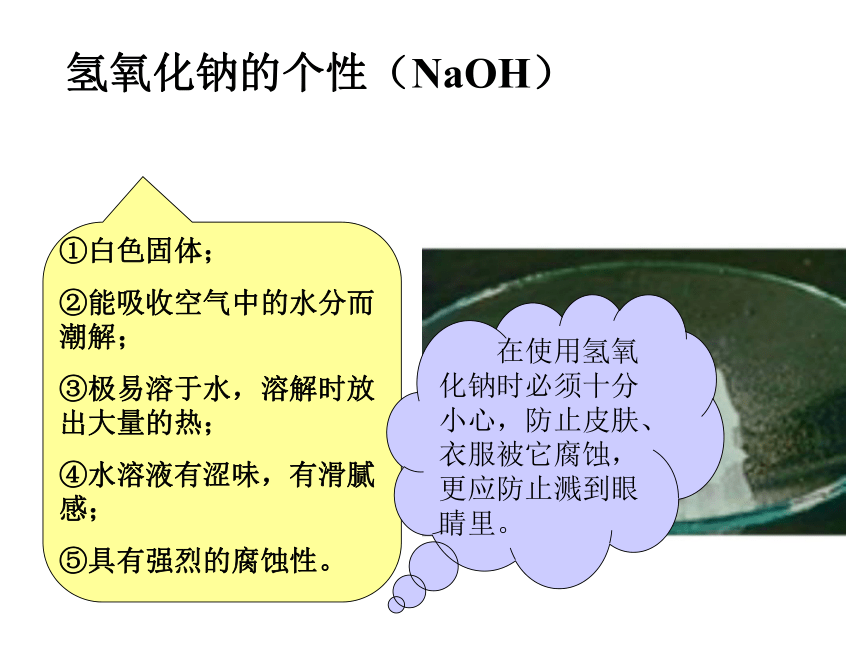
⑵第4条参加反应的盐和碱必需都是可溶性的。氢氧化钠的个性(NaOH)氢氧化钠是一种碱性干燥剂干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意;不能干燥酸性气体(HCl、CO2、 SO2、H2S等)
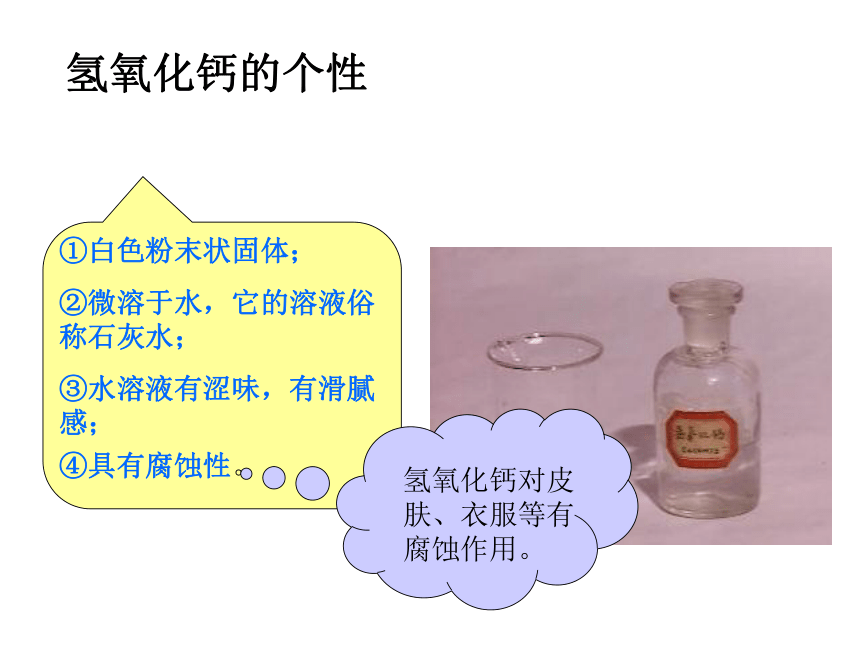
氢氧化钙的个性火碱、烧碱、苛性钠消石灰、熟石灰___色____体,_____溶于水,放出_____、易__可以用作______.____色粉末,____溶于水,它的水溶液俗称______.使石蕊试液变——色,使酚酞试液变——色蓝红使石蕊试液变——色
使酚酞试液变——色蓝红CO2+NaOH——
SO2+NaOH——CO2+Ca(OH)2 ——NaOH+HCl——
NaOH+H2SO4——Ca(OH)2 +HCl——CuCl2+NaOH——
FeCl3 +NaOH——Na2CO3+Ca(OH)2——氢氧化钠、氢氧化钙的性质的比较 如何鉴别NaOH Ca(OH)21、用CO22、用Na2CO31.下列气体中,可以用氢氧化钠干燥的是( )
A. H2 B. SO2 C. CO2 D. HCl 2.用天平称量固体氢氧化钠时,应把氢氧化钠
放在( )
A.天平的托盘上 B.滤纸上
C.小烧杯内 D.试管中AC3:下列物质暴露在空气中,质量增加且变质的是
(A)浓硫酸 (B)火碱
(C)水 (D)浓盐酸
4:按下列要求各写一个化学方程式
(1) NaOH → Cu(OH)2
(2) NaOH → Na2CO3
NaOH → NaCl
B5.下列物质溶液中能使酚酞试液变红的是( )
A.NaCl B.H2SO4 C.Ca(OH)2 D.NaNO3 6. 下列物质中,既能与氢氧化钙溶液反应,又能与
盐酸反应的是( )
A.碳酸钠 B.二氧化碳 C.氧化铜 D.氢氧化钠AC8. 氢氧化钙的俗称 或 ,它是 与水反应生成的,该反应的化学方程式是 。澄清的氢氧化钙水溶液又称 ,常用来检验 气体,观察到的现象是 ,此反应的化学方程为 。7.氢氧化钠是 色 体。 溶于水,溶解时放出 。固体氢氧化钠在空气中易 水分,而 ,所以它可以作为某些气体的 。氢氧化钠有强烈的 性,俗称 、 、 。 填空白固易热量吸收潮解干燥剂腐蚀苛性钠烧碱火碱熟石灰消石灰生石灰石灰水二氧化碳澄清的石灰水变浑浊Ca(OH)2+CO2→CaCO3↓+H2OCaO +H2O → Ca(OH)29.完成化学方程式 1.NaOH + SO2 →
2. NaOH + FeCl3 →
3. NaOH +H2SO4 →4.KOH+( )→ K2CO3+( )
5.HNO3+( )→ NaNO3+( )
6.Ca(OH)2+( )→ CaCl2+( )1.盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别。 2.你能否用生石灰制出烧碱?写出有关的化学方程式。 综合应用为了证明长期暴露在空气中氢氧化钠溶液已经部分变质,请分别选用三种不同物质类别的试剂完成三种实验方案的设计,并填写实验报告。
分析与解 本题应先分析得出,长期暴露在空气中的氢氧化钠溶液变质的原因和变质的产物是什么,再设计验证产物存在的方案。暴露在空气中的NaOH 由于吸收了空气中的CO2生成Na2CO3 而变质。要证明NaOH 溶液已部分变质,实质就是通过实验证明NaOH 溶液中含有Na2CO3,即CO32-的检验。本题的答案是:
方案一 加入过量的HCl (或H2SO4、HNO3) 有气泡出现
方案二 加入Ca(OH) 2 或Ba(OH) 2溶液 有白色沉淀出现
方案三 加入BaCl2 (或Ba(NO3)2、、CaCl2)溶液 有白色沉淀出现能力训练
1.下表为家庭中一些常见物质的pH:
物质食醋牙膏食盐水肥皂水火碱液pH3971013蚊子、蜂、蚂蚁等昆虫叮咬人时,会向人体射入一种叫蚁酸(具有酸的性质)的物质,使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )
A.牙膏或肥皂水 B.食盐水 C.烧碱溶液 D.食醋2.测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其中离子个数比为:Na+:Mg2+:Cl-=4:5:8,若设Na+为4n个,则SO42-个数可能为( )
A.2n B.3n C.6n D.8n
3.M克20%的盐酸和N克20%的氢氧化钠混合后所得溶液PH=7,则M和N的关系正确的是( )
A.MN C.M=N D.无法确定4.钡盐若进入血液中,Ba2+能使人中毒,但对胃肠做X光造影时,让病人口服钡餐(硫酸钡)却不会造成中毒。若误服碳酸钡却会造成中毒。误服碳酸钡后要迅速服用硫酸镁,可以起到解毒作用。你能解释以上现象吗? 5.2002年12月11日,一辆运载100桶砒霜的卡车在柳州金秀县境内翻车。有33桶约7吨砒霜跌入河床中。其中30桶不同程度地破损,部分砒霜散落在河床和河水中。砒霜的化学名称为三氧化二砷,其化学式为As2O3,是剧毒物质,其致死量最低为20mg,仅次于毒性最大的氰化钾。当地有关部门采取了紧急有效措施,防止跌落的砒霜污染土壤和河水。除筑坝拦水外,还应采取的适当措施是向河床、河水中( )
A.撒入大量生石灰 B.撒入大量烧碱
C.倒入大量醋酸 D.倒入大量稀盐酸6.甲、乙两位同学分别设计了下述实验方案,并都认为如果观察到的现象和自己的方案一致,即可确证溶液中含有SO42— ,试评价甲乙同学的方案是否严谨,并分别说明理由。8、将24.9克的某氢氧化钠溶液与140克硫酸铜溶液混合,二者恰好完全反应,过滤后,得到滤液160克,求:
?氢氧化钠溶液溶质的质量分数?
?硫酸铜溶液中溶质的质量分数?7.下列A、B、C溶液中都有杂质(括号内为杂质),请自选一种试剂可把杂质除去而达到提纯溶液的目的,并写出有关化学方程式。
(1)NaCl (CaCl2)试剂______________,化学方程式_____________________________
(2)Na2SO4 (Na2CO3)试剂______________, 化学方程式_______________________9.现有Fe,稀H2SO4,CuCl2溶液,NaOH溶液,Fe2O3,两两混合后,能发生反应的有 ( )
A.7个 B.6个 C.5个 D.4个
10.人体内CO2排出不畅时,血液的PH值会____________(填“升高、降低或不变”),浓硫酸敞口长期放置会自动溢出,这是因为____________________________________。11.将20克10%的盐酸和20克10%的氢氧化钠溶液混合后,滴入石蕊试液,溶液为 ( )
A.紫色 B.蓝色 C.红色 D.无法判断再见
这种反应也叫中和反应。3)、非金属氧化物跟碱反应生成盐和水4)、盐和碱反应生成另一种碱 和另一种盐碱的化学性质要注意哪些事项?⑴只有可溶性碱才能满足以上四条性质,难溶性碱只能满足第2条
⑵第4条参加反应的盐和碱必需都是可溶性的。氢氧化钠的个性(NaOH)氢氧化钠是一种碱性干燥剂干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意;不能干燥酸性气体(HCl、CO2、 SO2、H2S等)
氢氧化钙的个性火碱、烧碱、苛性钠消石灰、熟石灰___色____体,_____溶于水,放出_____、易__可以用作______.____色粉末,____溶于水,它的水溶液俗称______.使石蕊试液变——色,使酚酞试液变——色蓝红使石蕊试液变——色
使酚酞试液变——色蓝红CO2+NaOH——
SO2+NaOH——CO2+Ca(OH)2 ——NaOH+HCl——
NaOH+H2SO4——Ca(OH)2 +HCl——CuCl2+NaOH——
FeCl3 +NaOH——Na2CO3+Ca(OH)2——氢氧化钠、氢氧化钙的性质的比较 如何鉴别NaOH Ca(OH)21、用CO22、用Na2CO31.下列气体中,可以用氢氧化钠干燥的是( )
A. H2 B. SO2 C. CO2 D. HCl 2.用天平称量固体氢氧化钠时,应把氢氧化钠
放在( )
A.天平的托盘上 B.滤纸上
C.小烧杯内 D.试管中AC3:下列物质暴露在空气中,质量增加且变质的是
(A)浓硫酸 (B)火碱
(C)水 (D)浓盐酸
4:按下列要求各写一个化学方程式
(1) NaOH → Cu(OH)2
(2) NaOH → Na2CO3
NaOH → NaCl
B5.下列物质溶液中能使酚酞试液变红的是( )
A.NaCl B.H2SO4 C.Ca(OH)2 D.NaNO3 6. 下列物质中,既能与氢氧化钙溶液反应,又能与
盐酸反应的是( )
A.碳酸钠 B.二氧化碳 C.氧化铜 D.氢氧化钠AC8. 氢氧化钙的俗称 或 ,它是 与水反应生成的,该反应的化学方程式是 。澄清的氢氧化钙水溶液又称 ,常用来检验 气体,观察到的现象是 ,此反应的化学方程为 。7.氢氧化钠是 色 体。 溶于水,溶解时放出 。固体氢氧化钠在空气中易 水分,而 ,所以它可以作为某些气体的 。氢氧化钠有强烈的 性,俗称 、 、 。 填空白固易热量吸收潮解干燥剂腐蚀苛性钠烧碱火碱熟石灰消石灰生石灰石灰水二氧化碳澄清的石灰水变浑浊Ca(OH)2+CO2→CaCO3↓+H2OCaO +H2O → Ca(OH)29.完成化学方程式 1.NaOH + SO2 →
2. NaOH + FeCl3 →
3. NaOH +H2SO4 →4.KOH+( )→ K2CO3+( )
5.HNO3+( )→ NaNO3+( )
6.Ca(OH)2+( )→ CaCl2+( )1.盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别。 2.你能否用生石灰制出烧碱?写出有关的化学方程式。 综合应用为了证明长期暴露在空气中氢氧化钠溶液已经部分变质,请分别选用三种不同物质类别的试剂完成三种实验方案的设计,并填写实验报告。
分析与解 本题应先分析得出,长期暴露在空气中的氢氧化钠溶液变质的原因和变质的产物是什么,再设计验证产物存在的方案。暴露在空气中的NaOH 由于吸收了空气中的CO2生成Na2CO3 而变质。要证明NaOH 溶液已部分变质,实质就是通过实验证明NaOH 溶液中含有Na2CO3,即CO32-的检验。本题的答案是:
方案一 加入过量的HCl (或H2SO4、HNO3) 有气泡出现
方案二 加入Ca(OH) 2 或Ba(OH) 2溶液 有白色沉淀出现
方案三 加入BaCl2 (或Ba(NO3)2、、CaCl2)溶液 有白色沉淀出现能力训练
1.下表为家庭中一些常见物质的pH:
物质食醋牙膏食盐水肥皂水火碱液pH3971013蚊子、蜂、蚂蚁等昆虫叮咬人时,会向人体射入一种叫蚁酸(具有酸的性质)的物质,使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )
A.牙膏或肥皂水 B.食盐水 C.烧碱溶液 D.食醋2.测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其中离子个数比为:Na+:Mg2+:Cl-=4:5:8,若设Na+为4n个,则SO42-个数可能为( )
A.2n B.3n C.6n D.8n
3.M克20%的盐酸和N克20%的氢氧化钠混合后所得溶液PH=7,则M和N的关系正确的是( )
A.M
A.撒入大量生石灰 B.撒入大量烧碱
C.倒入大量醋酸 D.倒入大量稀盐酸6.甲、乙两位同学分别设计了下述实验方案,并都认为如果观察到的现象和自己的方案一致,即可确证溶液中含有SO42— ,试评价甲乙同学的方案是否严谨,并分别说明理由。8、将24.9克的某氢氧化钠溶液与140克硫酸铜溶液混合,二者恰好完全反应,过滤后,得到滤液160克,求:
?氢氧化钠溶液溶质的质量分数?
?硫酸铜溶液中溶质的质量分数?7.下列A、B、C溶液中都有杂质(括号内为杂质),请自选一种试剂可把杂质除去而达到提纯溶液的目的,并写出有关化学方程式。
(1)NaCl (CaCl2)试剂______________,化学方程式_____________________________
(2)Na2SO4 (Na2CO3)试剂______________, 化学方程式_______________________9.现有Fe,稀H2SO4,CuCl2溶液,NaOH溶液,Fe2O3,两两混合后,能发生反应的有 ( )
A.7个 B.6个 C.5个 D.4个
10.人体内CO2排出不畅时,血液的PH值会____________(填“升高、降低或不变”),浓硫酸敞口长期放置会自动溢出,这是因为____________________________________。11.将20克10%的盐酸和20克10%的氢氧化钠溶液混合后,滴入石蕊试液,溶液为 ( )
A.紫色 B.蓝色 C.红色 D.无法判断再见
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
