常见的酸和碱[上学期]
图片预览










文档简介
课件71张PPT。探索酸的性质胃酸、醋、酸梅、牛奶、可乐、雪碧等说一说:生活中有哪些东西是酸的? 引入:
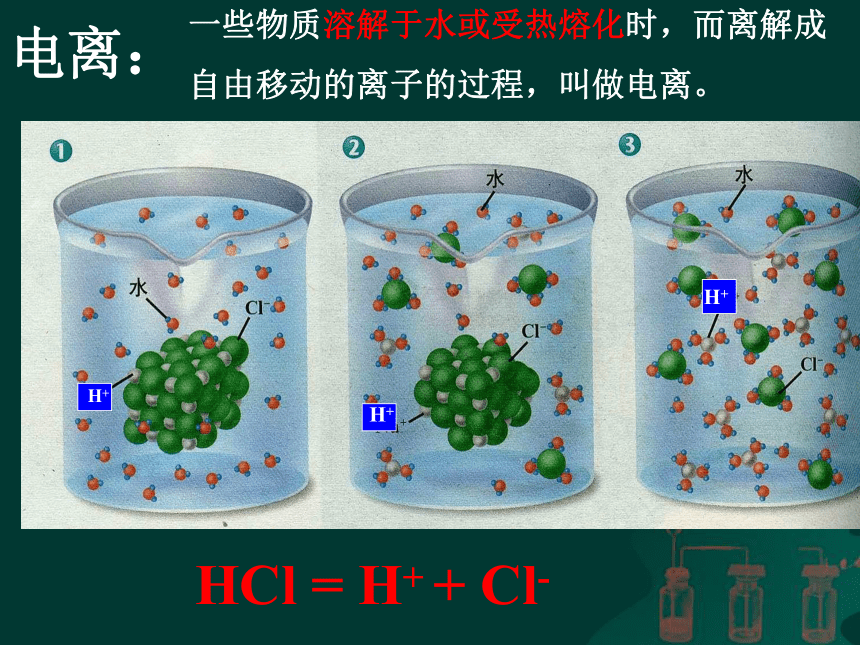
出示一个青桔子,同学们:当你看到它的即时感受是什么?――酸你能说出生活中有哪些东西是酸的? 苹果、橘子、葡萄、梨子、梅、杏、醋、酸奶、放置时间过长的面包等。食醋中有醋酸柠檬、柑橘等水果中含有柠檬酸汽车用铅蓄电池中含有硫酸一、那么酸是怎样的一类物质呢?电离:HCl = H+ + Cl-H+H+H+一些物质溶解于水或受热熔化时,而离解成
自由移动的离子的过程,叫做电离。
电离方程式NaCl== Na+ + Cl-
KNO3 == K+ + NO3-
NaOH == Na+ + OH-
Na2SO4 == 2Na+ + SO42-注意1、在电离过程中,原子团不拆散,离解发生在正价元素(或原子团)与负价元素(或原子团)两者连接处。
2、离子所带电荷数等于元素或原子团的化合价数。
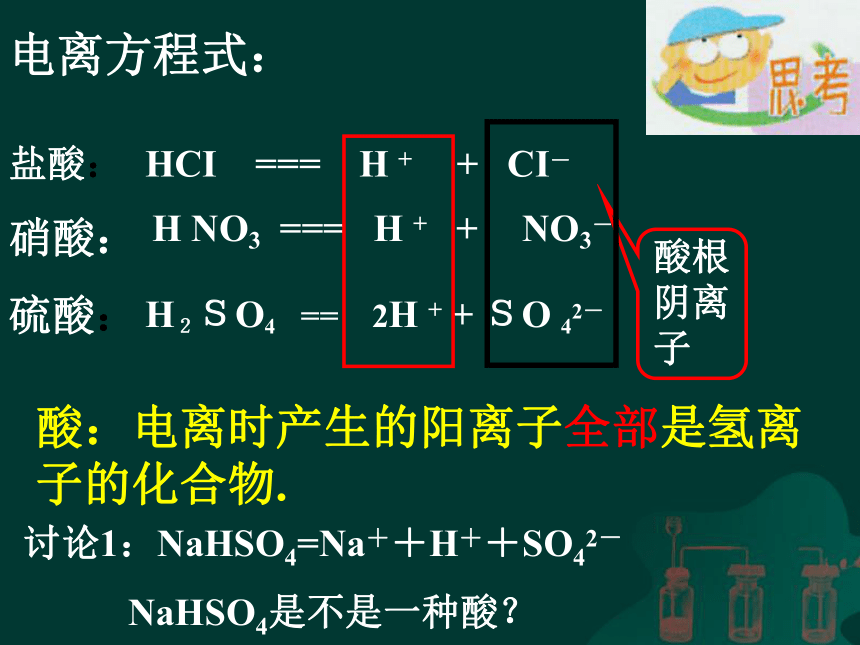
3、所有阳离子带的正电荷总数和所有阴离子带的负电荷总数是相等的。一些物质电离时产生的阴阳离子所带电荷的总数一定相等。所以,这些物质的溶液不显电性。电离方程式书写时,不必写条件,但要配平,使电荷总数,而原子团不能拆开。注意:常见的酸盐酸:
硝酸:
硫酸:HCI === H + + CI-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸:电离时产生的阳离子全部是氢离子的化合物.讨论1:NaHSO4=Na++H++SO42-
NaHSO4是不是一种酸?
电离通式:酸= H+ + 酸根阴离子我们把某种酸电离产生的阴离子叫做这中酸的酸根离子,如SO42-是H2SO4的酸根。 酸根离子所带负电荷的总数等于酸分子电离时生成的氢离子的总数日常生活中常见的酸胃液——盐酸
醋——醋酸
汽水饮料——碳酸、柠檬酸
牛奶发酵——乳酸
山渣、柑橘、柠檬——有机酸练习:
1、下列电离方程式正确的是( )
A、H2SO4 =H+ + SO42-
B、 Al2(SO4)3 = 2Al3++ 3SO4 2 -
C、 Ba(OH)2= Ba 2+ + (OH)-
D、NaCl=Na1+ +Cl1-
B2、写出下列物质的电离方式:
H2CO3 =
Ca(OH)2 =
Na2CO3 =
CuSO4 =
BaCl2 =
NaHSO4 =
在实验室我们用什么方法能简单而 快速地知道哪一种溶液是酸性的呢?用PH试纸思考: pH<7,酸性,
pH =7,中性;
pH>7,碱性
那么,你知道还有什么方法可以测 定物质的酸碱性?酸碱指示剂二、酸碱指示剂1、定义:在酸或碱溶液里能显示出不同颜色的物质。2、常见的指示剂有:紫色石蕊试液无色酚酞试液红色无色红色不变色蓝色红色不变色蓝色常用指示剂及其在酸性、碱性溶液中的颜色演示:1.用玻璃棒分别取少许水、酸果汁、白醋、 盐酸,滴在pH试纸中部,观察试纸的颜色变化.
2.在白色点滴板的空穴里分别滴入几滴上述样品,再滴加2-3滴紫色石蕊试液,观察其颜色的变化, 并将结果填入表中.结论:pH试纸能显示酸性的强弱,而指示剂则只能指示溶液是否显酸性或碱性。不变色变红色变红色变红色3174那么你会自制酸碱指示剂吗?
许多植物的花果茎叶中都含有某些显色的物质,它们在酸性溶液或碱性溶液里会显示不同的颜色.方法是取这些植物的花果枝叶切碎捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂. 红某些花浸出液的变色情况练习:
1、某无色溶液PH=2,该溶液呈 性,它能使紫色石蕊试液变 ,无色酚酞试液 ,使蓝色石蕊试纸变 。酸红色不变色红色2、下列物质中存在着能自由移动的氯离子的是---------( )
A、液态氯化氢; B、KCl晶体;
C、KClO3溶液; D、熔化的MgCl2
3、下列各组离子属于酸的电离的是…( )
A、H+、SO42-、Na+ B、OH-、Ba2+
C、H+、NO3- D、Na+、HCO3-实验二:往锌粒中加入稀盐酸盐酸能跟某些金属反应
反应方程式:
Zn + 2HCl = ZnCl2 + H2三、酸有哪些性质实验三:
酸与某些金属氧化物反应生成盐和水
往带锈铁钉中滴入稀盐酸溶液Fe2O3 + 6HCl = 2FeCl3 +3H2O
CuO+2HCl=CuCl2+H2O Al(OH)3 + HCl = + H2O
利用盐酸跟碱反应可以减少胃中盐酸的 含量。AlCl3实验四:往酚酞NaOH溶液中滴入稀盐酸溶液NaOH+HCl==NaCl+H2O实验五 :将鸡蛋壳放入盛有盐酸的试管
中,将燃着的火柴深入试管口CaCO3+2HCl==CaCl2+H2O+CO21、盐酸的性质酸对指示剂的作用酸跟金属的反应酸跟碱性氧化物的反应(一)物理性质 纯净的盐酸无色,有刺激性气味。工业盐酸因含杂质而带黄色。浓盐酸在空气中易挥发,与水蒸气形成酸雾。(二)化学性质(1)使紫色石蕊试液变红,无色酚酞不变色(2)跟金属反应Zn + 2HCl ==== ZnCl2 + H2 ↑Fe + 2HCl ==== FeCl2 + H2 ↑ (3)跟金属氧化物反应 CuO + 2HCl ==== CuCl2 + H2OFe2O3 + 6HCl ==== 2FeCl3 + 3H2O(4)跟碱反应Cu(OH)2+ 2HCl ==== CuCl2 + 2H2O(5)跟硝酸银反应AgNO3 + HCl ==== AgCl ↓+ HNO3可用于检验Cl-的存在。(1)金属表面除锈(2)制试剂或药品(3)胃液中帮助消化 (四)复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应化合物+化合物===两种新的化合物(三)盐酸的用途稀硫酸石蕊实验六:往稀硫酸中加入石蕊演示完毕,欲重复动画,请先
按PageUp,再单击鼠标左键结论
稀硫酸可使石蕊指示剂变红 特性:吸水性——干燥剂
脱水性
腐蚀性强
氧化性2、硫酸(H2SO4)
(一)浓硫酸 无色、黏稠、油状的液体,不易挥发,密度比水大,常用的浓硫酸中H2SO4的质量分数为98%。浓硫酸的腐蚀性浓硫酸的吸水性浓硫酸的脱水性吸水性脱水性 浓硫酸溶于水时放出大量的热,稀释浓硫酸时,一定要把沿着器壁慢慢地注入水中,(注意:不断搅动,使产生的热量迅速扩散。切不可把水倒进浓硫酸里) (二)浓硫酸的稀释 稀释浓硫酸的方法 (三)稀硫酸 H2SO4 ====2H+ + SO42- (1)能使紫色石蕊试液变红,无色酚
酞试液不变色(2)跟金属反应
Zn + H2SO4 ==== ZnSO4 + H2 ↑
Fe + H2SO4 ==== FeSO4 + H2 ↑ (3)跟金属氧化物反应
Fe2O3+3H2SO4 ==== Fe2 ( SO4 )3+3H2O
CuO+H2SO4 ==== Cu SO4 +H2O (4)跟碱反应
Cu( OH )2 +H2SO4 ==== Cu SO4 +3H2O(5)跟氯化钡(盐)反应
BaCl2 + H2SO4 ==== BaSO4 ↓ + 2HCl
此反应是用于检验硫酸和其他电离时能产生SO42-的化合物的特性反应(1)化工原料(农药、化肥、火药、染料)(2)冶炼有色金属,精炼石油(3)金属除锈 (四)硫酸的用途(二)化学性质 HNO3====H+ + NO3-3、硝酸(HNO3)
(一)物理性质 无色、有刺激性气味的液体,易挥发,在空气中与水蒸气形成酸雾。(1)能使紫色石蕊试液变红,无色酚酞
试液不变色(2)跟金属反应,产物很复杂,不产生H2 (3)跟金属氧化物反应
CuO + 2HNO3 ==== Cu (NO3)2 + H2O
ZnO + 2HNO3 ==== Zn (NO3)2 + H2O (4)跟碱反应
Mg( OH)2 + HNO3 ====Mg(NO3)2+3H2O(5)跟盐反应
CaCO 3 + 2HNO3 ==== Ca (NO3)2 +H2O+ CO2 ↑3、硝酸的用途
化工原料(化肥、染料、炸药)酸有哪些共同的化学性质?酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______ 例1:下列几种溶液装入敞口容器里,久置于空气中成分不变,但溶液的质量减少,且溶液中溶质的质量分数变小的是( )
A. 浓盐酸 B. 澄清石灰水
C. 浓硝酸 D. 浓硫酸A.C例2:下列叙述中,能够确定某物质一定是酸的是( )
A. 能使石蕊试液变红的溶液
B. 不能使酚酞试液变红的溶液
C. 能与活泼金属反应放出氢气的物质
D. 电离出的阳离子全部是氢离子的溶液
D例3:在稀硫酸中加入下列哪种物质,溶液的导电性会出现如图所示的变化( )
A. Ag
B. Ba(NO3)2
C. BaCl2
D. Ba(OH)2 所加物质质量 D导电性练习
1、将浓盐酸、浓硫酸、浓硝酸敞口放置一段时间,它们共同的变化是( )
(A)颜色发生改变
(B)发生化学变化
(C)质量变小
(D)溶质质量分数变小 D 2、盐酸和硫酸常用做金属表面的清洁剂,是利用了它们化学性质中的( ) (A)能与碱反应 (B)能与金属反应 (C)能与金属氧化物反应 (D)能与石蕊试液反应 C 3、一种无色溶液能BaCl 2溶液反应,生成不溶于HNO3的白色沉淀,则此无色溶液为( )
(A)一定是AgNO3溶液 (B)一定是稀H2SO4 (C)一定是可溶性的含SO42-的物质 (D)无法判断 D 1. 有两瓶试液: 稀 盐酸和氢氧化钠, 你如何来鉴别?思考2. 有两瓶试液: 稀盐酸和稀硫酸,
如何来鉴别?思考 如何证明无色溶液是
稀盐酸?酸的个性:浓盐酸的物理性质浓盐酸在空气里会生成白雾
浓盐酸有挥发性
工业浓盐酸常因含有杂质 而带黄色
浓硫酸H2SO4的物理性质纯净的浓硫酸是无色、粘稠、油状的液体,不容易挥发。常用的浓硫酸中H2SO4的质量分数是98%,
浓硫酸的个性1.浓硫酸具有强腐蚀性。【思考】如果浓硫酸不慎溅到皮肤上,应怎样处理?要先用干布拭去,然后用大量水
冲去,最后用小苏打溶液
冲洗。严重时应立即送医院.结论:2、浓硫酸具有脱水性。能使木材、纸张脱水碳化 3、浓硫酸具有吸水性,可做干燥剂。三、
硫酸的个性能干燥哪些气体呢?干燥剂与被干燥的气体不能发生反应。干燥氧气、氢气、
二氧化碳浓硫酸的稀释实验 【分析】由于水的密度较小,水流进浓硫酸时浮在硫酸上面,硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。导致事故发生。 【思考】为什么切不可把水倒入浓硫酸中稀释? 三、
硫酸的个性【三强酸的个性】硝酸 浓硝酸有很强
腐蚀性
挥发性【思考与讨论】
三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?【讨论与交流】你还认识哪些酸?
它们有哪些特性巩固与拓展磷酸H3PO4:纯品为无色透明粘稠状液体或斜方晶体,无臭,味很酸。性质相对稳定,挥发性小;酸性中等。
醋酸CH3COOH:无色的液体,酸味很浓, 容易与水相混和例1、向盐酸中不断地加入下列物质,溶液的pH值变化符合下图的是( )。
A. Zn pH
B. AgNO3 7
C. NaOH
D. NaCl 所加物质C例2、食醋是醋酸的稀溶液,某同学准备在家
中进行验证食醋具有酸的某一条通性的实验,他选择了下列物质,其中不能达到目的的是( )。
A. 木炭 B. 大理石
C. 铁钉 D. 铁锈 A例3:试用两种方法除去混在铜粉中的少量铁粉,简述过程。方法一:加入足量的盐酸,使铁粉充分反应,Fe+2HCl===FeCl2 +H2 ↑。铜粉与盐酸不反应,待铁粉反应完全后过滤,滤纸上留下的固体物质为铜,洗涤、干燥即可得到纯净的铜粉。方法二:加入足量的硫酸铜溶液,,使铁粉充分反应,Fe+CuSO4===FeSO4+Cu 。将杂质铁全部转化为铜,既没有增加新的杂质,又将杂质除去而转化为纯净物,待铁粉反应完全后过滤,将滤纸上留下的铜洗涤、干燥即可得到纯净的铜粉。例4:某工厂化验室用质量分数为10%的NaOH溶液洗涤一定量石油产品中的残余H2SO4共消耗这种溶液40g,洗涤后残留溶液呈中性,问这种石油产品中含多少克H2SO4 ? 80 98
40g×10% x解:设这一定量石油产品中的含H2SO4的质量为x。2NaOH + H2SO4 === Na2SO4 + 2H2O 80 98
40g×10% xx=4.9g答:这些石油产品中含H2SO4 4.9克。1、盐酸在工农业生产和日常生活中用途很大。下列各项用途是利用盐酸的哪些性质?试写出有关反应的化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)制革工业中用熟石灰脱毛后,剩余的熟石灰[Ca(OH)2]用盐酸来除去。
(3)用稀盐酸清除锅炉中的水垢[主要成分为CaCO3,和Mg(OH)2]。
2、怎样鉴别3瓶分别盛有水、稀盐酸、稀硫酸的无色液体?
3、向稀盐酸中滴加石蕊试液,溶液显______色,稀盐酸的PH______7(填<、>、=)
4、鉴定某酸溶液为盐酸时需用试剂是:______
出示一个青桔子,同学们:当你看到它的即时感受是什么?――酸你能说出生活中有哪些东西是酸的? 苹果、橘子、葡萄、梨子、梅、杏、醋、酸奶、放置时间过长的面包等。食醋中有醋酸柠檬、柑橘等水果中含有柠檬酸汽车用铅蓄电池中含有硫酸一、那么酸是怎样的一类物质呢?电离:HCl = H+ + Cl-H+H+H+一些物质溶解于水或受热熔化时,而离解成
自由移动的离子的过程,叫做电离。
电离方程式NaCl== Na+ + Cl-
KNO3 == K+ + NO3-
NaOH == Na+ + OH-
Na2SO4 == 2Na+ + SO42-注意1、在电离过程中,原子团不拆散,离解发生在正价元素(或原子团)与负价元素(或原子团)两者连接处。
2、离子所带电荷数等于元素或原子团的化合价数。
3、所有阳离子带的正电荷总数和所有阴离子带的负电荷总数是相等的。一些物质电离时产生的阴阳离子所带电荷的总数一定相等。所以,这些物质的溶液不显电性。电离方程式书写时,不必写条件,但要配平,使电荷总数,而原子团不能拆开。注意:常见的酸盐酸:
硝酸:
硫酸:HCI === H + + CI-电离方程式:H NO3 === H + + NO3-H2SO4 == 2H + + SO 42-
酸:电离时产生的阳离子全部是氢离子的化合物.讨论1:NaHSO4=Na++H++SO42-
NaHSO4是不是一种酸?
电离通式:酸= H+ + 酸根阴离子我们把某种酸电离产生的阴离子叫做这中酸的酸根离子,如SO42-是H2SO4的酸根。 酸根离子所带负电荷的总数等于酸分子电离时生成的氢离子的总数日常生活中常见的酸胃液——盐酸
醋——醋酸
汽水饮料——碳酸、柠檬酸
牛奶发酵——乳酸
山渣、柑橘、柠檬——有机酸练习:
1、下列电离方程式正确的是( )
A、H2SO4 =H+ + SO42-
B、 Al2(SO4)3 = 2Al3++ 3SO4 2 -
C、 Ba(OH)2= Ba 2+ + (OH)-
D、NaCl=Na1+ +Cl1-
B2、写出下列物质的电离方式:
H2CO3 =
Ca(OH)2 =
Na2CO3 =
CuSO4 =
BaCl2 =
NaHSO4 =
在实验室我们用什么方法能简单而 快速地知道哪一种溶液是酸性的呢?用PH试纸思考: pH<7,酸性,
pH =7,中性;
pH>7,碱性
那么,你知道还有什么方法可以测 定物质的酸碱性?酸碱指示剂二、酸碱指示剂1、定义:在酸或碱溶液里能显示出不同颜色的物质。2、常见的指示剂有:紫色石蕊试液无色酚酞试液红色无色红色不变色蓝色红色不变色蓝色常用指示剂及其在酸性、碱性溶液中的颜色演示:1.用玻璃棒分别取少许水、酸果汁、白醋、 盐酸,滴在pH试纸中部,观察试纸的颜色变化.
2.在白色点滴板的空穴里分别滴入几滴上述样品,再滴加2-3滴紫色石蕊试液,观察其颜色的变化, 并将结果填入表中.结论:pH试纸能显示酸性的强弱,而指示剂则只能指示溶液是否显酸性或碱性。不变色变红色变红色变红色3174那么你会自制酸碱指示剂吗?
许多植物的花果茎叶中都含有某些显色的物质,它们在酸性溶液或碱性溶液里会显示不同的颜色.方法是取这些植物的花果枝叶切碎捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂. 红某些花浸出液的变色情况练习:
1、某无色溶液PH=2,该溶液呈 性,它能使紫色石蕊试液变 ,无色酚酞试液 ,使蓝色石蕊试纸变 。酸红色不变色红色2、下列物质中存在着能自由移动的氯离子的是---------( )
A、液态氯化氢; B、KCl晶体;
C、KClO3溶液; D、熔化的MgCl2
3、下列各组离子属于酸的电离的是…( )
A、H+、SO42-、Na+ B、OH-、Ba2+
C、H+、NO3- D、Na+、HCO3-实验二:往锌粒中加入稀盐酸盐酸能跟某些金属反应
反应方程式:
Zn + 2HCl = ZnCl2 + H2三、酸有哪些性质实验三:
酸与某些金属氧化物反应生成盐和水
往带锈铁钉中滴入稀盐酸溶液Fe2O3 + 6HCl = 2FeCl3 +3H2O
CuO+2HCl=CuCl2+H2O Al(OH)3 + HCl = + H2O
利用盐酸跟碱反应可以减少胃中盐酸的 含量。AlCl3实验四:往酚酞NaOH溶液中滴入稀盐酸溶液NaOH+HCl==NaCl+H2O实验五 :将鸡蛋壳放入盛有盐酸的试管
中,将燃着的火柴深入试管口CaCO3+2HCl==CaCl2+H2O+CO21、盐酸的性质酸对指示剂的作用酸跟金属的反应酸跟碱性氧化物的反应(一)物理性质 纯净的盐酸无色,有刺激性气味。工业盐酸因含杂质而带黄色。浓盐酸在空气中易挥发,与水蒸气形成酸雾。(二)化学性质(1)使紫色石蕊试液变红,无色酚酞不变色(2)跟金属反应Zn + 2HCl ==== ZnCl2 + H2 ↑Fe + 2HCl ==== FeCl2 + H2 ↑ (3)跟金属氧化物反应 CuO + 2HCl ==== CuCl2 + H2OFe2O3 + 6HCl ==== 2FeCl3 + 3H2O(4)跟碱反应Cu(OH)2+ 2HCl ==== CuCl2 + 2H2O(5)跟硝酸银反应AgNO3 + HCl ==== AgCl ↓+ HNO3可用于检验Cl-的存在。(1)金属表面除锈(2)制试剂或药品(3)胃液中帮助消化 (四)复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应化合物+化合物===两种新的化合物(三)盐酸的用途稀硫酸石蕊实验六:往稀硫酸中加入石蕊演示完毕,欲重复动画,请先
按PageUp,再单击鼠标左键结论
稀硫酸可使石蕊指示剂变红 特性:吸水性——干燥剂
脱水性
腐蚀性强
氧化性2、硫酸(H2SO4)
(一)浓硫酸 无色、黏稠、油状的液体,不易挥发,密度比水大,常用的浓硫酸中H2SO4的质量分数为98%。浓硫酸的腐蚀性浓硫酸的吸水性浓硫酸的脱水性吸水性脱水性 浓硫酸溶于水时放出大量的热,稀释浓硫酸时,一定要把沿着器壁慢慢地注入水中,(注意:不断搅动,使产生的热量迅速扩散。切不可把水倒进浓硫酸里) (二)浓硫酸的稀释 稀释浓硫酸的方法 (三)稀硫酸 H2SO4 ====2H+ + SO42- (1)能使紫色石蕊试液变红,无色酚
酞试液不变色(2)跟金属反应
Zn + H2SO4 ==== ZnSO4 + H2 ↑
Fe + H2SO4 ==== FeSO4 + H2 ↑ (3)跟金属氧化物反应
Fe2O3+3H2SO4 ==== Fe2 ( SO4 )3+3H2O
CuO+H2SO4 ==== Cu SO4 +H2O (4)跟碱反应
Cu( OH )2 +H2SO4 ==== Cu SO4 +3H2O(5)跟氯化钡(盐)反应
BaCl2 + H2SO4 ==== BaSO4 ↓ + 2HCl
此反应是用于检验硫酸和其他电离时能产生SO42-的化合物的特性反应(1)化工原料(农药、化肥、火药、染料)(2)冶炼有色金属,精炼石油(3)金属除锈 (四)硫酸的用途(二)化学性质 HNO3====H+ + NO3-3、硝酸(HNO3)
(一)物理性质 无色、有刺激性气味的液体,易挥发,在空气中与水蒸气形成酸雾。(1)能使紫色石蕊试液变红,无色酚酞
试液不变色(2)跟金属反应,产物很复杂,不产生H2 (3)跟金属氧化物反应
CuO + 2HNO3 ==== Cu (NO3)2 + H2O
ZnO + 2HNO3 ==== Zn (NO3)2 + H2O (4)跟碱反应
Mg( OH)2 + HNO3 ====Mg(NO3)2+3H2O(5)跟盐反应
CaCO 3 + 2HNO3 ==== Ca (NO3)2 +H2O+ CO2 ↑3、硝酸的用途
化工原料(化肥、染料、炸药)酸有哪些共同的化学性质?酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______ 例1:下列几种溶液装入敞口容器里,久置于空气中成分不变,但溶液的质量减少,且溶液中溶质的质量分数变小的是( )
A. 浓盐酸 B. 澄清石灰水
C. 浓硝酸 D. 浓硫酸A.C例2:下列叙述中,能够确定某物质一定是酸的是( )
A. 能使石蕊试液变红的溶液
B. 不能使酚酞试液变红的溶液
C. 能与活泼金属反应放出氢气的物质
D. 电离出的阳离子全部是氢离子的溶液
D例3:在稀硫酸中加入下列哪种物质,溶液的导电性会出现如图所示的变化( )
A. Ag
B. Ba(NO3)2
C. BaCl2
D. Ba(OH)2 所加物质质量 D导电性练习
1、将浓盐酸、浓硫酸、浓硝酸敞口放置一段时间,它们共同的变化是( )
(A)颜色发生改变
(B)发生化学变化
(C)质量变小
(D)溶质质量分数变小 D 2、盐酸和硫酸常用做金属表面的清洁剂,是利用了它们化学性质中的( ) (A)能与碱反应 (B)能与金属反应 (C)能与金属氧化物反应 (D)能与石蕊试液反应 C 3、一种无色溶液能BaCl 2溶液反应,生成不溶于HNO3的白色沉淀,则此无色溶液为( )
(A)一定是AgNO3溶液 (B)一定是稀H2SO4 (C)一定是可溶性的含SO42-的物质 (D)无法判断 D 1. 有两瓶试液: 稀 盐酸和氢氧化钠, 你如何来鉴别?思考2. 有两瓶试液: 稀盐酸和稀硫酸,
如何来鉴别?思考 如何证明无色溶液是
稀盐酸?酸的个性:浓盐酸的物理性质浓盐酸在空气里会生成白雾
浓盐酸有挥发性
工业浓盐酸常因含有杂质 而带黄色
浓硫酸H2SO4的物理性质纯净的浓硫酸是无色、粘稠、油状的液体,不容易挥发。常用的浓硫酸中H2SO4的质量分数是98%,
浓硫酸的个性1.浓硫酸具有强腐蚀性。【思考】如果浓硫酸不慎溅到皮肤上,应怎样处理?要先用干布拭去,然后用大量水
冲去,最后用小苏打溶液
冲洗。严重时应立即送医院.结论:2、浓硫酸具有脱水性。能使木材、纸张脱水碳化 3、浓硫酸具有吸水性,可做干燥剂。三、
硫酸的个性能干燥哪些气体呢?干燥剂与被干燥的气体不能发生反应。干燥氧气、氢气、
二氧化碳浓硫酸的稀释实验 【分析】由于水的密度较小,水流进浓硫酸时浮在硫酸上面,硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。导致事故发生。 【思考】为什么切不可把水倒入浓硫酸中稀释? 三、
硫酸的个性【三强酸的个性】硝酸 浓硝酸有很强
腐蚀性
挥发性【思考与讨论】
三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?【讨论与交流】你还认识哪些酸?
它们有哪些特性巩固与拓展磷酸H3PO4:纯品为无色透明粘稠状液体或斜方晶体,无臭,味很酸。性质相对稳定,挥发性小;酸性中等。
醋酸CH3COOH:无色的液体,酸味很浓, 容易与水相混和例1、向盐酸中不断地加入下列物质,溶液的pH值变化符合下图的是( )。
A. Zn pH
B. AgNO3 7
C. NaOH
D. NaCl 所加物质C例2、食醋是醋酸的稀溶液,某同学准备在家
中进行验证食醋具有酸的某一条通性的实验,他选择了下列物质,其中不能达到目的的是( )。
A. 木炭 B. 大理石
C. 铁钉 D. 铁锈 A例3:试用两种方法除去混在铜粉中的少量铁粉,简述过程。方法一:加入足量的盐酸,使铁粉充分反应,Fe+2HCl===FeCl2 +H2 ↑。铜粉与盐酸不反应,待铁粉反应完全后过滤,滤纸上留下的固体物质为铜,洗涤、干燥即可得到纯净的铜粉。方法二:加入足量的硫酸铜溶液,,使铁粉充分反应,Fe+CuSO4===FeSO4+Cu 。将杂质铁全部转化为铜,既没有增加新的杂质,又将杂质除去而转化为纯净物,待铁粉反应完全后过滤,将滤纸上留下的铜洗涤、干燥即可得到纯净的铜粉。例4:某工厂化验室用质量分数为10%的NaOH溶液洗涤一定量石油产品中的残余H2SO4共消耗这种溶液40g,洗涤后残留溶液呈中性,问这种石油产品中含多少克H2SO4 ? 80 98
40g×10% x解:设这一定量石油产品中的含H2SO4的质量为x。2NaOH + H2SO4 === Na2SO4 + 2H2O 80 98
40g×10% xx=4.9g答:这些石油产品中含H2SO4 4.9克。1、盐酸在工农业生产和日常生活中用途很大。下列各项用途是利用盐酸的哪些性质?试写出有关反应的化学方程式。
(1)电镀前用盐酸清洗钢铁表面的铁锈。
(2)制革工业中用熟石灰脱毛后,剩余的熟石灰[Ca(OH)2]用盐酸来除去。
(3)用稀盐酸清除锅炉中的水垢[主要成分为CaCO3,和Mg(OH)2]。
2、怎样鉴别3瓶分别盛有水、稀盐酸、稀硫酸的无色液体?
3、向稀盐酸中滴加石蕊试液,溶液显______色,稀盐酸的PH______7(填<、>、=)
4、鉴定某酸溶液为盐酸时需用试剂是:______
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
