专题2.2.2分子的立体构型(2)-同步巩固2017-2018学年高二化学人教版(选修3)
文档属性
| 名称 | 专题2.2.2分子的立体构型(2)-同步巩固2017-2018学年高二化学人教版(选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-04 15:41:37 | ||
图片预览



文档简介
第二章 分子结构与性质
第二节 分子的立体构型
第2课时 分子的立体构型(2)
一、杂化轨道理论简介
1.杂化轨道理论
杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体构型提出的。
(1)轨道的杂化
在形成多原子分子时,中心原子价电子层上的某些 _____________________发生混杂,重新组合成一组新的轨道的过程。
注意:双原子分子中不存在杂化过程。
(2)杂化轨道
杂化后形成的新的能量相同的一组原子轨道,叫做杂化原子轨道,简称杂化轨道。
2.杂化轨道的类型
(1)sp3杂化
sp3杂化轨道是由1个s轨道和3个p轨道杂化而得。sp3杂化轨道间的夹角是________,立体构型为正四面体形。如图1所示。
图1
CH4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同。于是1个2s轨道和3个2p轨道混杂起来,形成能量相等、成分相同的4个sp3杂化轨道(其中每个杂化轨道中s成分占1/4,p成分占3/4),如图2所示。
图2 CH4分子中碳原子的杂化
4个sp3杂化轨道上的电子间相互排斥,使4个杂化轨道指向空间距离最远的正四面体的4个顶点,碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道形成4个C—H σ键,从而形成CH4分子。由于4个C—H键完全相同,所以形成的CH4分子为正四面体形,键角是109°28',如图3所示。
图3
(2)sp2杂化
sp2杂化轨道是由1个s轨道和两个p轨道混杂而成的。sp2杂化轨道间的夹角是_______,呈平面三角形(如图4所示)。
图4 sp2杂化
BF3分子的形成过程:硼原子的电子排布式为1s22s22,硼原子的1个2s电子激发到1个空的2p轨道中,使硼原子的电子排布式为1s22s122。硼原子的2s轨道和两个2p轨道混杂成3个sp2杂化轨道,硼原子的3个sp2杂化轨道分别与3个氟原子的各1个2p轨道重叠形成3个sp2?p σ键,由于3个sp2杂化轨道在同一平面上,而且夹角为120°,所以BF3分子具有平面三角形结构(如图5所示)。
图5 硼原子的杂化轨道和BF3分子的结构示意图
(3)sp杂化
sp杂化轨道是由1个s轨道和1个p轨道混杂而成的。sp杂化轨道间的夹角是180°,呈__________(如图6所示)。
图6
气态BeCl2分子的形成过程:铍原子的电子排布式是1s22s2,Be的1个2s电子激发进入空的2p轨道,经过杂化形成两个sp杂化轨道,与氯原子中的3p轨道重叠形成两个sp?p σ键。由于杂化轨道间的夹角为180°,所以形成的BeCl2分子的立体构型是直线形(如图7所示)。
图7 铍原子的杂化轨道和BeCl2分子的结构示意图
3.杂化轨道类型与分子的立体构型的关系
(1)杂化轨道还能用于形成σ键和容纳孤电子对,当没有孤电子对时,能量相同的杂化轨道在空间彼此远离,形成的分子为对称结构;当有孤电子对时,孤电子对占据一定空间且对成键电子对产生________,形成的分子空间构型也发生变化。
(2)杂化轨道与分子立体构型的关系
杂化方式
等性杂化
不等性杂化
sp
sp2
sp3
sp3
轨道间的夹角
180°
120°
109°28'
——
——
中心原子上的
孤电子对数
0
0
0
1
2
分子立体构型
直线形
平面三角形
正四面体形
三角锥形
V形
实例
BeCl2、HgCl2
BF3
CH4、SiCl4
NH3、PH3
H2O、H2S
二、配合物理论简介
1.配位键
(1)概念:成键的两个原子或离子一方提供____________ (配体),一方提供空轨道而形成的共价键,叫做配位键。
(2)配体:应含有孤电子对,可以是分子,也可以是离子,如NH3、H2O、F?、OH?等。
(3)成键条件:形成配位键的一方是能够提供孤电子对的原子,另一方是具有能够接受孤电子对的空轨道的原子。
(4)配位键的表示方法:
A → B
电子对给予体 电子对接受体
H3O+的结构式:+,的结构式:+。
2.配合物
(1)概念
_______________与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
(2)配合物的形成
实验操作
实验现象
有关离子方程式
滴加氨水后,试管中首先出现__________,氨水过量后沉淀逐渐____,滴加乙醇后析出__________色晶体[Cu(NH3)4]SO4·H2O
溶液颜色
_________
上述实验现象产生的原因主要是配离子的形成。以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的________进入Cu2+的__________,Cu2+与NH3分子中的氮原子通过________________________形成配位键。配离子[Cu(NH3)4]2+可表示为。
(3)配合物的组成
配合物由中心原子(提供空轨道)和配体(提供孤电子对)组成,分为_________,以[Cu (NH3)4] SO4为例表示为:
3.配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氯化物、溴化物、碘化物、氰化物,可以依次溶解于含过量的Cl?、Br?、I?、CN?和氨的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN?形成铁的硫氰酸根配离子,其溶液显红色。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
【答案】一、1.(1)能量相近的原子轨道
2.(1)109°28' (2)120° (3)直线形 3.(1) 排斥
二、1.(1)孤电子对
2.(1)金属离子(或原子)
(2)(从左到右,从上到下)蓝色沉淀 溶解 深蓝 Cu2++2NH3·H2O===Cu(OH)2↓+2、Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH- 变血红色 Fe3++3SCN-===Fe(SCN)3 孤电子对 空轨道 共用氮原子提供的孤电子对
(3)内界和外界
一、杂化轨道类型的判断方法
1.根据杂化轨道数判断
对于ABm型分子(或离子)(A为中心原子,B为配位原子),中心原子的价层电子对数(用n表示)即为其杂化轨道数。可先确定分子或离子的VSEPR模型,然后就可以确定中心原子的杂化轨道类型。若n=4,则中心原子为sp3杂化;若n=3,则中心原子为sp2杂化;若n=2,则中心原子为sp杂化。如、的n均为4,所以氯原子均采用sp3杂化(但离子的空间构型不同,从价层电子对互斥模型来看,前者为三角锥形,后者为正四面体形)。
2.根据杂化轨道间的夹角判断
不同的杂化方式,其杂化轨道之间的夹角不同,所以可根据杂化轨道间的夹角判断分子或离子的杂化类型。
(1)若杂化轨道之间的夹角为109°28',则分子的中心原子采用sp3杂化;
(2)若杂化轨道之间的夹角为120°,则分子的中心原子采用sp2杂化;
(3)若杂化轨道之间的夹角为180°,则分子的中心原子采用sp杂化。
3.取代法
以中学常见的、熟悉的物质分子为基础,用其他原子或原子团取代分子中的部分原子或原子团,得到的新分子的中心原子与原分子对应的中心原子的杂化类型相同。如:
(1)CH3CH=CH2分子中碳原子的杂化类型的判断,可看作乙烯基取代了甲烷分子中的一个氢原子,则甲基中碳原子为sp3杂化,也可看作甲基取代了乙烯分子中的一个氢原子,故两个不饱和碳原子均为sp2杂化;
(2)(CH3)3N可看作三个甲基取代了NH3分子中的三个氢原子而得,所以其分子中氮原子采用sp3杂化;
(3)H2O2可看作羟基取代了H2O分子中一个氢原子,H2O2中氧原子应为sp3杂化;
(4)B(OH)3可看作三个羟基取代了BF3中的氟原子,可知B(OH)3中硼原子为sp2杂化。
4.根据共价键类型判断
从杂化轨道理论可知,原子之间成键时,未杂化轨道形成π键,杂化轨道形成σ键。对于能够明确结构式的分子、离子,可直接用下式判断其中心原子的杂化轨道类型:
杂化轨道数n=中心原子的σ键数+中心原子的孤电子对数(多重键中只有一个σ键,其余均为π键)
(1)SiF4分子中硅原子轨道杂化类型分析,基态硅原子有4个价电子,与4个氟原子恰好形成4个键,无未成键电子,n=4,则SiF4分子中硅原子采用sp3杂化。
(2)基态碳原子有4个价电子,在HCHO分子中,碳原子与2个氢原子形成2个σ键,与氧原子形成C=O键,C=O键中有1个σ键、1个π键,碳原子无剩余价电子,n=3,则HCHO分子中碳原子采用sp2杂化。
5.等电子原理的应用
等电子体具有相同的结构特征,一般来说等电子体的中心原子的杂化类型相同。对于结构模糊或复杂的分子、离子,可将其转化成熟悉的等电子体,然后进行判断。如、H2B=NH2分别与CO2、CH2=CH2互为等电子体,而CO2、CH2=CH2中心原子碳原子分别为sp、sp2杂化,则的中心原子氮原子为sp杂化,H2B=NH2的中心原子硼、氮原子均为sp2杂化。
(1)杂化轨道数=价层电子对数。
(2)杂化轨道类型与杂化轨道数的关系:sp—2、sp2—3、sp3—4。
(3)CO2分子中的碳原子形成双键,但碳原子不是采用sp2杂化(易错),CO2中碳原子采用sp杂化。
试判断下列分子中心原子的杂化类型:
(1)NI3 (2)CH3Cl (3)CO2 (4)SO2
【答案】(1)sp3杂化 (2)sp3杂化 (3)sp杂化 (4)sp2杂化
【点评】(1)杂化方式的判断是一个难点,要注意积累经验,原子间形成的共价键,既包括σ键,也包括π键及大π键。
(2)根据最大重叠原理,中心原子与每个配位原子之间只能形成一个σ键,除此之外,其价电子只能形成π键或大π键。
二、配位键的理解
(1)配位键是一种特殊的共价键。配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
(2)配位键的形成条件
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
下列不能形成配位键的组合是
A.Ag+、NH3 B.H2O、H+
C.Co3+、CO D.Ag+、H+
【答案】D
三、配合物
1.形成配合物的原理
形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。当配体接近中心原子(离子)时,为了增加成键能力,中心原子(离子)用能量相近的空轨道杂化,配体的孤电子对填到中心原子(离子)已杂化的空轨道中形成配离子。配离子的立体构型、配位数及稳定性等主要决定于杂化轨道的数目和类型。
2.常见的能形成配合物的粒子
(1)常见的含孤电子对的配体:分子如CO、NH3、H2O等;离子如Cl?、CN?、等。
(2)常见的可提供空轨道的中心原子。通常是过渡元素的离子或原子,如Cu2+、Ag+、Fe3+、Fe、Ni等。
下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为Br? B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化 D.中心离子的化合价为+2
【答案】B
1.有关杂化轨道的说法不正确的是
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释
D.杂化轨道全部参与形成化学键
2.下列关于配位化合物的叙述中不正确的是
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
3.下列关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
4.能正确表示CH4中碳原子的成键方式的示意图为
5.下列各组分子中所有原子都可能处于同一平面的是
A.CH4、CS2、BF3 B.CO2、H2O、NH3
C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
6.向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是
A.开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B.Cu(OH)2溶于浓氨水的离子方程式是Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?
C.开始生成蓝色沉淀,加入氨水后,沉淀溶解形成深蓝色溶液
D.开始生成Cu(OH)2,之后生成更稳定的配合物
7.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
在Xm-中,硼原子轨道的杂化类型有________________;配位键存在于____________原子之间(填原子的数字标号);m=____________(填数字)。
8.四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素
A
B
C
D
性质结构信息
原子核外有两个电子层,最外层有3个未成对的电子
原子的M层有1对成对的p电子
原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价
有两种常见氧化物,其中有一种是冶金工业常用的还原剂
(1)写出B原子的电子排布式________。
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________,简要描述该配合物中化学键的成键情况:______________________。
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是______(填序号);在②的分子中有________个σ键和________个π键。
9.(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为______________,第二种配合物的结构式为_______,如果在第二种配合物溶液中滴加AgNO3溶液时,产生__________________现象。
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下图,其中配位键和氢键均采用虚线表示。
①写出基态Cu原子的核外电子排布式______________。
②写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应,如:①CH2=CH2,②CH≡CH,③
④HCHO等,其中碳原子采取sp2杂化的分子有__________(填物质序号),预测HCHO分子的立体结构为__________形。
1.【答案】D
【解析】杂化轨道可以部分参与形成化学键,如NH3中N发生了sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键。
2.【答案】B
【解析】配位化合物中一定含有配位键,但也含有其他化学键;Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键。
3.【答案】C
4.【答案】D
【解析】碳原子的2s轨道与2p轨道形成4个等性的杂化轨道,因此碳原子4个价电子分占在4个sp3杂化轨道上,且自旋状态相同。
5.【答案】C
【解析】题中的CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子的所有原子不可能都在同一平面上。CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子都是平面形结构。故选C项。
6.【答案】A
【解析】向CuCl2溶液中加入少量NaOH溶液,发生反应Cu2++2OH?Cu(OH)2↓,Cu(OH)2沉淀为蓝色,再加入适量浓氨水,发生反应Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?,形成深蓝色溶液,故A错误。
7.【答案】sp2、sp3 4、5(或5、4) 2
【解析】由硼砂模型知1、3、5、6均代表氧原子,2、4代表B原子,利用中心原子价电子对数n=σ键数+孤电子对数,如果n=2则为sp杂化,n=3则为sp2杂化。由于2号B形成3个σ键且无孤电子对,故B原子为sp2杂化,4号B形成4个σ键,则B原子为sp3杂化;B原子提供空轨道,O原子提供孤电子对,故4、5(或5、4)原子之间形成配位键。由阴离子的组成可知,Xm-为[H4B4O9]m-,得出m=2。
8.【答案】(1)1s22s22p63s23p4
(2)[Cu(NH3)4]SO4 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合
(3)①③④ 3 2
9.【答案】(1)[Co(NH3)5Br] SO4 [Co (SO4) (NH3)5] Br 淡黄色沉淀
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1
②
(3)①③④ 平面三角
【解析】由实验可知,第一种配合物的外界为,第二种配合物的外界不含有。铜处于ds区,d轨道处于全满状态。从所给的结构判断出每个Cu2+与4个H2O分子形成配位化合物。在写配离子时注意用箭头指向提供空轨道的原子。乙烯、苯、甲醛中的碳原子均采取sp2杂化,所有原子均共平面(苯中还有一个大π键)。
原子结构
物质的性质决定于结构,归根溯源,还是由每种元素原子的得失电子能力决定的。——别相信那么多告诉你怎样快速成功的技巧宝典,最终,决定一切的依然是实力,人与人之间也是如此。随着原子序数增大,核外电子数增加,你可以找到越来越容易失电子的原子,却找不到更容易得电子的原子了。——得到了很多的人,或者说能够认识到自己已经得到了很多的人,总是更容易明白施比受有福。
第二节 分子的立体构型
第2课时 分子的立体构型(2)
一、杂化轨道理论简介
1.杂化轨道理论
杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体构型提出的。
(1)轨道的杂化
在形成多原子分子时,中心原子价电子层上的某些 _____________________发生混杂,重新组合成一组新的轨道的过程。
注意:双原子分子中不存在杂化过程。
(2)杂化轨道
杂化后形成的新的能量相同的一组原子轨道,叫做杂化原子轨道,简称杂化轨道。
2.杂化轨道的类型
(1)sp3杂化
sp3杂化轨道是由1个s轨道和3个p轨道杂化而得。sp3杂化轨道间的夹角是________,立体构型为正四面体形。如图1所示。
图1
CH4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同。于是1个2s轨道和3个2p轨道混杂起来,形成能量相等、成分相同的4个sp3杂化轨道(其中每个杂化轨道中s成分占1/4,p成分占3/4),如图2所示。
图2 CH4分子中碳原子的杂化
4个sp3杂化轨道上的电子间相互排斥,使4个杂化轨道指向空间距离最远的正四面体的4个顶点,碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道形成4个C—H σ键,从而形成CH4分子。由于4个C—H键完全相同,所以形成的CH4分子为正四面体形,键角是109°28',如图3所示。
图3
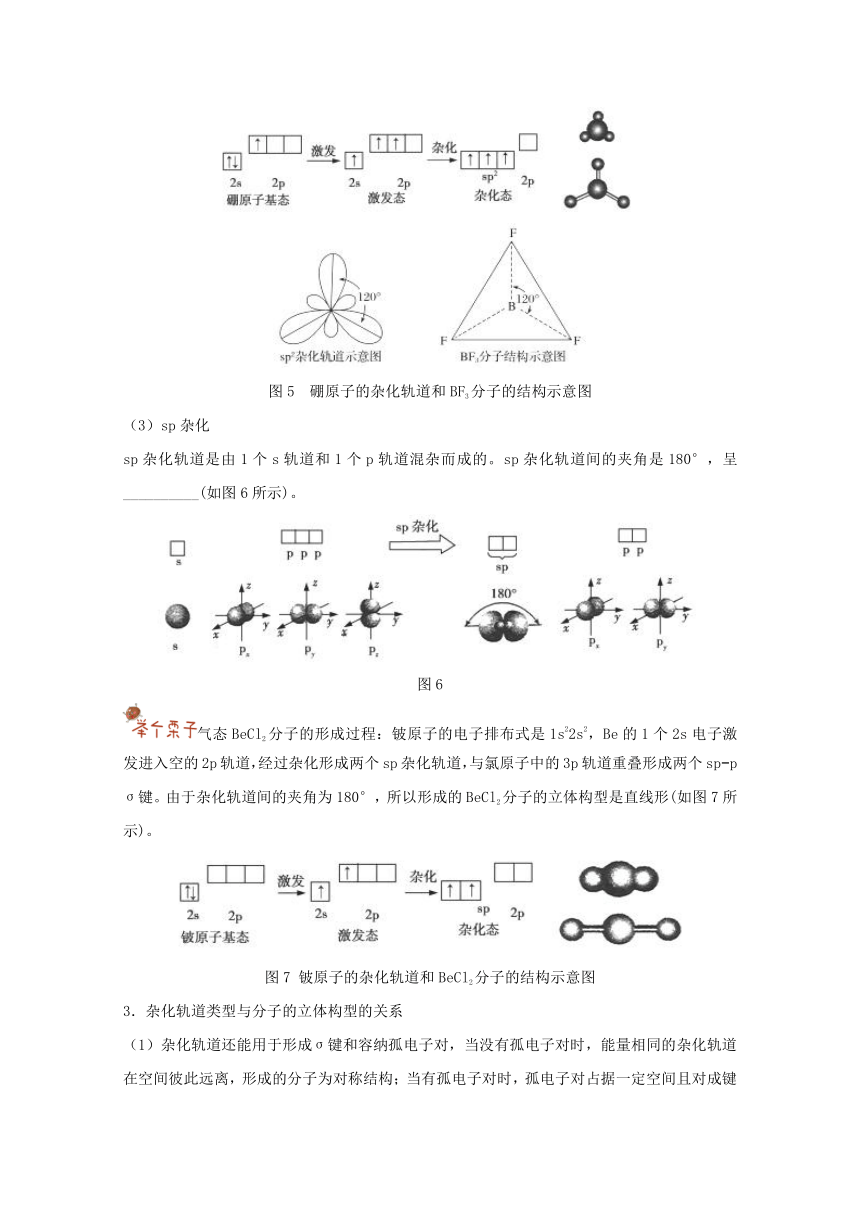
(2)sp2杂化
sp2杂化轨道是由1个s轨道和两个p轨道混杂而成的。sp2杂化轨道间的夹角是_______,呈平面三角形(如图4所示)。
图4 sp2杂化
BF3分子的形成过程:硼原子的电子排布式为1s22s22,硼原子的1个2s电子激发到1个空的2p轨道中,使硼原子的电子排布式为1s22s122。硼原子的2s轨道和两个2p轨道混杂成3个sp2杂化轨道,硼原子的3个sp2杂化轨道分别与3个氟原子的各1个2p轨道重叠形成3个sp2?p σ键,由于3个sp2杂化轨道在同一平面上,而且夹角为120°,所以BF3分子具有平面三角形结构(如图5所示)。
图5 硼原子的杂化轨道和BF3分子的结构示意图
(3)sp杂化
sp杂化轨道是由1个s轨道和1个p轨道混杂而成的。sp杂化轨道间的夹角是180°,呈__________(如图6所示)。
图6
气态BeCl2分子的形成过程:铍原子的电子排布式是1s22s2,Be的1个2s电子激发进入空的2p轨道,经过杂化形成两个sp杂化轨道,与氯原子中的3p轨道重叠形成两个sp?p σ键。由于杂化轨道间的夹角为180°,所以形成的BeCl2分子的立体构型是直线形(如图7所示)。
图7 铍原子的杂化轨道和BeCl2分子的结构示意图
3.杂化轨道类型与分子的立体构型的关系
(1)杂化轨道还能用于形成σ键和容纳孤电子对,当没有孤电子对时,能量相同的杂化轨道在空间彼此远离,形成的分子为对称结构;当有孤电子对时,孤电子对占据一定空间且对成键电子对产生________,形成的分子空间构型也发生变化。
(2)杂化轨道与分子立体构型的关系
杂化方式
等性杂化
不等性杂化
sp
sp2
sp3
sp3
轨道间的夹角
180°
120°
109°28'
——
——
中心原子上的
孤电子对数
0
0
0
1
2
分子立体构型
直线形
平面三角形
正四面体形
三角锥形
V形
实例
BeCl2、HgCl2
BF3
CH4、SiCl4
NH3、PH3
H2O、H2S
二、配合物理论简介
1.配位键
(1)概念:成键的两个原子或离子一方提供____________ (配体),一方提供空轨道而形成的共价键,叫做配位键。
(2)配体:应含有孤电子对,可以是分子,也可以是离子,如NH3、H2O、F?、OH?等。
(3)成键条件:形成配位键的一方是能够提供孤电子对的原子,另一方是具有能够接受孤电子对的空轨道的原子。
(4)配位键的表示方法:
A → B
电子对给予体 电子对接受体
H3O+的结构式:+,的结构式:+。
2.配合物
(1)概念
_______________与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。
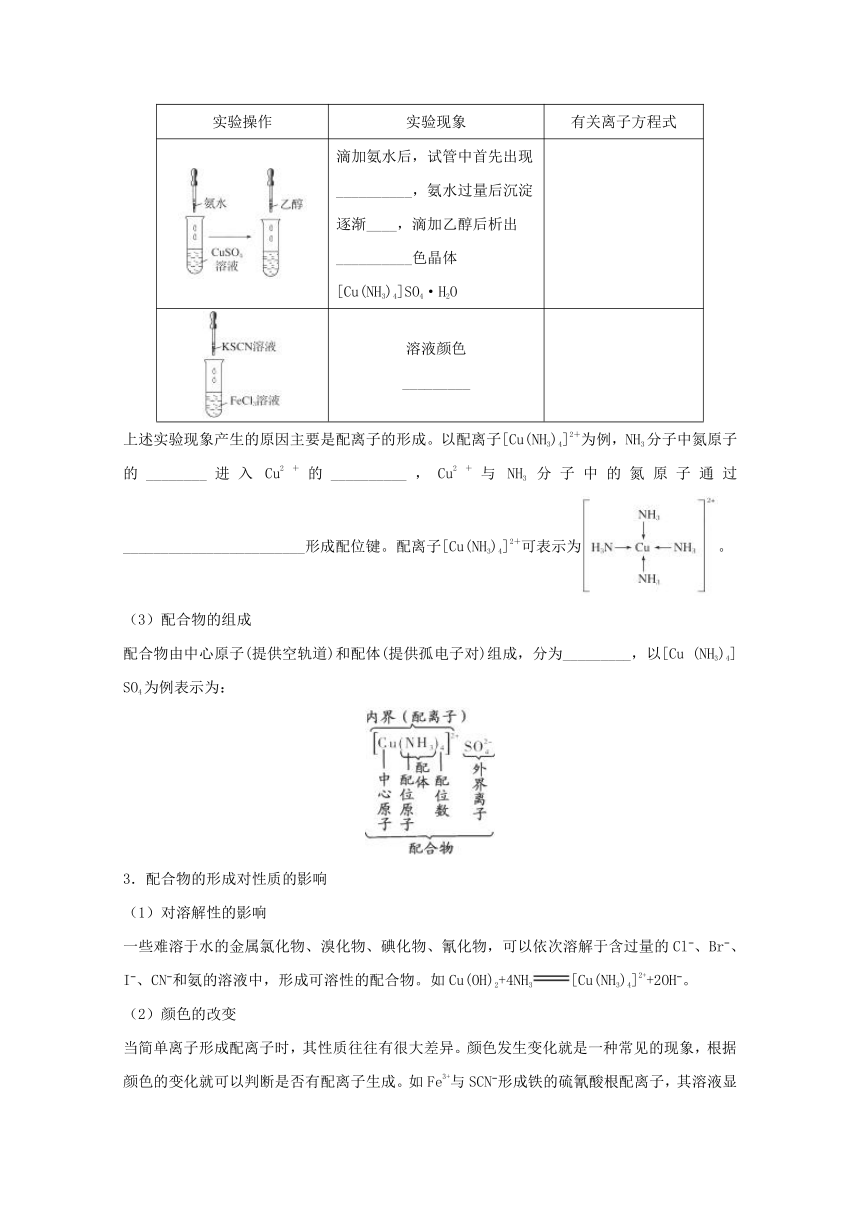
(2)配合物的形成
实验操作
实验现象
有关离子方程式
滴加氨水后,试管中首先出现__________,氨水过量后沉淀逐渐____,滴加乙醇后析出__________色晶体[Cu(NH3)4]SO4·H2O
溶液颜色
_________
上述实验现象产生的原因主要是配离子的形成。以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的________进入Cu2+的__________,Cu2+与NH3分子中的氮原子通过________________________形成配位键。配离子[Cu(NH3)4]2+可表示为。
(3)配合物的组成
配合物由中心原子(提供空轨道)和配体(提供孤电子对)组成,分为_________,以[Cu (NH3)4] SO4为例表示为:
3.配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氯化物、溴化物、碘化物、氰化物,可以依次溶解于含过量的Cl?、Br?、I?、CN?和氨的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN?形成铁的硫氰酸根配离子,其溶液显红色。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
【答案】一、1.(1)能量相近的原子轨道
2.(1)109°28' (2)120° (3)直线形 3.(1) 排斥
二、1.(1)孤电子对
2.(1)金属离子(或原子)
(2)(从左到右,从上到下)蓝色沉淀 溶解 深蓝 Cu2++2NH3·H2O===Cu(OH)2↓+2、Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH- 变血红色 Fe3++3SCN-===Fe(SCN)3 孤电子对 空轨道 共用氮原子提供的孤电子对
(3)内界和外界
一、杂化轨道类型的判断方法
1.根据杂化轨道数判断
对于ABm型分子(或离子)(A为中心原子,B为配位原子),中心原子的价层电子对数(用n表示)即为其杂化轨道数。可先确定分子或离子的VSEPR模型,然后就可以确定中心原子的杂化轨道类型。若n=4,则中心原子为sp3杂化;若n=3,则中心原子为sp2杂化;若n=2,则中心原子为sp杂化。如、的n均为4,所以氯原子均采用sp3杂化(但离子的空间构型不同,从价层电子对互斥模型来看,前者为三角锥形,后者为正四面体形)。
2.根据杂化轨道间的夹角判断
不同的杂化方式,其杂化轨道之间的夹角不同,所以可根据杂化轨道间的夹角判断分子或离子的杂化类型。
(1)若杂化轨道之间的夹角为109°28',则分子的中心原子采用sp3杂化;
(2)若杂化轨道之间的夹角为120°,则分子的中心原子采用sp2杂化;
(3)若杂化轨道之间的夹角为180°,则分子的中心原子采用sp杂化。
3.取代法
以中学常见的、熟悉的物质分子为基础,用其他原子或原子团取代分子中的部分原子或原子团,得到的新分子的中心原子与原分子对应的中心原子的杂化类型相同。如:
(1)CH3CH=CH2分子中碳原子的杂化类型的判断,可看作乙烯基取代了甲烷分子中的一个氢原子,则甲基中碳原子为sp3杂化,也可看作甲基取代了乙烯分子中的一个氢原子,故两个不饱和碳原子均为sp2杂化;
(2)(CH3)3N可看作三个甲基取代了NH3分子中的三个氢原子而得,所以其分子中氮原子采用sp3杂化;
(3)H2O2可看作羟基取代了H2O分子中一个氢原子,H2O2中氧原子应为sp3杂化;
(4)B(OH)3可看作三个羟基取代了BF3中的氟原子,可知B(OH)3中硼原子为sp2杂化。
4.根据共价键类型判断
从杂化轨道理论可知,原子之间成键时,未杂化轨道形成π键,杂化轨道形成σ键。对于能够明确结构式的分子、离子,可直接用下式判断其中心原子的杂化轨道类型:
杂化轨道数n=中心原子的σ键数+中心原子的孤电子对数(多重键中只有一个σ键,其余均为π键)
(1)SiF4分子中硅原子轨道杂化类型分析,基态硅原子有4个价电子,与4个氟原子恰好形成4个键,无未成键电子,n=4,则SiF4分子中硅原子采用sp3杂化。
(2)基态碳原子有4个价电子,在HCHO分子中,碳原子与2个氢原子形成2个σ键,与氧原子形成C=O键,C=O键中有1个σ键、1个π键,碳原子无剩余价电子,n=3,则HCHO分子中碳原子采用sp2杂化。
5.等电子原理的应用
等电子体具有相同的结构特征,一般来说等电子体的中心原子的杂化类型相同。对于结构模糊或复杂的分子、离子,可将其转化成熟悉的等电子体,然后进行判断。如、H2B=NH2分别与CO2、CH2=CH2互为等电子体,而CO2、CH2=CH2中心原子碳原子分别为sp、sp2杂化,则的中心原子氮原子为sp杂化,H2B=NH2的中心原子硼、氮原子均为sp2杂化。
(1)杂化轨道数=价层电子对数。
(2)杂化轨道类型与杂化轨道数的关系:sp—2、sp2—3、sp3—4。
(3)CO2分子中的碳原子形成双键,但碳原子不是采用sp2杂化(易错),CO2中碳原子采用sp杂化。
试判断下列分子中心原子的杂化类型:
(1)NI3 (2)CH3Cl (3)CO2 (4)SO2
【答案】(1)sp3杂化 (2)sp3杂化 (3)sp杂化 (4)sp2杂化
【点评】(1)杂化方式的判断是一个难点,要注意积累经验,原子间形成的共价键,既包括σ键,也包括π键及大π键。
(2)根据最大重叠原理,中心原子与每个配位原子之间只能形成一个σ键,除此之外,其价电子只能形成π键或大π键。
二、配位键的理解
(1)配位键是一种特殊的共价键。配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
(2)配位键的形成条件
①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
下列不能形成配位键的组合是
A.Ag+、NH3 B.H2O、H+
C.Co3+、CO D.Ag+、H+
【答案】D
三、配合物
1.形成配合物的原理
形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。当配体接近中心原子(离子)时,为了增加成键能力,中心原子(离子)用能量相近的空轨道杂化,配体的孤电子对填到中心原子(离子)已杂化的空轨道中形成配离子。配离子的立体构型、配位数及稳定性等主要决定于杂化轨道的数目和类型。
2.常见的能形成配合物的粒子
(1)常见的含孤电子对的配体:分子如CO、NH3、H2O等;离子如Cl?、CN?、等。
(2)常见的可提供空轨道的中心原子。通常是过渡元素的离子或原子,如Cu2+、Ag+、Fe3+、Fe、Ni等。
下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为Br? B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化 D.中心离子的化合价为+2
【答案】B
1.有关杂化轨道的说法不正确的是
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释
D.杂化轨道全部参与形成化学键
2.下列关于配位化合物的叙述中不正确的是
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
3.下列关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
4.能正确表示CH4中碳原子的成键方式的示意图为
5.下列各组分子中所有原子都可能处于同一平面的是
A.CH4、CS2、BF3 B.CO2、H2O、NH3
C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
6.向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是
A.开始生成蓝色沉淀,加入过量氨水时,形成无色溶液
B.Cu(OH)2溶于浓氨水的离子方程式是Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?
C.开始生成蓝色沉淀,加入氨水后,沉淀溶解形成深蓝色溶液
D.开始生成Cu(OH)2,之后生成更稳定的配合物
7.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
在Xm-中,硼原子轨道的杂化类型有________________;配位键存在于____________原子之间(填原子的数字标号);m=____________(填数字)。
8.四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素
A
B
C
D
性质结构信息
原子核外有两个电子层,最外层有3个未成对的电子
原子的M层有1对成对的p电子
原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价
有两种常见氧化物,其中有一种是冶金工业常用的还原剂
(1)写出B原子的电子排布式________。
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________,简要描述该配合物中化学键的成键情况:______________________。
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是______(填序号);在②的分子中有________个σ键和________个π键。
9.(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为______________,第二种配合物的结构式为_______,如果在第二种配合物溶液中滴加AgNO3溶液时,产生__________________现象。
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下图,其中配位键和氢键均采用虚线表示。
①写出基态Cu原子的核外电子排布式______________。
②写出胆矾晶体中水合铜离子的结构简式______________(必须将配位键表示出来)。
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应,如:①CH2=CH2,②CH≡CH,③
④HCHO等,其中碳原子采取sp2杂化的分子有__________(填物质序号),预测HCHO分子的立体结构为__________形。
1.【答案】D
【解析】杂化轨道可以部分参与形成化学键,如NH3中N发生了sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键。
2.【答案】B
【解析】配位化合物中一定含有配位键,但也含有其他化学键;Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键。
3.【答案】C
4.【答案】D
【解析】碳原子的2s轨道与2p轨道形成4个等性的杂化轨道,因此碳原子4个价电子分占在4个sp3杂化轨道上,且自旋状态相同。
5.【答案】C
【解析】题中的CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子的所有原子不可能都在同一平面上。CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子都是平面形结构。故选C项。
6.【答案】A
【解析】向CuCl2溶液中加入少量NaOH溶液,发生反应Cu2++2OH?Cu(OH)2↓,Cu(OH)2沉淀为蓝色,再加入适量浓氨水,发生反应Cu(OH)2+4NH3[Cu(NH3)4]2++2OH?,形成深蓝色溶液,故A错误。
7.【答案】sp2、sp3 4、5(或5、4) 2
【解析】由硼砂模型知1、3、5、6均代表氧原子,2、4代表B原子,利用中心原子价电子对数n=σ键数+孤电子对数,如果n=2则为sp杂化,n=3则为sp2杂化。由于2号B形成3个σ键且无孤电子对,故B原子为sp2杂化,4号B形成4个σ键,则B原子为sp3杂化;B原子提供空轨道,O原子提供孤电子对,故4、5(或5、4)原子之间形成配位键。由阴离子的组成可知,Xm-为[H4B4O9]m-,得出m=2。
8.【答案】(1)1s22s22p63s23p4
(2)[Cu(NH3)4]SO4 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合
(3)①③④ 3 2
9.【答案】(1)[Co(NH3)5Br] SO4 [Co (SO4) (NH3)5] Br 淡黄色沉淀
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1
②
(3)①③④ 平面三角
【解析】由实验可知,第一种配合物的外界为,第二种配合物的外界不含有。铜处于ds区,d轨道处于全满状态。从所给的结构判断出每个Cu2+与4个H2O分子形成配位化合物。在写配离子时注意用箭头指向提供空轨道的原子。乙烯、苯、甲醛中的碳原子均采取sp2杂化,所有原子均共平面(苯中还有一个大π键)。
原子结构
物质的性质决定于结构,归根溯源,还是由每种元素原子的得失电子能力决定的。——别相信那么多告诉你怎样快速成功的技巧宝典,最终,决定一切的依然是实力,人与人之间也是如此。随着原子序数增大,核外电子数增加,你可以找到越来越容易失电子的原子,却找不到更容易得电子的原子了。——得到了很多的人,或者说能够认识到自己已经得到了很多的人,总是更容易明白施比受有福。
