专题2.3.2分子的性质(2)-同步巩固2017-2018学年高二化学人教版(选修3)
文档属性
| 名称 | 专题2.3.2分子的性质(2)-同步巩固2017-2018学年高二化学人教版(选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 754.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-04 15:46:10 | ||
图片预览




文档简介
第二章 分子结构与性质
第三节 分子的性质
第2课时 分子的性质(2)
一、溶解性
1.“相似相溶”规律
物质相互溶解的性质十分复杂,受到许多因素制约,如温度、压强等。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律。非极性溶质一般能溶于___________溶剂,极性溶质一般能溶于______溶剂。如蔗糖和氨易溶于水,难溶于CCl4,因为蔗糖、氨、水都是极性分子;而萘和碘易溶于CCl4,难溶于水,因为萘、碘和CCl4都是非极性分子。离子化合物可以看作极强的极性溶质,很多易溶于水。
2.影响溶解度的因素
(1)内因
①“相似相溶”还适用于分子结构的相似性。如低级羧酸(甲酸、乙酸等)可以与水以任意比例互溶,而高级脂肪酸如硬脂酸、软脂酸和油酸等不溶于水。
②如果溶剂和溶质之间存在氢键,则溶解度较大。如果溶质分子不能与水分子形成氢键,则在水中的溶解度就比较小。
③化学反应——溶质与溶剂发生反应可增大其溶解度。如SO2与H2O反应生成H2SO3,SO3与H2O反应生成H2SO4,NH3与H2O反应生成NH3·H2O。
(2)外因
①温度——一般来说,温度升高,固体物质的溶解度_______,气体物质的溶解度减小。
②压强——压强越大,气体的溶解度越大。
注意:a.影响固体溶解度的主要因素是温度。
b.影响气体溶解度的主要因素是温度和压强。
二、手性
1.手性异构体与手性分子
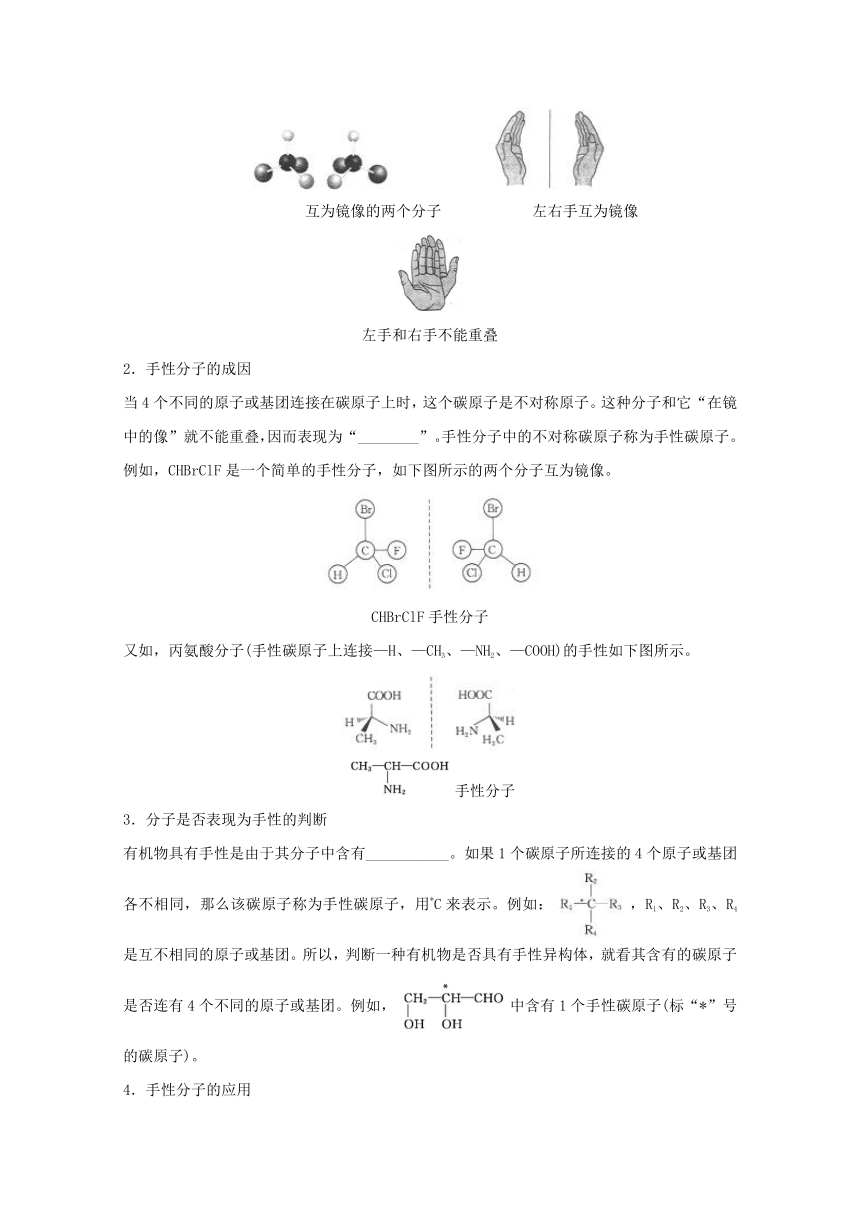
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。有手性异构体的分子叫做________。
互为镜像的两个分子 左右手互为镜像
左手和右手不能重叠
2.手性分子的成因
当4个不同的原子或基团连接在碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”就不能重叠,因而表现为“________”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF是一个简单的手性分子,如下图所示的两个分子互为镜像。
CHBrClF手性分子
又如,丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性如下图所示。
手性分子
3.分子是否表现为手性的判断
有机物具有手性是由于其分子中含有___________。如果1个碳原子所连接的4个原子或基团各不相同,那么该碳原子称为手性碳原子,用*C来表示。例如:,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物是否具有手性异构体,就看其含有的碳原子是否连有4个不同的原子或基团。例如,中含有1个手性碳原子(标“*”号的碳原子)。
4.手性分子的应用
(1)手性药物
如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它就是典型的手性药物。这种药物能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的。随后的药物化学研究证实,在这种药物中,只有一种手性异构体(右旋)是有效的镇静剂,而另一种异构体(左旋)则对胚胎有很强的致畸作用。所以,有选择地生成手性异构体,以及分离出单一的(左旋或右旋)异构体,对人类的健康生活具有重要意义。
“反应停”
(2)手性合成
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成为药物生产带来巨大的经济效益。手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手(如图)。
手性催化剂的手性传递
三、无机含氧酸分子的酸性
1.无机含氧酸的分子结构
无机含氧酸分子之所以能显示酸性,是因为其分子中含有—OH,而—OH中的氢原子在水分子的作用下能够变成________而显示一定的酸性。如HNO3、H2SO4和H2CO3的结构式分别是、和。因此,根据其组成的结构特点,无机含氧酸可以写成(HO)mROn。
2.无机含氧酸酸性比较
(1)同一元素的不同含氧酸的酸性强弱规律
无机含氧酸分子(HO)mROn中,对于同一种元素的含氧酸来说,R元素的化合价越高,其含氧酸的酸性_______。如HClO(2)无机含氧酸酸性与非羟基氧原子数的关系
无机含氧酸的通式可写成(HO)mROn,其中含有n个非羟基氧原子。非羟基氧原子数越多,酸性______,见下表:
次氯酸
磷酸
硫酸
高氯酸
含氧酸
Cl—OH
非羟基氧原子数
0
1
2
3
酸性
弱酸
中强酸
强酸
超强酸
规律:n=0时为弱酸;n=1时为中强酸;n=2时为强酸;n=3时为超强酸。
3.酸性变化原因
如果把含氧酸的通式写成(HO)mROn,成酸元素R相同,则n值越大,R的正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
【答案】一、1. 非极性 极性 2.(2)增大 二、1.手性分子 2.手性 3.手性碳原子
三、1.H+ 2.(1)越强 (2)越强
一、判断手性分子的方法 1.判断手性分子,关键是找到手性碳原子,故分析手性碳原子是否存在是解答这类题的关键。 2.一般要分析目标碳原子连接的原子或基团是否不同,所处的环境是否有差异。 3.若是手性碳原子则连接的原子或基团所处的环境是不同的,即连在同一个碳原子上的四个原子或基团是互不相同的。
3-氯-2-丁氨酸的结构简式为,1个3-氯-2-丁氨酸分子中含有_______个手性碳原子,它的其中一对手性异构体用简单投影式表示为和,则另一对手性异构体的简单投影式为和_________________。
【答案】2
二、无机含氧酸酸性的判断方法 1.比较无机含氧酸的酸性,关键是比较中心元素化合价的高低。如将含氧酸的通式写为(HO)mROn,当成酸元素R相同时,则n值越大,R的正电性越高,导致R—O—H中O的电子向R偏移,在水分子作用下就容易电离出H+,显示出较强的酸性。 2.同种元素的不同价态:一般化合价越高,无机含氧酸的酸性越强;同周期不同元素的最高价态:一般越向右,无机含氧酸的酸性越强;同主族不同元素的最高价态:一般越向上,无机含氧酸的酸性越强(O、F除外)。
注意:(1)无机含氧酸的酸性与其溶解度无关,并非溶解度越大,酸性越强。如HClO、H3PO4均易溶于水,但它们均不是强酸。
(2)无机含氧酸分子中有几个氢原子,该酸不一定就是几元酸。例如H3PO3的结构式为,为二元酸。
(3)碳酸(H2CO3)为弱酸的原因:碳酸[(HO)2CO]中非羟基氧的个数为1,理论上应是强度与亚硝酸[(HO)NO]和磷酸[(HO)3PO]相近的中强酸,但事实上它是弱酸,这是由于溶于水的CO2分子中只有几百分之一与水结合成碳酸。
(4)同主族元素或同周期元素最高价含氧酸的酸性可根据元素的非金属性强弱比较。
(5)无氧酸酸性强弱的规律:若用RHn表示无氧酸,其酸性强弱主要取决于R的电负性,R的电负性越大,则其对氢原子的束缚力越强,其酸性越弱。
下列各组物质中,酸性由强到弱排列顺序错误的是
A.HClO4 H2SO4 H3PO4
B.HClO4 HClO3 HClO2
C.HClO HBrO4 HIO4
D.H2SO4 H2SO3 H2CO3
【答案】C
三、对含氧酸的元数、酸性、氧化性的认识的易错点
1.由HNO3、H2SO4、H3PO4的相关知识而误认为有几个H或几个羟基的酸就属于几元酸;由氧化性:HNO3>HNO2、H2SO4>H2SO3而混淆酸的酸性与氧化性,误认为酸性越强的酸其氧化性也越强。
2.误认为羟基数就是含氧酸的元数。如磷元素的几种含氧酸的名称、分子式、结构式、磷的化合价、酸的元数如下表:
名称
正磷酸
偏磷酸
亚磷酸
次磷酸
分子式
H3PO4
HPO3
H3PO3
H3PO2
结构式
磷的
化合价
+5
+5
+3
+1
酸的元数
三元
一元
二元
一元
3.同种元素的含氧酸,中心原子的价态越高,含氧酸的氧化性不一定越强。如酸性:HClO4>HClO3>HClO,氧化性:HClO4下列叙述正确的是
A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B.无机含氧酸分子中含有几个羟基,它就属于几元酸
C.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
【答案】D
【易错诊断】错选A、B项是由于只考虑到了HNO3、H2SO4、H3PO4等个例,而忽略了酸式盐、CH3COOH、H3BO3等例外;错选C项是由于只考虑到了HNO3与HNO2、H2SO4与H2SO3的酸性与氧化性符合酸性强的氧化性也强,而忽略了HClO与HClO4等例外。
1.关于CS2、SO2、NH3三种物质的说法中正确的是
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔、沸点最低
D.NH3在水中溶解度很大只是由于NH3分子为极性分子
2.欲提取碘水中的碘,不能选用的萃取剂是
A.酒精 B.四氯化碳
C.直馏汽油 D.苯
3.下列叙述中正确的是
A.无机含氧酸分子中含有几个氢原子,它就属于几元酸
B.同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强
C.同一元素的含氧酸,该元素的化合价越高,酸性越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,它们的酸性相近,均为中强酸。
4.如图所示,下列有关两分子的说法正确的是
A.互为同分异构体 B.二者是同一物质
C.二者是手性分子 D.互为同系物
5.物质的物理性质与化学键、分子间作用力有密切关系。请回答下列问题:
Ⅰ.如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是_______________,b点代表的是_______________。
Ⅱ.如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)请写出如图中d单质对应元素原子的电子排布式:____________________。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含_____个σ键,_____个π键。
(3)a与b对应的元素形成的10电子中性分子X的空间构型为__________;将X溶于水后形成的溶液滴入到含有d元素高价离子的溶液中直至过量,生成的含d元素的离子的化学式为__________,其中X与d的高价离子之间以_____键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为,请简要说明该物质易溶于水的原因: ____________________。
Ⅲ.研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。如图是水和“热冰”的计算机模拟图,图中小球代表水分子中的原子。
图1 图2
(1)图中较大的球代表_____原子,其原子结构示意图是_____。水分子中氢氧原子间的化学键是_____ (填“共价键”或“离子键”)。
(2)用球棍模型表示的水分子结构是_____ (填序号)。
(3)已知水分子中氧原子一端带部分负电荷,氢原子一端带部分正电荷,在外加电场作用下,水结成冰。如图中模拟“热冰”的示意图是_____ (填“图1”或“图2”),理由是____________________。
6.[2017江苏节选]铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮()分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
7.[2016四川节选]M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
1.【答案】B
2.【答案】A
【解析】单质碘(I2)是含有非极性键的非极性分子,根据“相似相溶”规律,可知碘易溶于非极性溶剂。而CCl4、直馏汽油、C6H6等为非极性溶剂,且它们与水的密度差别较大,容易分层,所以B、C、D选项可以作为碘的萃取剂。而酒精容易与水、碘互溶,不分层,故不能用作萃取剂。
3.【答案】C
【解析】H3PO3的分子结构为,它是二元酸,所以A项错误;B项所述规律对非金属元素的最高价氧化物对应的水化物才适合;C项是比较无机含氧酸酸性强弱的重要规律,C项正确;D项中H3PO4和H2CO3的非羟基氧原子数均为1,但H2CO3酸性弱于H3PO4,这是由于溶于水的CO2只有很少的一部分与水结合成碳酸。
4.【答案】B
【解析】手性分子中应含有手性碳原子,即同一个碳原子上连有四个不同的原子或基团,所以二者不是手性分子;二者的分子式相同,结构也相同,故二者是同一物质。
5.【答案】Ⅰ.SiH4 H2Se
Ⅱ.(1)1s22s22p63s23p63d104s1
(2)2 2
(3)三角锥形 [Cu(NH3)4]2+ 配位
(4)HNO3是极性分子,易溶于极性溶剂水中;HNO3分子易与水分子之间形成氢键
Ⅲ.(1)氧(或O) 共价键 (2)B (3)图1 分子有序排列
Ⅱ.(1)根据熔点的高低顺序,可判断出a是H2,b是N2,c是Na,d是Cu,e是Si,f是C。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子为HCN,含有2个个σ键,2个π键。
Ⅲ.(1)N原子与P原子的结构相似,NH3分子与PH3分子的结构也相似,P—H键为不同种元素原子之间形成的共价键,为极性键。
(2)由N、P在元素周期表中的位置关系和元素周期律可知,N的非金属性比P强。由元素的非金属性与对应氢化物热稳定性之间的关系可知,NH3的热稳定性比PH3强。
(3)“易液化”属于物质的物理性质,NH3与PH3都是共价化合物,其物理性质与化学键无关。按照相对分子质量与范德华力的关系,范德华力与物质的物理性质的关系分析,应该是PH3的沸点比NH3高,PH3比NH3易液化。现实是NH3比PH3易液化,这种反常现象是由于NH3分子之间存在特殊的分子间作用力——氢键。
Ⅳ.氧原子半径比氢原子大,故大球代表氧原子。水分子中含极性共价键,两个O—H键之间的夹角为105°,呈V形结构。“热冰”中的水分子有序排列。
【备注】分子内氢键除必须具备形成氢键的条件外,还必须具备特定的条件:形成平面环(五元环或六元环最为稳定)、形成的环没有任何扭曲等。氢键的形成使物质在熔点、沸点、电离度、溶解度等方面表现出一些特殊性质。由于分子间氢键的作用,形成了“缔合分子”,增大了分子间作用力,使物质的熔、沸点升高(如水),溶解度增大(如氨),电离度降低(如氢氟酸为弱酸)等;由于分子内的氢键作用,形成具有“环状结构”的物质,减小了分子间的作用力,使物质的熔、沸点降低,溶解度减小等。
6.【答案】(1)[Ar]3d5或 1s22s22p63s23p63d5
(2)sp2和sp3 9 mol
(3)H(4)乙醇分子间存在氢键
7.【答案】(1)①1s22s22p63s1或[Ne]3s1 ②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
【解析】根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道电子数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,且原子序数大于O,则R在第三周期,应是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,进而知Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。
(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素,答案为:1s22s22p63s1;Cl。
(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键。
(3)SO3中硫原子的价层电子对数为3+(6-3×2)/2=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形,答案为:平面三角形。
链反应
化学上有很多链反应,如氢气与氯气的反应,反应一旦被引发,就会不断地进行下去,直至发生燃烧、爆炸,最后反应终结。人生也有很多链反应,一旦迈出了第一步,后面的往往就身不由己了。如果是好事,那就一帆风顺,通畅无阻;如果是坏事,就麻烦了,往往祸不单行,接踵而至。而要使它停下来,就要借助外界的力量,花费很大的力气。正如柳青所说:“人生的道路虽然漫长,但紧要处常常只有几步,特别是当人年轻的时候。”
第三节 分子的性质
第2课时 分子的性质(2)
一、溶解性
1.“相似相溶”规律
物质相互溶解的性质十分复杂,受到许多因素制约,如温度、压强等。通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律。非极性溶质一般能溶于___________溶剂,极性溶质一般能溶于______溶剂。如蔗糖和氨易溶于水,难溶于CCl4,因为蔗糖、氨、水都是极性分子;而萘和碘易溶于CCl4,难溶于水,因为萘、碘和CCl4都是非极性分子。离子化合物可以看作极强的极性溶质,很多易溶于水。
2.影响溶解度的因素
(1)内因
①“相似相溶”还适用于分子结构的相似性。如低级羧酸(甲酸、乙酸等)可以与水以任意比例互溶,而高级脂肪酸如硬脂酸、软脂酸和油酸等不溶于水。
②如果溶剂和溶质之间存在氢键,则溶解度较大。如果溶质分子不能与水分子形成氢键,则在水中的溶解度就比较小。
③化学反应——溶质与溶剂发生反应可增大其溶解度。如SO2与H2O反应生成H2SO3,SO3与H2O反应生成H2SO4,NH3与H2O反应生成NH3·H2O。
(2)外因
①温度——一般来说,温度升高,固体物质的溶解度_______,气体物质的溶解度减小。
②压强——压强越大,气体的溶解度越大。
注意:a.影响固体溶解度的主要因素是温度。
b.影响气体溶解度的主要因素是温度和压强。
二、手性
1.手性异构体与手性分子
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。有手性异构体的分子叫做________。
互为镜像的两个分子 左右手互为镜像
左手和右手不能重叠
2.手性分子的成因
当4个不同的原子或基团连接在碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”就不能重叠,因而表现为“________”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF是一个简单的手性分子,如下图所示的两个分子互为镜像。
CHBrClF手性分子
又如,丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性如下图所示。
手性分子
3.分子是否表现为手性的判断
有机物具有手性是由于其分子中含有___________。如果1个碳原子所连接的4个原子或基团各不相同,那么该碳原子称为手性碳原子,用*C来表示。例如:,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物是否具有手性异构体,就看其含有的碳原子是否连有4个不同的原子或基团。例如,中含有1个手性碳原子(标“*”号的碳原子)。
4.手性分子的应用
(1)手性药物
如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它就是典型的手性药物。这种药物能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的。随后的药物化学研究证实,在这种药物中,只有一种手性异构体(右旋)是有效的镇静剂,而另一种异构体(左旋)则对胚胎有很强的致畸作用。所以,有选择地生成手性异构体,以及分离出单一的(左旋或右旋)异构体,对人类的健康生活具有重要意义。
“反应停”
(2)手性合成
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成为药物生产带来巨大的经济效益。手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手(如图)。
手性催化剂的手性传递
三、无机含氧酸分子的酸性
1.无机含氧酸的分子结构
无机含氧酸分子之所以能显示酸性,是因为其分子中含有—OH,而—OH中的氢原子在水分子的作用下能够变成________而显示一定的酸性。如HNO3、H2SO4和H2CO3的结构式分别是、和。因此,根据其组成的结构特点,无机含氧酸可以写成(HO)mROn。
2.无机含氧酸酸性比较
(1)同一元素的不同含氧酸的酸性强弱规律
无机含氧酸分子(HO)mROn中,对于同一种元素的含氧酸来说,R元素的化合价越高,其含氧酸的酸性_______。如HClO
无机含氧酸的通式可写成(HO)mROn,其中含有n个非羟基氧原子。非羟基氧原子数越多,酸性______,见下表:
次氯酸
磷酸
硫酸
高氯酸
含氧酸
Cl—OH
非羟基氧原子数
0
1
2
3
酸性
弱酸
中强酸
强酸
超强酸
规律:n=0时为弱酸;n=1时为中强酸;n=2时为强酸;n=3时为超强酸。
3.酸性变化原因
如果把含氧酸的通式写成(HO)mROn,成酸元素R相同,则n值越大,R的正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
【答案】一、1. 非极性 极性 2.(2)增大 二、1.手性分子 2.手性 3.手性碳原子
三、1.H+ 2.(1)越强 (2)越强
一、判断手性分子的方法 1.判断手性分子,关键是找到手性碳原子,故分析手性碳原子是否存在是解答这类题的关键。 2.一般要分析目标碳原子连接的原子或基团是否不同,所处的环境是否有差异。 3.若是手性碳原子则连接的原子或基团所处的环境是不同的,即连在同一个碳原子上的四个原子或基团是互不相同的。
3-氯-2-丁氨酸的结构简式为,1个3-氯-2-丁氨酸分子中含有_______个手性碳原子,它的其中一对手性异构体用简单投影式表示为和,则另一对手性异构体的简单投影式为和_________________。
【答案】2
二、无机含氧酸酸性的判断方法 1.比较无机含氧酸的酸性,关键是比较中心元素化合价的高低。如将含氧酸的通式写为(HO)mROn,当成酸元素R相同时,则n值越大,R的正电性越高,导致R—O—H中O的电子向R偏移,在水分子作用下就容易电离出H+,显示出较强的酸性。 2.同种元素的不同价态:一般化合价越高,无机含氧酸的酸性越强;同周期不同元素的最高价态:一般越向右,无机含氧酸的酸性越强;同主族不同元素的最高价态:一般越向上,无机含氧酸的酸性越强(O、F除外)。
注意:(1)无机含氧酸的酸性与其溶解度无关,并非溶解度越大,酸性越强。如HClO、H3PO4均易溶于水,但它们均不是强酸。
(2)无机含氧酸分子中有几个氢原子,该酸不一定就是几元酸。例如H3PO3的结构式为,为二元酸。
(3)碳酸(H2CO3)为弱酸的原因:碳酸[(HO)2CO]中非羟基氧的个数为1,理论上应是强度与亚硝酸[(HO)NO]和磷酸[(HO)3PO]相近的中强酸,但事实上它是弱酸,这是由于溶于水的CO2分子中只有几百分之一与水结合成碳酸。
(4)同主族元素或同周期元素最高价含氧酸的酸性可根据元素的非金属性强弱比较。
(5)无氧酸酸性强弱的规律:若用RHn表示无氧酸,其酸性强弱主要取决于R的电负性,R的电负性越大,则其对氢原子的束缚力越强,其酸性越弱。
下列各组物质中,酸性由强到弱排列顺序错误的是
A.HClO4 H2SO4 H3PO4
B.HClO4 HClO3 HClO2
C.HClO HBrO4 HIO4
D.H2SO4 H2SO3 H2CO3
【答案】C
三、对含氧酸的元数、酸性、氧化性的认识的易错点
1.由HNO3、H2SO4、H3PO4的相关知识而误认为有几个H或几个羟基的酸就属于几元酸;由氧化性:HNO3>HNO2、H2SO4>H2SO3而混淆酸的酸性与氧化性,误认为酸性越强的酸其氧化性也越强。
2.误认为羟基数就是含氧酸的元数。如磷元素的几种含氧酸的名称、分子式、结构式、磷的化合价、酸的元数如下表:
名称
正磷酸
偏磷酸
亚磷酸
次磷酸
分子式
H3PO4
HPO3
H3PO3
H3PO2
结构式
磷的
化合价
+5
+5
+3
+1
酸的元数
三元
一元
二元
一元
3.同种元素的含氧酸,中心原子的价态越高,含氧酸的氧化性不一定越强。如酸性:HClO4>HClO3>HClO,氧化性:HClO4
A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B.无机含氧酸分子中含有几个羟基,它就属于几元酸
C.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
【答案】D
【易错诊断】错选A、B项是由于只考虑到了HNO3、H2SO4、H3PO4等个例,而忽略了酸式盐、CH3COOH、H3BO3等例外;错选C项是由于只考虑到了HNO3与HNO2、H2SO4与H2SO3的酸性与氧化性符合酸性强的氧化性也强,而忽略了HClO与HClO4等例外。
1.关于CS2、SO2、NH3三种物质的说法中正确的是
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔、沸点最低
D.NH3在水中溶解度很大只是由于NH3分子为极性分子
2.欲提取碘水中的碘,不能选用的萃取剂是
A.酒精 B.四氯化碳
C.直馏汽油 D.苯
3.下列叙述中正确的是
A.无机含氧酸分子中含有几个氢原子,它就属于几元酸
B.同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强
C.同一元素的含氧酸,该元素的化合价越高,酸性越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,它们的酸性相近,均为中强酸。
4.如图所示,下列有关两分子的说法正确的是
A.互为同分异构体 B.二者是同一物质
C.二者是手性分子 D.互为同系物
5.物质的物理性质与化学键、分子间作用力有密切关系。请回答下列问题:
Ⅰ.如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是_______________,b点代表的是_______________。
Ⅱ.如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)请写出如图中d单质对应元素原子的电子排布式:____________________。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含_____个σ键,_____个π键。
(3)a与b对应的元素形成的10电子中性分子X的空间构型为__________;将X溶于水后形成的溶液滴入到含有d元素高价离子的溶液中直至过量,生成的含d元素的离子的化学式为__________,其中X与d的高价离子之间以_____键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为,请简要说明该物质易溶于水的原因: ____________________。
Ⅲ.研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。如图是水和“热冰”的计算机模拟图,图中小球代表水分子中的原子。
图1 图2
(1)图中较大的球代表_____原子,其原子结构示意图是_____。水分子中氢氧原子间的化学键是_____ (填“共价键”或“离子键”)。
(2)用球棍模型表示的水分子结构是_____ (填序号)。
(3)已知水分子中氧原子一端带部分负电荷,氢原子一端带部分正电荷,在外加电场作用下,水结成冰。如图中模拟“热冰”的示意图是_____ (填“图1”或“图2”),理由是____________________。
6.[2017江苏节选]铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮()分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
7.[2016四川节选]M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
1.【答案】B
2.【答案】A
【解析】单质碘(I2)是含有非极性键的非极性分子,根据“相似相溶”规律,可知碘易溶于非极性溶剂。而CCl4、直馏汽油、C6H6等为非极性溶剂,且它们与水的密度差别较大,容易分层,所以B、C、D选项可以作为碘的萃取剂。而酒精容易与水、碘互溶,不分层,故不能用作萃取剂。
3.【答案】C
【解析】H3PO3的分子结构为,它是二元酸,所以A项错误;B项所述规律对非金属元素的最高价氧化物对应的水化物才适合;C项是比较无机含氧酸酸性强弱的重要规律,C项正确;D项中H3PO4和H2CO3的非羟基氧原子数均为1,但H2CO3酸性弱于H3PO4,这是由于溶于水的CO2只有很少的一部分与水结合成碳酸。
4.【答案】B
【解析】手性分子中应含有手性碳原子,即同一个碳原子上连有四个不同的原子或基团,所以二者不是手性分子;二者的分子式相同,结构也相同,故二者是同一物质。
5.【答案】Ⅰ.SiH4 H2Se
Ⅱ.(1)1s22s22p63s23p63d104s1
(2)2 2
(3)三角锥形 [Cu(NH3)4]2+ 配位
(4)HNO3是极性分子,易溶于极性溶剂水中;HNO3分子易与水分子之间形成氢键
Ⅲ.(1)氧(或O) 共价键 (2)B (3)图1 分子有序排列
Ⅱ.(1)根据熔点的高低顺序,可判断出a是H2,b是N2,c是Na,d是Cu,e是Si,f是C。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子为HCN,含有2个个σ键,2个π键。
Ⅲ.(1)N原子与P原子的结构相似,NH3分子与PH3分子的结构也相似,P—H键为不同种元素原子之间形成的共价键,为极性键。
(2)由N、P在元素周期表中的位置关系和元素周期律可知,N的非金属性比P强。由元素的非金属性与对应氢化物热稳定性之间的关系可知,NH3的热稳定性比PH3强。
(3)“易液化”属于物质的物理性质,NH3与PH3都是共价化合物,其物理性质与化学键无关。按照相对分子质量与范德华力的关系,范德华力与物质的物理性质的关系分析,应该是PH3的沸点比NH3高,PH3比NH3易液化。现实是NH3比PH3易液化,这种反常现象是由于NH3分子之间存在特殊的分子间作用力——氢键。
Ⅳ.氧原子半径比氢原子大,故大球代表氧原子。水分子中含极性共价键,两个O—H键之间的夹角为105°,呈V形结构。“热冰”中的水分子有序排列。
【备注】分子内氢键除必须具备形成氢键的条件外,还必须具备特定的条件:形成平面环(五元环或六元环最为稳定)、形成的环没有任何扭曲等。氢键的形成使物质在熔点、沸点、电离度、溶解度等方面表现出一些特殊性质。由于分子间氢键的作用,形成了“缔合分子”,增大了分子间作用力,使物质的熔、沸点升高(如水),溶解度增大(如氨),电离度降低(如氢氟酸为弱酸)等;由于分子内的氢键作用,形成具有“环状结构”的物质,减小了分子间的作用力,使物质的熔、沸点降低,溶解度减小等。
6.【答案】(1)[Ar]3d5或 1s22s22p63s23p63d5
(2)sp2和sp3 9 mol
(3)H
7.【答案】(1)①1s22s22p63s1或[Ne]3s1 ②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
【解析】根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道电子数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,且原子序数大于O,则R在第三周期,应是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,进而知Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。
(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素,答案为:1s22s22p63s1;Cl。
(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键。
(3)SO3中硫原子的价层电子对数为3+(6-3×2)/2=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形,答案为:平面三角形。
链反应
化学上有很多链反应,如氢气与氯气的反应,反应一旦被引发,就会不断地进行下去,直至发生燃烧、爆炸,最后反应终结。人生也有很多链反应,一旦迈出了第一步,后面的往往就身不由己了。如果是好事,那就一帆风顺,通畅无阻;如果是坏事,就麻烦了,往往祸不单行,接踵而至。而要使它停下来,就要借助外界的力量,花费很大的力气。正如柳青所说:“人生的道路虽然漫长,但紧要处常常只有几步,特别是当人年轻的时候。”
