专题2.2.1分子的立体构型(1)-同步巩固2017-2018学年高二化学人教版(选修3)
文档属性
| 名称 | 专题2.2.1分子的立体构型(1)-同步巩固2017-2018学年高二化学人教版(选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 498.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-04 21:22:40 | ||
图片预览



文档简介
第二章 分子结构与性质
第二节 分子的立体构型
第1课时 分子的立体构型(1)
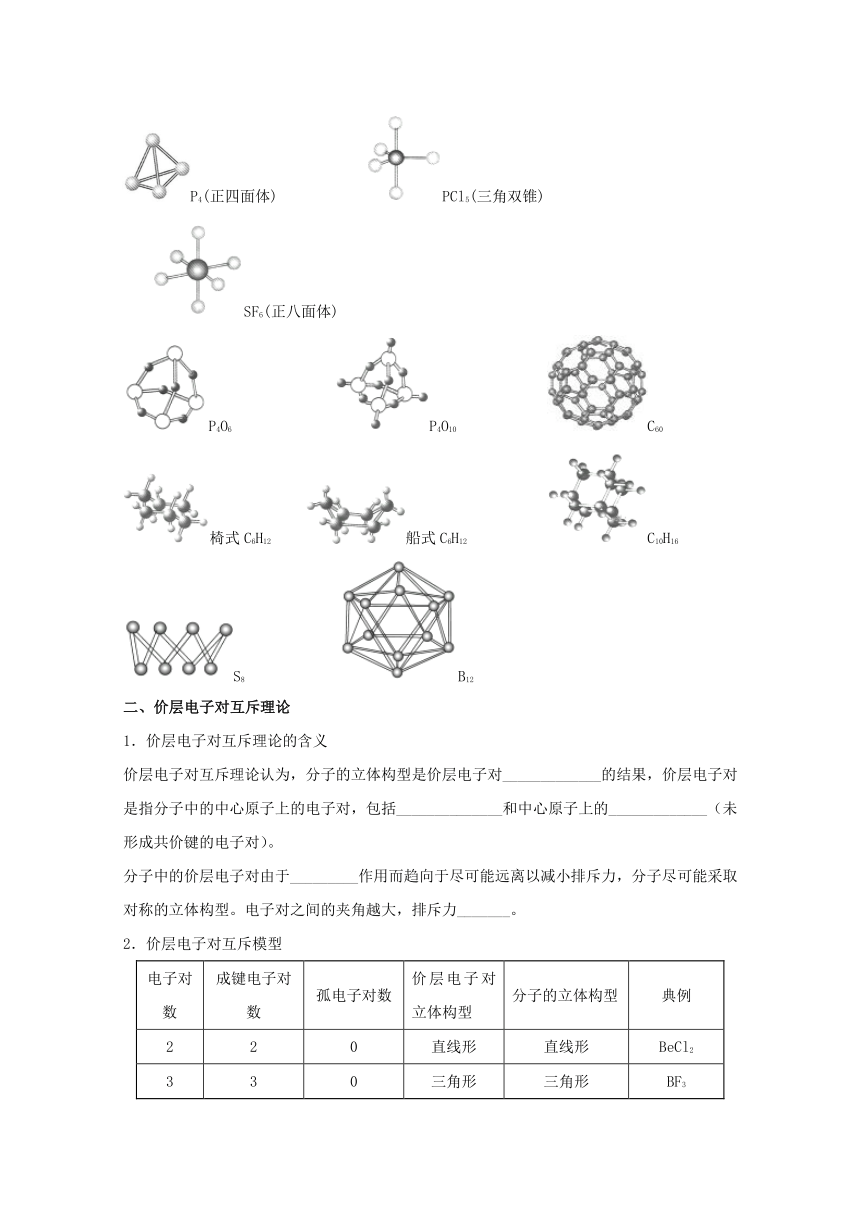
一、形形色色的分子
单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.三原子分子——直线形和V形
化学式
立体构型
结构式
键角
比例模型
球棍模型
CO2
直线形
______
H2O
V形
105°
2.四原子分子——平面三角形和三角锥形
化学式
立体构型
结构式
键角
比例模型
球棍模型
CH2O
平面三角形
120°
NH3
三角锥形
107°
3.五原子分子
化学式
立体构型
结构式
键角
比例模型
球棍模型
CH4
________
109°28'
4.其他多原子分子的立体构型
多原子分子的立体构型形形色色,异彩纷呈。如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(金刚烷)、S8、B12(硼单质)等的立体构型如图所示。
P4(正四面体) PCl5(三角双锥) SF6(正八面体)
P4O6 P4O10 C60
椅式C6H12 船式C6H12 C10H16
S8 B12
二、价层电子对互斥理论
1.价层电子对互斥理论的含义
价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型
电子对数
成键电子对数
孤电子对数
价层电子对立体构型
分子的立体构型
典例
2
2
0
直线形
直线形
BeCl2
3
3
0
三角形
三角形
BF3
2
1
V形
SnBr2
4
4
0
四面体
___________
CH4
3
1
三角锥形
NH3
2
2
V形
H2O
3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
(1)当中心原子上无孤电子对时,二者的构型一致;
(2)当中心原子上有孤电子对时,二者的构型不一致。
【答案】180° 正四面体形 相互排斥 σ键电子对 孤电子对 排斥力 越小 正四面体形
一、分子立体构型的确定
利用VSEPR理论预测分子立体构型的思路:σ键电子对数+孤电子对数=价层电子对数VSEPR模型分子的立体构型。其中正确地确定σ键数和a、x、b的值是计算价电子对数的关键,也是判断、预测VSEPR模型和立体构型的关键。一些常见的分子、离子的价层电子对数和立体构型如下表。
分子或离子
σ键电
子对数
中心原子上的孤电子对数
价层电
子对数
立体构型
a
x
b
(a?xb)
分
子
CO2
2
4
2
2
0
2
直线形
BeCl2
2
2
2
1
0
2
直线形
SO2
2
6
2
2
1
3
V形
SO3
3
6
3
2
0
3
平面三角形
NH3
3
5
3
1
1
4
三角锥形
H2O
2
6
2
1
2
4
V形
CH4(CCl4)
4
4
4
1
0
4
正四面体形
离
子
H3O+
3
6?1=5
3
1
1
4
三角锥形
3
4+2=6
3
2
0
3
平面三角形
4
6+2=8
4
2
0
4
正四面体形
3
7+1=8
3
2
1
4
三角锥形
注意:当中心原子无孤电子对时,VSEPR模型与分子的立体构型一致;当中心原子有孤电子对时,VSEPR模型与分子的立体构型不一致。
运用价电子对互斥理论的注意事项
1.利用价层电子对互斥理论判断分子的立体构型时应注意:价层电子对互斥理论模型是电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。 2.二者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,二者的构型一致;当中心原子上有孤电子对时,二者的构型不一致。
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。下列判断正确的是
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
【答案】C
二、用价层电子对互斥理论推测分子或离子立体构型时的易错点
1.计算阴、阳离子的中心原子的价层电子对数目时未考虑离子所带电荷而计算错误。
2.用电子式或路易斯结构式判断中心原子的价层电子对数时,未将双键或三键当一对价层电子对计算导致错误。
3.不能准确区别和判断孤电子对和成键电子对。判断ABn型分子中孤电子对数的简单方法为孤电子对数=价层电子对数?成键电子对数。
4.误将VSEPR模型的立体结构当成分子或离子的空间构型。
5.错误利用相似性规律判断分子或离子的空间构型。
下列各组分子的立体构型相同的是
A.SnCl2、BeCl2 B.BF3、NH3 C.CCl4、SiF4 D.CS2、OF2
【解析】通过分子的价层电子对数、孤电子对数确定分子的立体构型,例如A、D中物质
成键电子对数
中心原子上的
孤电子对数
价层电子对数
立体构型
SnCl2
2
(4?2×1)=1
3
V形
BeCl2
2
(2?2×1)=0
2
直线形
CS2
2
(4?2×2)=0
2
直线形
OF2
2
(6?2×1)=2
4
V形
B中BF3、NH3的立体构型分别为平面三角形、三角锥形;C项中,CCl4与SiF4的立体构型均为正四面体形。
【答案】C
1.下列分子的立体结构模型正确的是
A.CO2的立体结构模型
B.PH3的立体结构模型
C.H2S的立体结构模型
D.CH4的立体结构模型
2.下列分子或离子的中心原子,带有一对孤电子对的是
A.H2O B.BeCl2 C.CH4 D.PCl3
3.下列分子或离子中,中心原子价层电子对的立体构型为正四面体形且分子或离子的立体构型为V形的是
A. B.PH3 C.H3O+ D.OF2
4.用价层电子对互斥理论判断SO3的立体构型为
A.正四面体形 B.V形
C.三角锥形 D.平面三角形
5.据报道,大气中存在一种潜在的温室气体SF5—CF3,虽然其数量有限,但它是已知气体中吸热最高的气体。关于SF5—CF3的说法正确的是
A.分子中有σ键也有π键
B.所有原子在同一平面内
C.CF4与CH4都是正四面体结构
D.0.1 mol SF5—CF3分子中电子数为8 mol
6.研究表明:H2O2具有立体结构,两个氢原子像在半展开一本书的两页上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°,如图所示,下列说法错误的是
A.H2O2分子中既有极性键又有非极性键
B.H2O2分子为含有非极性键的极性分子
C.H2O2分子为非极性分子
D.H2O2分子为既含极性键又含非极性键的极性分子
7.膦(PH3)又称磷化氢,在常温下是一种无色、有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的立体构型是三角锥形。则下列关于PH3的叙述正确的是
A.PH3分子中有未成键的孤电子对
B.PH3是空间对称结构
C.PH3是一种强氧化剂
D.PH3分子中的P—H键间夹角是90°
8.试回答下列问题:
(1)指出下列分子或离子的空间构型:____________;CS2____________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据如图所示的两种微粒的球棍模型,写出相应的化学式:A____________;B____________。
A B
(3)按要求写出由第2周期非金属主族元素原子构成的分子的化学式:
平面三角形分子____________,三角锥形分子____________,正四面体形分子____________。
(4)下列微粒中键角由大到小的顺序为____________ (填序号)。
①HCN ②SiF4 ③SCl2 ④ ⑤H3O+
1.【答案】D
【解析】CO2分子的立体构型是直线形,A不正确;PH3与NH3的立体构型相同为三角锥形,B不正确;H2S与H2O的立体构型相似均为V形,C不正确;CH4的立体构型为正四面体形,D正确。
2.【答案】D
3.【答案】D
【解析】中心原子价层电子对的立体构型为正四面体形,且分子或离子的立体构型为V形的只有3个原子构成的分子或离子,OF2为V形结构。A选项是三角锥形的NH3结合了一个H+,呈正四面体形,B项中PH3为三角锥形,C中H3O+是V形的H2O结合了一个H+,呈三角锥形。
4.【答案】D
【解析】SO3中的S原子表现+6价,S原子的价电子全部用于形成了共价键,S周围有3个氧原子,故选D。
5.【答案】C
【解析】A项,分子中都是σ键,无π键,错误;B项,碳原子与其相连的四个原子形成四面体结构,不可能所有原子共平面;D项,一个分子中有94个电子,错误。
6.【答案】C
【解析】由同种元素构成的O—O键为非极性键,由不同种元素构成的O—H键为极性键。由题意可知,两个O—H键与O—O键处于不对称的位置上,所以H2O2分子为极性分子。
7.【答案】A
8.【答案】(1)正四面体形 直线形 (2)
(3)BF3 NF3 CF4 (4)①④②⑤③
【解析】(1)中无孤电子对,空间构型为正四面体形;CS2分子的空间构型与CO2一样,为直线形。
(2)含有1个碳原子和3个氢原子且为平面结构的微粒应该是,无孤电子对。含有1个碳原子和3个氢原子且为三角锥形结构的微粒应该是,有一个孤电子对。
(3)第2周期的五种非金属主族元素原子B、C、N、O、F构成的分子中,平面三角形分子为BF3,三角锥形分子为NF3,正四面体形分子为CF4。
(4)①HCN为直线形分子,键角为180°;②SiF4为正四面体形结构,键角为109°28′;③SCl2为V形结构,键角接近104.5°;④为平面三角形结构,键角为120°;⑤H3O+为三角锥形结构,键角接近107.3°。所以键角由大到小的顺序为①④②⑤③。
元素周期表结构
七主七副七周期,Ⅷ族0族镧锕系;熟记三个短周期,位性皆由结构定。
对族序的巧记
族序逐个加,两主五副随,族序一七零,两副五主零。
元素周期表的巧记
十八纵行十六族,七主七副Ⅷ和0;八九十行成Ⅷ族,每逢二三分主副;七个周期分长短,三长三短一不全;镧系锕系各十五,都在ⅢB里边住。
第二节 分子的立体构型
第1课时 分子的立体构型(1)
一、形形色色的分子
单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.三原子分子——直线形和V形
化学式
立体构型
结构式
键角
比例模型
球棍模型
CO2
直线形
______
H2O
V形
105°
2.四原子分子——平面三角形和三角锥形
化学式
立体构型
结构式
键角
比例模型
球棍模型
CH2O
平面三角形
120°
NH3
三角锥形
107°
3.五原子分子
化学式
立体构型
结构式
键角
比例模型
球棍模型
CH4
________
109°28'
4.其他多原子分子的立体构型
多原子分子的立体构型形形色色,异彩纷呈。如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(金刚烷)、S8、B12(硼单质)等的立体构型如图所示。
P4(正四面体) PCl5(三角双锥) SF6(正八面体)
P4O6 P4O10 C60
椅式C6H12 船式C6H12 C10H16
S8 B12
二、价层电子对互斥理论
1.价层电子对互斥理论的含义
价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型
电子对数
成键电子对数
孤电子对数
价层电子对立体构型
分子的立体构型
典例
2
2
0
直线形
直线形
BeCl2
3
3
0
三角形
三角形
BF3
2
1
V形
SnBr2
4
4
0
四面体
___________
CH4
3
1
三角锥形
NH3
2
2
V形
H2O
3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
(1)当中心原子上无孤电子对时,二者的构型一致;
(2)当中心原子上有孤电子对时,二者的构型不一致。
【答案】180° 正四面体形 相互排斥 σ键电子对 孤电子对 排斥力 越小 正四面体形
一、分子立体构型的确定
利用VSEPR理论预测分子立体构型的思路:σ键电子对数+孤电子对数=价层电子对数VSEPR模型分子的立体构型。其中正确地确定σ键数和a、x、b的值是计算价电子对数的关键,也是判断、预测VSEPR模型和立体构型的关键。一些常见的分子、离子的价层电子对数和立体构型如下表。
分子或离子
σ键电
子对数
中心原子上的孤电子对数
价层电
子对数
立体构型
a
x
b
(a?xb)
分
子
CO2
2
4
2
2
0
2
直线形
BeCl2
2
2
2
1
0
2
直线形
SO2
2
6
2
2
1
3
V形
SO3
3
6
3
2
0
3
平面三角形
NH3
3
5
3
1
1
4
三角锥形
H2O
2
6
2
1
2
4
V形
CH4(CCl4)
4
4
4
1
0
4
正四面体形
离
子
H3O+
3
6?1=5
3
1
1
4
三角锥形
3
4+2=6
3
2
0
3
平面三角形
4
6+2=8
4
2
0
4
正四面体形
3
7+1=8
3
2
1
4
三角锥形
注意:当中心原子无孤电子对时,VSEPR模型与分子的立体构型一致;当中心原子有孤电子对时,VSEPR模型与分子的立体构型不一致。
运用价电子对互斥理论的注意事项
1.利用价层电子对互斥理论判断分子的立体构型时应注意:价层电子对互斥理论模型是电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。 2.二者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,二者的构型一致;当中心原子上有孤电子对时,二者的构型不一致。
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。下列判断正确的是
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
【答案】C
二、用价层电子对互斥理论推测分子或离子立体构型时的易错点
1.计算阴、阳离子的中心原子的价层电子对数目时未考虑离子所带电荷而计算错误。
2.用电子式或路易斯结构式判断中心原子的价层电子对数时,未将双键或三键当一对价层电子对计算导致错误。
3.不能准确区别和判断孤电子对和成键电子对。判断ABn型分子中孤电子对数的简单方法为孤电子对数=价层电子对数?成键电子对数。
4.误将VSEPR模型的立体结构当成分子或离子的空间构型。
5.错误利用相似性规律判断分子或离子的空间构型。
下列各组分子的立体构型相同的是
A.SnCl2、BeCl2 B.BF3、NH3 C.CCl4、SiF4 D.CS2、OF2
【解析】通过分子的价层电子对数、孤电子对数确定分子的立体构型,例如A、D中物质
成键电子对数
中心原子上的
孤电子对数
价层电子对数
立体构型
SnCl2
2
(4?2×1)=1
3
V形
BeCl2
2
(2?2×1)=0
2
直线形
CS2
2
(4?2×2)=0
2
直线形
OF2
2
(6?2×1)=2
4
V形
B中BF3、NH3的立体构型分别为平面三角形、三角锥形;C项中,CCl4与SiF4的立体构型均为正四面体形。
【答案】C
1.下列分子的立体结构模型正确的是
A.CO2的立体结构模型
B.PH3的立体结构模型
C.H2S的立体结构模型
D.CH4的立体结构模型
2.下列分子或离子的中心原子,带有一对孤电子对的是
A.H2O B.BeCl2 C.CH4 D.PCl3
3.下列分子或离子中,中心原子价层电子对的立体构型为正四面体形且分子或离子的立体构型为V形的是
A. B.PH3 C.H3O+ D.OF2
4.用价层电子对互斥理论判断SO3的立体构型为
A.正四面体形 B.V形
C.三角锥形 D.平面三角形
5.据报道,大气中存在一种潜在的温室气体SF5—CF3,虽然其数量有限,但它是已知气体中吸热最高的气体。关于SF5—CF3的说法正确的是
A.分子中有σ键也有π键
B.所有原子在同一平面内
C.CF4与CH4都是正四面体结构
D.0.1 mol SF5—CF3分子中电子数为8 mol
6.研究表明:H2O2具有立体结构,两个氢原子像在半展开一本书的两页上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°,如图所示,下列说法错误的是
A.H2O2分子中既有极性键又有非极性键
B.H2O2分子为含有非极性键的极性分子
C.H2O2分子为非极性分子
D.H2O2分子为既含极性键又含非极性键的极性分子
7.膦(PH3)又称磷化氢,在常温下是一种无色、有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的立体构型是三角锥形。则下列关于PH3的叙述正确的是
A.PH3分子中有未成键的孤电子对
B.PH3是空间对称结构
C.PH3是一种强氧化剂
D.PH3分子中的P—H键间夹角是90°
8.试回答下列问题:
(1)指出下列分子或离子的空间构型:____________;CS2____________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据如图所示的两种微粒的球棍模型,写出相应的化学式:A____________;B____________。
A B
(3)按要求写出由第2周期非金属主族元素原子构成的分子的化学式:
平面三角形分子____________,三角锥形分子____________,正四面体形分子____________。
(4)下列微粒中键角由大到小的顺序为____________ (填序号)。
①HCN ②SiF4 ③SCl2 ④ ⑤H3O+
1.【答案】D
【解析】CO2分子的立体构型是直线形,A不正确;PH3与NH3的立体构型相同为三角锥形,B不正确;H2S与H2O的立体构型相似均为V形,C不正确;CH4的立体构型为正四面体形,D正确。
2.【答案】D
3.【答案】D
【解析】中心原子价层电子对的立体构型为正四面体形,且分子或离子的立体构型为V形的只有3个原子构成的分子或离子,OF2为V形结构。A选项是三角锥形的NH3结合了一个H+,呈正四面体形,B项中PH3为三角锥形,C中H3O+是V形的H2O结合了一个H+,呈三角锥形。
4.【答案】D
【解析】SO3中的S原子表现+6价,S原子的价电子全部用于形成了共价键,S周围有3个氧原子,故选D。
5.【答案】C
【解析】A项,分子中都是σ键,无π键,错误;B项,碳原子与其相连的四个原子形成四面体结构,不可能所有原子共平面;D项,一个分子中有94个电子,错误。
6.【答案】C
【解析】由同种元素构成的O—O键为非极性键,由不同种元素构成的O—H键为极性键。由题意可知,两个O—H键与O—O键处于不对称的位置上,所以H2O2分子为极性分子。
7.【答案】A
8.【答案】(1)正四面体形 直线形 (2)
(3)BF3 NF3 CF4 (4)①④②⑤③
【解析】(1)中无孤电子对,空间构型为正四面体形;CS2分子的空间构型与CO2一样,为直线形。
(2)含有1个碳原子和3个氢原子且为平面结构的微粒应该是,无孤电子对。含有1个碳原子和3个氢原子且为三角锥形结构的微粒应该是,有一个孤电子对。
(3)第2周期的五种非金属主族元素原子B、C、N、O、F构成的分子中,平面三角形分子为BF3,三角锥形分子为NF3,正四面体形分子为CF4。
(4)①HCN为直线形分子,键角为180°;②SiF4为正四面体形结构,键角为109°28′;③SCl2为V形结构,键角接近104.5°;④为平面三角形结构,键角为120°;⑤H3O+为三角锥形结构,键角接近107.3°。所以键角由大到小的顺序为①④②⑤③。
元素周期表结构
七主七副七周期,Ⅷ族0族镧锕系;熟记三个短周期,位性皆由结构定。
对族序的巧记
族序逐个加,两主五副随,族序一七零,两副五主零。
元素周期表的巧记
十八纵行十六族,七主七副Ⅷ和0;八九十行成Ⅷ族,每逢二三分主副;七个周期分长短,三长三短一不全;镧系锕系各十五,都在ⅢB里边住。
