常见的酸复习[上学期]
图片预览










文档简介
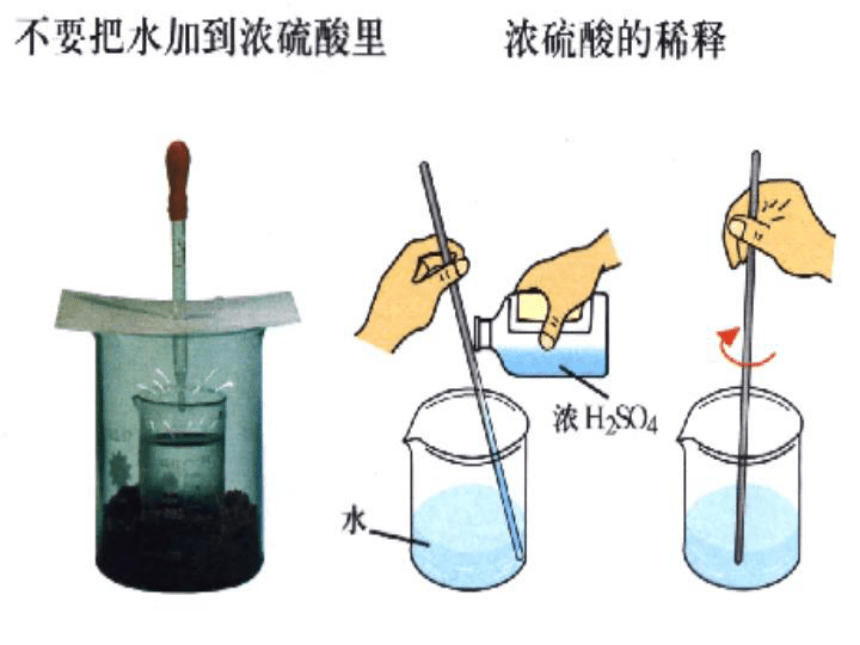
课件40张PPT。2004年5月31日星期一 第二节 常见的酸 一、硫酸2004年5月31日星期一2004年5月31日星期一 (一)、硫酸的物理性质 2、 浓硫酸有吸水性,可作某些气体干燥剂。1、纯硫酸是无色、粘稠、油状的液体(H2S04)问: 浓硫酸如果敞口存放,结果会怎样?3、脱水性,具有强腐蚀性。纯硫酸是无色粘稠油状液体, 难挥发,密度较大,约为1.84g/cm3 ,可与水互溶。根据上述性质,如何不用任何试剂把两个相同试剂瓶中的浓、稀硫酸溶液区别开?浓硫酸能干燥:H2、O2、SO2、Cl2、HCl、CO2 等吸水:直接与水分子作用脱水:夺取氢、氧元素(2:1),生成水2004年5月31日星期一错误操作:由于浓硫酸密度比水大,浮在上面,而浓硫酸溶于水时, 放出大量的热,会产生局部高温,使水沸腾,造成液滴飞溅出来。正确操作:把浓硫酸慢慢地倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。浓硫酸的稀释2004年5月31日星期一2004年5月31日星期一1.怎样稀释浓硫酸?2.如果皮肤或衣服上不小心沾了浓硫酸,
怎样处理? 稀释浓硫酸时须把浓硫酸慢慢地沿着玻璃棒或容器壁倒入水中,并不断搅拌,使产生的热量迅速扩散,切不可把水倒进浓硫酸里。 如果皮肤或衣服上不小心沾了浓硫酸, 应立即用布拭去,再用大量的水冲洗。2004年5月31日星期一(二)、稀硫酸的化学性质 1、稀硫酸能使紫色石蕊试液变红色,
无色酚酞试液不变色。2、稀硫酸能和锌、铁等金属反应,
产生氢气。 Zn + H2SO4 =ZnSO4 + H2↑ Fe + H2SO4 =FeSO4 + H2↑2004年5月31日星期一2004年5月31日星期一CuO+H2SO43、稀硫酸能和某些金属氧化物反应(现象:黑色固体逐渐消失,溶液变淡蓝色)Fe203+3H2S04 (现象:铁锈逐渐消失,溶液变浅黄色——工业去锈) 4、稀硫酸能和氢氧化铜反应Cu(OH)2+ H2SO4(现象:蓝色固体消失,溶液变蓝色 )== CuSO4+H2O == Fe2(S04)3+3H20== CuSO4+H2O2004年5月31日星期一2004年5月31日星期一5、检验硫酸根H2SO4 +BaCl2==BaSO4↓(白色) +2HCl 白色沉淀不溶于稀硝酸。此实验可检验硫酸及其他能电离出S042-的化合物。2004年5月31日星期一检验硫酸根离子的方法:
1、用一洁净试管取少量稀硫酸,然后向试管中滴加 溶液产生白色沉淀,再加 ,白色沉淀不溶解,即可证明溶液中含有 S042-离子 。氯化钡稀硝酸2004年5月31日星期一2、检验硫酸是酸(检验H+ )的方法:
(1)向盛有稀硫酸的试管中滴加
试液,使试液变红;
(2)向盛有稀硫酸的试管里放入 ,生成氢气。锌粒紫色的石蕊2004年5月31日星期一 1、浓硫酸是 、 的液体。浓硫酸是一种难挥发的酸。浓硫酸有三大特性:
(1)具有吸水性,故常用浓硫酸做 。
(2)浓硫酸有 ,若不慎将浓硫酸洒到衣服、皮肤等有机物上,浓硫酸能使有机物碳化。所以,若不慎将浓硫酸溅到皮肤上,应立即 ,然后用大量的 。
(3)浓硫酸有氧化性,是强氧化剂。
2、由于浓硫酸有吸水性,所以敞口露置在空气中,其溶液质量 ,溶质质量分数 。巩固练习无色 黏稠油状干燥剂脱水性用布拭去水冲洗大小2004年5月31日星期一3、稀释浓硫酸时,不能向盛有浓硫酸的烧杯里注入水。因为浓硫酸的密度比水 ,并且溶于水时放出 。稀释浓硫酸时,若把水倒入浓硫酸中,水只能浮在浓硫酸上面,水与浓硫酸接触面的浓硫酸溶解同时放出大量热,此时不在接触面的浓硫酸和水是冷的,冷、热不均使液体溅出,易伤人。所以稀释浓硫酸时,一定要把浓硫酸沿着 (一般都用烧杯)慢慢注入水中,并且一边倒一边 ,使产生的热量迅速扩散。大大量的热器壁搅拌2004年5月31日星期一 第二节 常见的酸 二、盐酸2004年5月31日星期一2004年5月31日星期一(一)、盐酸(HCl) 的物理性质问: 浓盐酸如果敞口存放,结果会怎样?质量变小,质量分数变小;
溶质减少,溶剂不变。 纯净的盐酸是无色透明并有刺激性气味和酸味的液体,工业用盐酸呈黄色(Fe3+的缘故),浓盐酸有挥发性,有腐蚀性,浓盐酸在空气中会生成白雾——盐酸小液滴。 盐酸(HCl)是氯化氢的水溶液2004年5月31日星期一2004年5月31日星期一跟指示剂的反应
跟金属的反应
跟金属氧化物的反应
跟碱的反应
跟硝酸银的反应 (二)、盐酸的化学性质2004年5月31日星期一 (二)、盐酸的化学性质:l.盐酸能使紫色石蕊试液变红色,
无色酚酞不变色。 2.盐酸能和某些金属反应,生成氢气: Zn+2HCl=ZnCl2+H2 ↑ Fe+2HCl=FeCl2+H2↑2004年5月31日星期一 3.盐酸能和金属氧化物反应: Fe2O3+6HCl=2FeCl3+3H2O 铁锈逐渐消失,溶液变黄色。 CuO+2HCl=CuCl2+H20 黑色固体逐渐消失,溶液变蓝绿色。4.盐酸能和氢氧化铜反应:Cu(OH)2+2HCl=CuCl2+2H20 蓝色固体消失,溶液变蓝绿色。2004年5月31日星期一5.盐酸能和硝酸银反应: HCl+AgNO3==AgCl↓(白色)+HN03 白色沉淀不溶于稀硝酸。
此反应可鉴定Cl-离子。 AgCl沉淀和BaSO4沉淀一样,是一种
既不溶于水,又不溶于酸的沉淀。 Na2C03+2AgNO3=Ag2C03↓+2NaN03
Ag2C03+2HN03=2AgN03+H20+C02↑2004年5月31日星期一练习: 在某一无色的溶液中滴加BaCl2溶液,结果产生白色沉淀,该沉淀不溶于稀硝酸。这可证明此溶液中有什么离子?2004年5月31日星期一常见酸的练习2004年5月31日星期一1、H2、O2、CO2三种气体都能用浓硫酸做干燥剂,是因为浓硫酸具有 ( ) A、脱水性 B、酸性 C、吸水性 D、氧化性 C 2004年5月31日星期一2、浓盐酸、浓硫酸在空气中敞口放置一段时间后(假设水分没蒸发),这两种溶液 ( ) A、都会变质 B、溶质质量都不改变 C、溶液体积都变大 D、溶质的质量分数都变小 D 2004年5月31日星期一3、鉴别盐酸和稀硫酸的试剂是 ( ) A、氢氧化钠溶液 B、硝酸银溶液 C、氯化钡溶液 D、紫色石蕊试液 C2004年5月31日星期一4、把下列固体物质分别放入足量的盐酸中,固体全部溶解的是(1)Mg(2)BaSO4(3)Cu(4)CuO(5)CaCO3 ( ) A、(1)(2)(3) B、(2)(3) C、(1 )(3)(4) D、(1)(4)(5) D2004年5月31日星期一5、为了使硫酸溶液的导电性消失,应滴加适量的 ( ) A、NaOH溶液 B、Ba(NO3)2 溶液 C、Ba(OH)2溶液 D、NaCl溶液 C2004年5月31日星期一6 碳酸根离子的检验1.试剂稀盐酸 澄清石灰水2.现象大量的气泡 石灰水变浑浊3.化学方程式CaCO3+2HCl=CaCl2+H2O+CO22004年5月31日星期一7、下列物质可以用金属和盐酸反应直接制得的是 ( ) A、FeCl3 B、FeCl2 C、CuCl2 D、AgCl B2004年5月31日星期一8、下列物质和盐酸反应生成白色沉淀的是 ( ) A、Fe B、CuO C、NaOH溶液 D、AgNO3溶液D2004年5月31日星期一9、在人的胃液中含有少量盐酸有助消化,若胃酸过多会吐酸水,可用来治胃酸过多的药物中主要含有 ( ) A、ZnSO4 B、NaCl C、Al(OH)3 D、AgNO3C2004年5月31日星期一10、下列物质和盐酸反应生成黄色溶液的是 ( )
A、Fe B、MgO C、Cu(OH)2 D、Fe(OH)3 D2004年5月31日星期一11、下列物质中能和盐酸反应,既不生成沉淀,又无气体放出且溶液呈无色的是( )A、AgNO3 B、MgO C、Na2CO3 D、CuOB2004年5月31日星期一12、下列物质能与稀硫酸反应且放出气体的是( )A、NaOH B、CuO C、BaCl2 D、Na2CO3 D2004年5月31日星期一13、除去盐酸中混入的少量硫酸,选用的试剂是 ( )
A、BaCl2溶液 B、硝酸银溶液 C、水 D、石灰水A2004年5月31日星期一除杂质的要求1.不增:就是不增加新的杂质2.不变:不把原物质反应了3.易分:把杂质变成沉淀 气体或水,
或变成原物质就是所加试剂与原物质”沾亲带故”,
即阳离子或阴离子与原物质相同.2004年5月31日星期一14、有一种无色溶液可使紫色石蕊试液变红色,还能和BaCl2溶液产生白色沉淀,这种溶液可能是 ( )
A、盐酸 B、稀硫酸 C、硫酸钠溶液 D、石灰水B
怎样处理? 稀释浓硫酸时须把浓硫酸慢慢地沿着玻璃棒或容器壁倒入水中,并不断搅拌,使产生的热量迅速扩散,切不可把水倒进浓硫酸里。 如果皮肤或衣服上不小心沾了浓硫酸, 应立即用布拭去,再用大量的水冲洗。2004年5月31日星期一(二)、稀硫酸的化学性质 1、稀硫酸能使紫色石蕊试液变红色,
无色酚酞试液不变色。2、稀硫酸能和锌、铁等金属反应,
产生氢气。 Zn + H2SO4 =ZnSO4 + H2↑ Fe + H2SO4 =FeSO4 + H2↑2004年5月31日星期一2004年5月31日星期一CuO+H2SO43、稀硫酸能和某些金属氧化物反应(现象:黑色固体逐渐消失,溶液变淡蓝色)Fe203+3H2S04 (现象:铁锈逐渐消失,溶液变浅黄色——工业去锈) 4、稀硫酸能和氢氧化铜反应Cu(OH)2+ H2SO4(现象:蓝色固体消失,溶液变蓝色 )== CuSO4+H2O == Fe2(S04)3+3H20== CuSO4+H2O2004年5月31日星期一2004年5月31日星期一5、检验硫酸根H2SO4 +BaCl2==BaSO4↓(白色) +2HCl 白色沉淀不溶于稀硝酸。此实验可检验硫酸及其他能电离出S042-的化合物。2004年5月31日星期一检验硫酸根离子的方法:
1、用一洁净试管取少量稀硫酸,然后向试管中滴加 溶液产生白色沉淀,再加 ,白色沉淀不溶解,即可证明溶液中含有 S042-离子 。氯化钡稀硝酸2004年5月31日星期一2、检验硫酸是酸(检验H+ )的方法:
(1)向盛有稀硫酸的试管中滴加
试液,使试液变红;
(2)向盛有稀硫酸的试管里放入 ,生成氢气。锌粒紫色的石蕊2004年5月31日星期一 1、浓硫酸是 、 的液体。浓硫酸是一种难挥发的酸。浓硫酸有三大特性:
(1)具有吸水性,故常用浓硫酸做 。
(2)浓硫酸有 ,若不慎将浓硫酸洒到衣服、皮肤等有机物上,浓硫酸能使有机物碳化。所以,若不慎将浓硫酸溅到皮肤上,应立即 ,然后用大量的 。
(3)浓硫酸有氧化性,是强氧化剂。
2、由于浓硫酸有吸水性,所以敞口露置在空气中,其溶液质量 ,溶质质量分数 。巩固练习无色 黏稠油状干燥剂脱水性用布拭去水冲洗大小2004年5月31日星期一3、稀释浓硫酸时,不能向盛有浓硫酸的烧杯里注入水。因为浓硫酸的密度比水 ,并且溶于水时放出 。稀释浓硫酸时,若把水倒入浓硫酸中,水只能浮在浓硫酸上面,水与浓硫酸接触面的浓硫酸溶解同时放出大量热,此时不在接触面的浓硫酸和水是冷的,冷、热不均使液体溅出,易伤人。所以稀释浓硫酸时,一定要把浓硫酸沿着 (一般都用烧杯)慢慢注入水中,并且一边倒一边 ,使产生的热量迅速扩散。大大量的热器壁搅拌2004年5月31日星期一 第二节 常见的酸 二、盐酸2004年5月31日星期一2004年5月31日星期一(一)、盐酸(HCl) 的物理性质问: 浓盐酸如果敞口存放,结果会怎样?质量变小,质量分数变小;
溶质减少,溶剂不变。 纯净的盐酸是无色透明并有刺激性气味和酸味的液体,工业用盐酸呈黄色(Fe3+的缘故),浓盐酸有挥发性,有腐蚀性,浓盐酸在空气中会生成白雾——盐酸小液滴。 盐酸(HCl)是氯化氢的水溶液2004年5月31日星期一2004年5月31日星期一跟指示剂的反应
跟金属的反应
跟金属氧化物的反应
跟碱的反应
跟硝酸银的反应 (二)、盐酸的化学性质2004年5月31日星期一 (二)、盐酸的化学性质:l.盐酸能使紫色石蕊试液变红色,
无色酚酞不变色。 2.盐酸能和某些金属反应,生成氢气: Zn+2HCl=ZnCl2+H2 ↑ Fe+2HCl=FeCl2+H2↑2004年5月31日星期一 3.盐酸能和金属氧化物反应: Fe2O3+6HCl=2FeCl3+3H2O 铁锈逐渐消失,溶液变黄色。 CuO+2HCl=CuCl2+H20 黑色固体逐渐消失,溶液变蓝绿色。4.盐酸能和氢氧化铜反应:Cu(OH)2+2HCl=CuCl2+2H20 蓝色固体消失,溶液变蓝绿色。2004年5月31日星期一5.盐酸能和硝酸银反应: HCl+AgNO3==AgCl↓(白色)+HN03 白色沉淀不溶于稀硝酸。
此反应可鉴定Cl-离子。 AgCl沉淀和BaSO4沉淀一样,是一种
既不溶于水,又不溶于酸的沉淀。 Na2C03+2AgNO3=Ag2C03↓+2NaN03
Ag2C03+2HN03=2AgN03+H20+C02↑2004年5月31日星期一练习: 在某一无色的溶液中滴加BaCl2溶液,结果产生白色沉淀,该沉淀不溶于稀硝酸。这可证明此溶液中有什么离子?2004年5月31日星期一常见酸的练习2004年5月31日星期一1、H2、O2、CO2三种气体都能用浓硫酸做干燥剂,是因为浓硫酸具有 ( ) A、脱水性 B、酸性 C、吸水性 D、氧化性 C 2004年5月31日星期一2、浓盐酸、浓硫酸在空气中敞口放置一段时间后(假设水分没蒸发),这两种溶液 ( ) A、都会变质 B、溶质质量都不改变 C、溶液体积都变大 D、溶质的质量分数都变小 D 2004年5月31日星期一3、鉴别盐酸和稀硫酸的试剂是 ( ) A、氢氧化钠溶液 B、硝酸银溶液 C、氯化钡溶液 D、紫色石蕊试液 C2004年5月31日星期一4、把下列固体物质分别放入足量的盐酸中,固体全部溶解的是(1)Mg(2)BaSO4(3)Cu(4)CuO(5)CaCO3 ( ) A、(1)(2)(3) B、(2)(3) C、(1 )(3)(4) D、(1)(4)(5) D2004年5月31日星期一5、为了使硫酸溶液的导电性消失,应滴加适量的 ( ) A、NaOH溶液 B、Ba(NO3)2 溶液 C、Ba(OH)2溶液 D、NaCl溶液 C2004年5月31日星期一6 碳酸根离子的检验1.试剂稀盐酸 澄清石灰水2.现象大量的气泡 石灰水变浑浊3.化学方程式CaCO3+2HCl=CaCl2+H2O+CO22004年5月31日星期一7、下列物质可以用金属和盐酸反应直接制得的是 ( ) A、FeCl3 B、FeCl2 C、CuCl2 D、AgCl B2004年5月31日星期一8、下列物质和盐酸反应生成白色沉淀的是 ( ) A、Fe B、CuO C、NaOH溶液 D、AgNO3溶液D2004年5月31日星期一9、在人的胃液中含有少量盐酸有助消化,若胃酸过多会吐酸水,可用来治胃酸过多的药物中主要含有 ( ) A、ZnSO4 B、NaCl C、Al(OH)3 D、AgNO3C2004年5月31日星期一10、下列物质和盐酸反应生成黄色溶液的是 ( )
A、Fe B、MgO C、Cu(OH)2 D、Fe(OH)3 D2004年5月31日星期一11、下列物质中能和盐酸反应,既不生成沉淀,又无气体放出且溶液呈无色的是( )A、AgNO3 B、MgO C、Na2CO3 D、CuOB2004年5月31日星期一12、下列物质能与稀硫酸反应且放出气体的是( )A、NaOH B、CuO C、BaCl2 D、Na2CO3 D2004年5月31日星期一13、除去盐酸中混入的少量硫酸,选用的试剂是 ( )
A、BaCl2溶液 B、硝酸银溶液 C、水 D、石灰水A2004年5月31日星期一除杂质的要求1.不增:就是不增加新的杂质2.不变:不把原物质反应了3.易分:把杂质变成沉淀 气体或水,
或变成原物质就是所加试剂与原物质”沾亲带故”,
即阳离子或阴离子与原物质相同.2004年5月31日星期一14、有一种无色溶液可使紫色石蕊试液变红色,还能和BaCl2溶液产生白色沉淀,这种溶液可能是 ( )
A、盐酸 B、稀硫酸 C、硫酸钠溶液 D、石灰水B
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
