酸的复习[上学期]
图片预览






文档简介
课件16张PPT。酸的复习什么是酸?酸的分类和命名硫酸和盐酸酸的通性酸的复习酸的含义电离时生成的阳离子全部是氢离子的化合物叫酸酸=H++酸根阴离子练习:完成下列电离方程式:
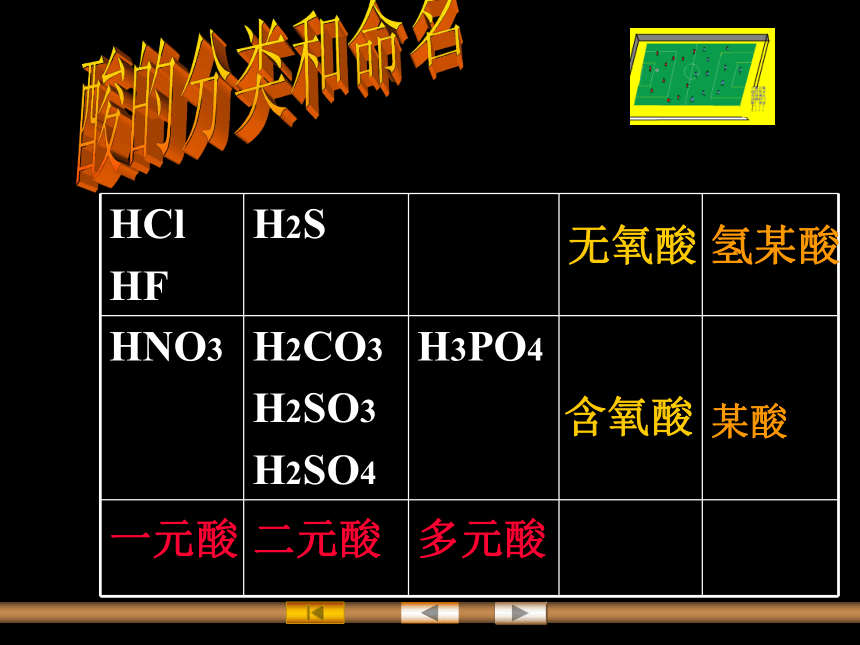
H2SO4 HCl HNO3 HnY Hn-1XOn+1酸的分类和命名一元酸二元酸多元酸 含氧酸 无氧酸氢某酸某酸硫酸和盐酸硫酸和盐酸酸的通性1.酸能使紫色石蕊试液变 , 使无色酚酞试液
变色.
2.酸能与某些金属发生 反应,生成相应的盐和氢气.
3.酸能与金属氧化物反应,生成 .
4.酸能与碱发生 反应,生成 .
5.酸能与某些盐发生 反应,生成 。 金属活动性顺序红不置换盐和水复分解盐和水复分解新酸和新盐金属活动性顺序K Mg Al Sn Pb
H Cu Hg Ag Pt AuCa NaZn Fe意义:在金属活动性顺序中,越排在前面的金属,活动性越强,在水溶液中越容易失去电子变成离子.应用:排在氢前面的金属能置换出酸中的氢.1.能确定某物质是酸的是( )
A.能与金属反应 B.能使指示剂变色
C.溶液能导电D.电离时生成的阳离子全部是氢离子
2.氯酸钾(KClO3)是一种盐,其对应的酸读作 .
3.下列能与硫酸反应的物质有 ,
能反应的写出化学方程式:
Mg Cu CuO CO2 H2O FeO
Cu(OH)2 Ba(OH)2 BaCl2 Ba(NO3)2 练习D氯酸练习4.一枚生锈的铁钉放入稀硫酸中,可观察到的现象有 ,写出反应的化学方程式为: .?15、将相同质量的镁、铝、铁、锌投入足量的稀硫酸中,产生氢气最快的是 ,生成氢气最多的是 ,如生成氢气的质量与反应时间的关系如下图,则a、b、c、d分别为 。
镁铝镁、铝、锌、铁练习6、设计一个实验证明:
能使石蕊变红是稀盐酸中的H+离子,而不是Cl-,也不是其中的H2O分子
谢谢指导Mg+H2SO4=MgSO4+H2
CuO+H2SO4=CuSO4+H2O
FeO+H2SO4=FeSO4+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
Ba(OH)2+H2SO4=BaSO4 +2H2O
BaCl2+H2SO4=BaSO4 +2HCl
Ba(NO3)2+H2SO4=BaSO4 +HNO3现象:铁锈逐渐消失,溶液变成淡黄色,有气泡产生.H2SO4=2H++SO4 2-
HCl=H++Cl-
HNO3=H+ +NO3-
HnY=nH++Y n-
Hn-1XOn+1=(n-1)H++XO n+1(n-1)-思考:酸根离子所带电荷数与氢离子个数有何关系?复分解反应: 两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的条件:生成 物中有气体、沉淀或水生成。
H2SO4 HCl HNO3 HnY Hn-1XOn+1酸的分类和命名一元酸二元酸多元酸 含氧酸 无氧酸氢某酸某酸硫酸和盐酸硫酸和盐酸酸的通性1.酸能使紫色石蕊试液变 , 使无色酚酞试液
变色.
2.酸能与某些金属发生 反应,生成相应的盐和氢气.
3.酸能与金属氧化物反应,生成 .
4.酸能与碱发生 反应,生成 .
5.酸能与某些盐发生 反应,生成 。 金属活动性顺序红不置换盐和水复分解盐和水复分解新酸和新盐金属活动性顺序K Mg Al Sn Pb
H Cu Hg Ag Pt AuCa NaZn Fe意义:在金属活动性顺序中,越排在前面的金属,活动性越强,在水溶液中越容易失去电子变成离子.应用:排在氢前面的金属能置换出酸中的氢.1.能确定某物质是酸的是( )
A.能与金属反应 B.能使指示剂变色
C.溶液能导电D.电离时生成的阳离子全部是氢离子
2.氯酸钾(KClO3)是一种盐,其对应的酸读作 .
3.下列能与硫酸反应的物质有 ,
能反应的写出化学方程式:
Mg Cu CuO CO2 H2O FeO
Cu(OH)2 Ba(OH)2 BaCl2 Ba(NO3)2 练习D氯酸练习4.一枚生锈的铁钉放入稀硫酸中,可观察到的现象有 ,写出反应的化学方程式为: .?15、将相同质量的镁、铝、铁、锌投入足量的稀硫酸中,产生氢气最快的是 ,生成氢气最多的是 ,如生成氢气的质量与反应时间的关系如下图,则a、b、c、d分别为 。
镁铝镁、铝、锌、铁练习6、设计一个实验证明:
能使石蕊变红是稀盐酸中的H+离子,而不是Cl-,也不是其中的H2O分子
谢谢指导Mg+H2SO4=MgSO4+H2
CuO+H2SO4=CuSO4+H2O
FeO+H2SO4=FeSO4+H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
Ba(OH)2+H2SO4=BaSO4 +2H2O
BaCl2+H2SO4=BaSO4 +2HCl
Ba(NO3)2+H2SO4=BaSO4 +HNO3现象:铁锈逐渐消失,溶液变成淡黄色,有气泡产生.H2SO4=2H++SO4 2-
HCl=H++Cl-
HNO3=H+ +NO3-
HnY=nH++Y n-
Hn-1XOn+1=(n-1)H++XO n+1(n-1)-思考:酸根离子所带电荷数与氢离子个数有何关系?复分解反应: 两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的条件:生成 物中有气体、沉淀或水生成。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
