稀硫酸性质[上学期]
图片预览





文档简介
(共23张PPT)
稀硫酸
紫色石
蕊试液
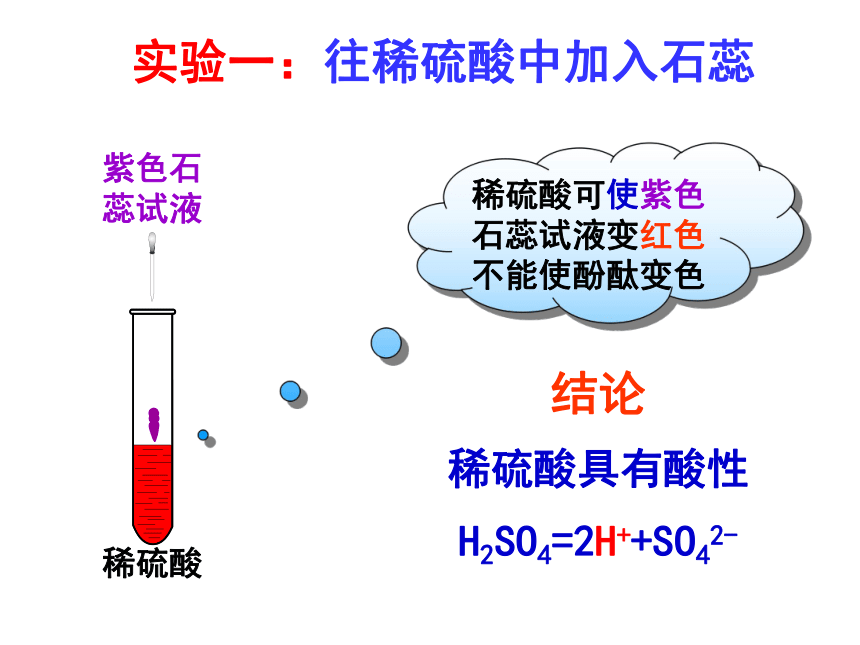
实验一:往稀硫酸中加入石蕊
结论
稀硫酸具有酸性
H2SO4=2H++SO42-
稀硫酸可使紫色石蕊试液变红色
不能使酚酞变色
锌粒
稀硫酸
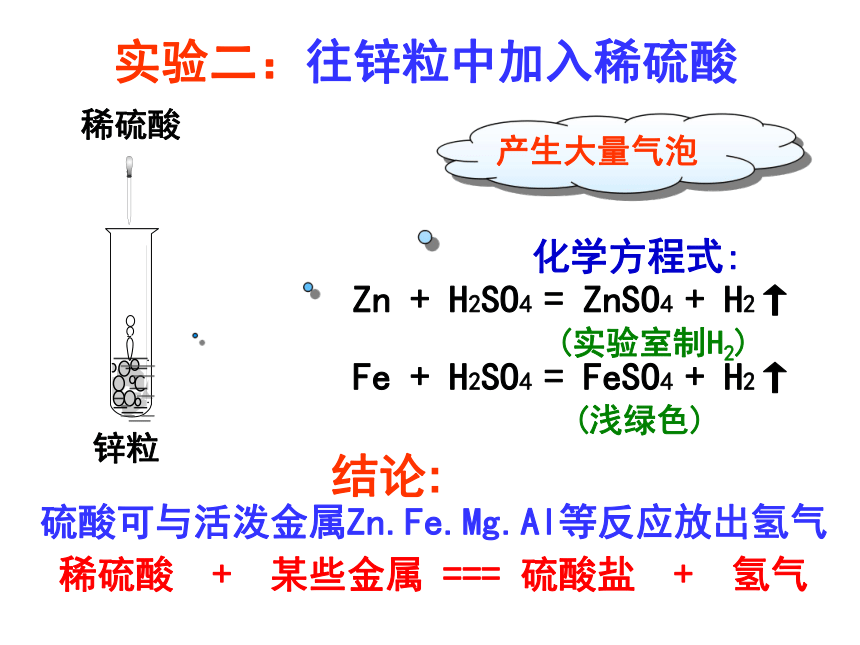
实验二:往锌粒中加入稀硫酸
硫酸可与活泼金属Zn.Fe.Mg.Al等反应放出氢气
稀硫酸 + 某些金属 === 硫酸盐 + 氢气
产生大量气泡
Zn + H2SO4 = ZnSO4 + H2↑
(实验室制H2)
Fe + H2SO4 = FeSO4 + H2↑
(浅绿色)
化学方程式:
结论:
原理:
金属蚀刻
强调:常见金属Cu.Ag等金属
不能和酸反应.
Mg + H2SO4 =_______________
Al + H2SO4 =________________
MgSO4 + H2↑
Al2(SO4)3 + H2↑
2
3
3
思考 如何除去铜粉中的铁粉
加过量酸后过滤或用磁铁吸引
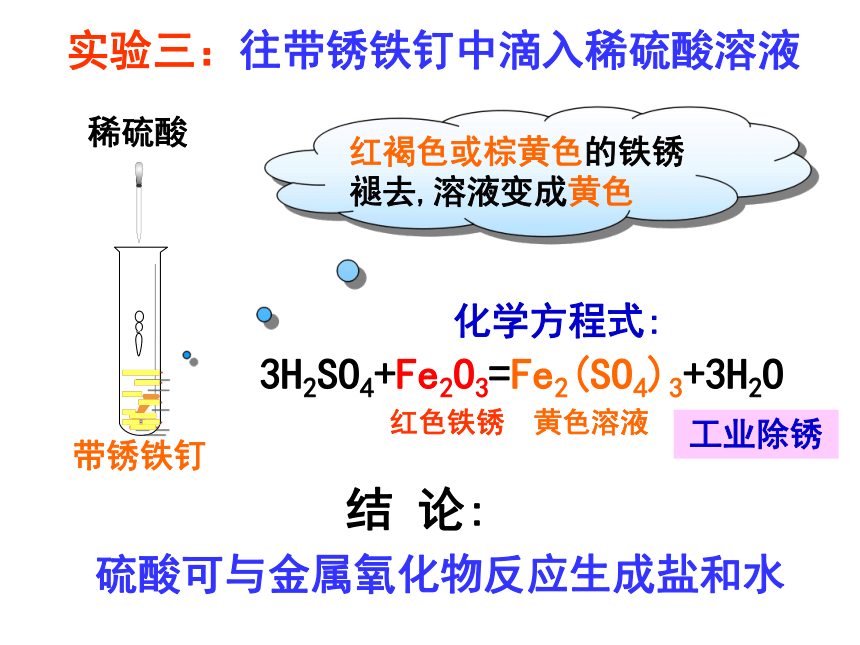
实验三:往带锈铁钉中滴入稀硫酸溶液
稀硫酸
带锈铁钉
结 论:
硫酸可与金属氧化物反应生成盐和水
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
红色铁锈 黄色溶液
红褐色或棕黄色的铁锈褪去,溶液变成黄色
化学方程式:
工业除锈
化学方程式:
结论:
稀硫酸
氧化铜
现象:黑色氧化铜溶解消失,溶液变成蓝色。
CuO + H2SO4 === CuSO4 + H2O
稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水
MgO + H2SO4 = _____________
Al2O3 + H2SO4 = ________________
ZnO + H2SO4 =________________
MgSO4 + H2O
Al2(SO4)3 + H2O
3
3
ZnSO4 + H2O
练习:
稀硫酸
酚酞
NaOH溶液
实验四:往酚酞NaOH溶液中滴入稀硫酸
结论:
硫酸与碱反应中和反应生成盐和水
H2SO4+2NaOH=Na2SO4+2H2O
现象: 无色→红色→无色
化学方程式:
(强酸强碱反应一般无现象)
现象:
化学方程式:
结论:
稀硫酸
氢氧化铜
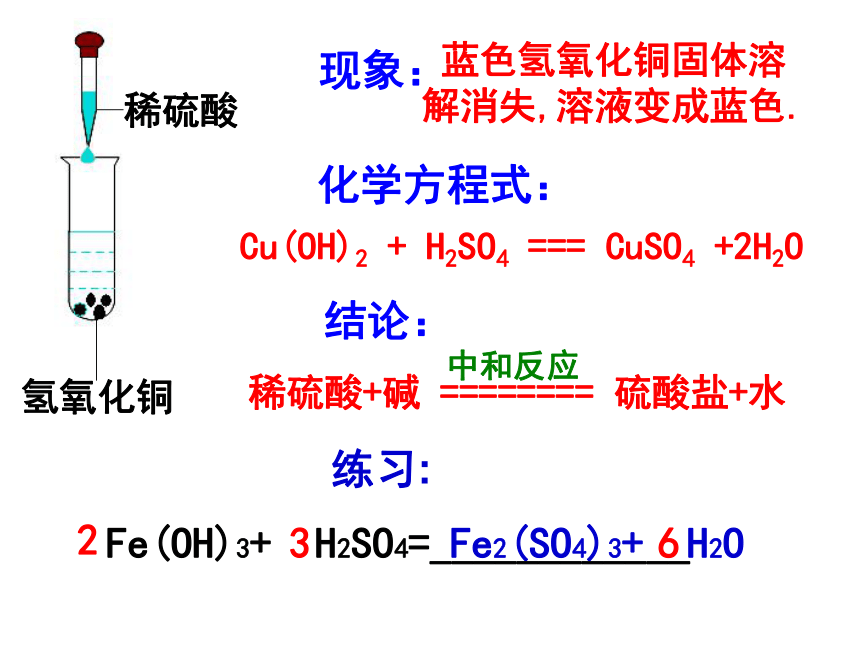
蓝色氢氧化铜固体溶解消失,溶液变成蓝色.
Cu(OH)2 + H2SO4 === CuSO4 +2H2O
稀硫酸+碱 ======== 硫酸盐+水
中和反应
练习:
Fe2(SO4)3+ H2O
3
6
2
Fe(OH)3+ H2SO4=____________
回顾旧知识:
实验室制取CO2的反应原理:
Na2CO3 +H2SO4==Na2SO4 + H2O +CO2↑
CaCO3 +2HCl == CaCl2↓ +H2O +CO2↑
灭火器的反应原理:
说明了酸能与盐反应生成新酸和新盐
碳酸盐 + 酸 == 盐 + H2O + CO2↑
碳酸根离子(CO32-)的检验:
(1)取样加盐酸,冒气泡
(2)将生成的气体通入澄清石灰水,变浑浊.
稀硫酸
BaCl2溶液
实验五:往稀硫酸溶液中滴入氯化钡溶液
结论:
H2SO4+BaCl2=BaSO4↓+H2O
稀硝酸
产生不溶于稀硝酸的白色沉淀
反应方程式:
酸+某些盐 → 新酸+新盐
化合物+化合物======化合物+化合物
交换
成分
(复分解反应)
练习: H2SO4+Ba(NO3)2=______________
BaSO4↓+ HNO3
2
化学方程式:H2SO4 +BaCl2 ==BaSO4↓+2HCl
重点内容: 硫酸根离子(SO42-)的检验
(即检验硫酸及可溶性硫酸盐)
取样
操作1:
滴加BaCl2或Ba(NO3)2
现象1:白色沉淀
操作2:
滴加稀硝酸(HNO3)
现象2:白色沉淀不溶于酸
得出结论:含SO42-
硫酸根离子(SO42-)的检验时,产生白色沉淀后,为何还要滴加稀硝酸呢
演示实验
碳酸钠
氯化钡
白色沉淀
滴加稀硝酸
白色沉淀溶解
检验SO42—时,要加几滴稀硝酸,目的是除去CO32-等杂质离子的干扰;因为CO32-与BaCl2溶液接触时,也有白色沉淀BaCO3生成,但BaCO3沉淀都溶于稀硝酸.
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
而BaSO4不溶于稀硝酸,所以在检验时一定要加些稀硝酸,如果白色沉淀不溶解,才能确认有SO42-.
Na2CO3+BaCl2==BaCO3↓+2NaCl
稀硫酸化学性质:
(1)与酸碱指示剂作用
能使紫色石蕊试液变红,无色酚酞不变色(仍为无色)
(2)跟某些金属单质反应
Zn + H2SO4==ZnSO4 +H2↑
Fe + H2SO4== FeSO4 + H2↑
(3)与金属氧化物反应
CuO + H2SO4==CuSO4 + H2O
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
(4)与氢氧化物(碱)反应
2NaOH+H2SO4==Na2SO4+2H2O
Cu(OH)2+H2SO4==CuSO4+2H2O
(5)与氯化钡溶液反应(与某些盐反应)
H2SO4 + BaCl2==BaSO4↓ +2HCl
(该反应用于检验SO42-)
浓硫酸特性:
吸水性
脱水性
不易挥发
SO42—的检验方法:滴加氯化钡(或硝酸钡)溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解.
如何检验某一瓶溶液是硫酸溶液?
(想一想:如何检验某一瓶溶液是硫酸溶液与检验硫酸根离子一样吗 )
1.取少量硫酸样品于试管中,滴加紫色石蕊试液,使试液变红,证明含有H+
(或取硫酸样品加锌粒冒气泡,证明含有H+)
2.取少量硫酸样品于试管中,滴加BaCl2试液和稀硝酸,产生不溶于酸的白色沉淀,证明含有SO42-
复分解反应的特征:
AB + CD === AD + CB
写出硫酸钠.硫酸铜和氯化钡溶液反应的化学方程式:
Na2SO4 +BaCl2==BaSO4 ↓+2NaCl
CuSO4 + BaCl2 ==BaSO4 ↓+ CuCl2
写出碳酸钠.碳酸钡跟硫酸反应的化学方程式:
Na2CO3 +H2SO4==Na2SO4 + H2O +CO2↑
BaCO3 +H2SO4 == BaSO4↓ +H2O +CO2↑
1.下列物质中不能跟稀硫酸反应的是( )
A.铁 B.氧化镁 C.二氧化碳 D.碳酸钠
C
2.下列物质不属于稀硫酸的用途的是( )
A.实验室制取氢气 B.实验室制取二氧化碳
C.工业除锈 D.制硫酸铵化肥
B
3.下列物质中,能除去铁制品表面铁锈的是( )
A.稀硫酸 B、水 C.氢氧化钠溶液 D.硫酸铜溶液
A
5.为了使硫酸溶液的导电性几乎降到零,应加入适量的( ) A.NaOH B.Na2CO3 C.Ca(OH)2 D.Ba(OH)2
A
4.下列四种物质中,能和其他三种物质反应的是( )
A.盐酸 B.锌 C.铁锈 D.氢氧化铜
A
A
6.在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )
A.ZnO B.Fe C.Cu(OH)2 D.Fe2O3
7.H2.O2.CO2三种气体都能用浓硫酸做干燥剂,是因为浓硫酸具有( ) A.脱水性 B.酸性 C.吸水性 D.氧化性
C
8.浓盐酸.浓硫酸在空气中敞口放置一段时间后(假设水分没蒸发),这两种溶液( ) A.都会变质 B.溶质质量都不改变 C.溶液体积都变大 D.溶质的质量分数都变小
D
9.下列物质能与稀硫酸反应且放出气体的是( )
A.NaOH B.CuO C.BaCl2 D.Na2CO3
D
10.下列描述属于物质化学性质的是( ) A.盐酸具有挥发性 B.浓硫酸的吸水性 C.HNO3的强氧化性 D.溶液的导电性
C
B
11.有一种无色溶液可使紫色石蕊试液变红色,还能和BaCl2溶液产生白色沉淀,这种溶液可能是( )
A.盐酸 B.稀硫酸 C.硫酸钠溶液 D.石灰水
12.下列属于中和反应的是( )
A.氧化铜和盐酸反应 B.纯碱和硫酸反应 C.氢氧化钡和硝酸反应 D.二氧化碳和石灰水反应
13.某三价金属的相对原子质量为27,它跟稀硫酸反应后生成的化合物的相对分子质量为( )
A.123 B.273 C.342 D.348
14.生活中接触到的下列物质中,不含酸的是( )
A.汽水 B.食醋 C.食盐 D.发酵后的面粉
15.下列说法正确的是( ) A.石蕊试液使盐酸变红 B.中和反应一定生成盐和水 C.生成盐和水的反应一定是中和反应 D.测定溶液的pH值时,应先将pH试纸用蒸馏水润湿
C
C
C
B
16.下列几种酸的命名错误的是( )
A.HCl 盐酸 B.HNO3 硝酸 C.H2SO4 氢硫酸 D.H2SiO3 硅酸
18.在H2R的分子中共有18个电子,则R表示的元素是( ),H2R的水溶液叫( ).
硫元素
氢硫酸
C
17.下列各酸中,既属于二元酸,又属于无氧酸的是( ) A.HNO3 B.H2S C.HCl D.H2CO3
B
19.16g铁和铜的混合物与50g稀硫酸恰好完全反应,生
成0.5g氢气,计算: (1)混合物中铁的质量是多少? (2)所用稀硫酸中硫酸的质量分数是多少? (3)生成物的溶液中,溶质的质量分数是多少?
20.用一定质量稀盐酸中和40g溶质质量分数10%的氢氧化钠溶液,当反应至溶液的pH=7时,所得溶液中溶质的质量分数为7.8%,试计算所用盐酸中溶质的质量分数
解:设消耗HCl和生成NaCl的质量分别为x、y, m NaOH =40 g×10%=4 g NaOH + HCl = NaCl + H2O 40 36.5 58.5 4g x y 40/4克 = 36.5/X 解得:x=3.65 g 40/4克 = 58.5/Y 解得:y=5.85 g m NaCl溶液 = 5.85/7.8% =75.0 g m 盐酸 =75.0 g-40 g=35 g HCl =3.65/35×100%=10.4% 答:盐酸中溶质的质量分数为10.4%。
稀硫酸
紫色石
蕊试液
实验一:往稀硫酸中加入石蕊
结论
稀硫酸具有酸性
H2SO4=2H++SO42-
稀硫酸可使紫色石蕊试液变红色
不能使酚酞变色
锌粒
稀硫酸
实验二:往锌粒中加入稀硫酸
硫酸可与活泼金属Zn.Fe.Mg.Al等反应放出氢气
稀硫酸 + 某些金属 === 硫酸盐 + 氢气
产生大量气泡
Zn + H2SO4 = ZnSO4 + H2↑
(实验室制H2)
Fe + H2SO4 = FeSO4 + H2↑
(浅绿色)
化学方程式:
结论:
原理:
金属蚀刻
强调:常见金属Cu.Ag等金属
不能和酸反应.
Mg + H2SO4 =_______________
Al + H2SO4 =________________
MgSO4 + H2↑
Al2(SO4)3 + H2↑
2
3
3
思考 如何除去铜粉中的铁粉
加过量酸后过滤或用磁铁吸引
实验三:往带锈铁钉中滴入稀硫酸溶液
稀硫酸
带锈铁钉
结 论:
硫酸可与金属氧化物反应生成盐和水
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
红色铁锈 黄色溶液
红褐色或棕黄色的铁锈褪去,溶液变成黄色
化学方程式:
工业除锈
化学方程式:
结论:
稀硫酸
氧化铜
现象:黑色氧化铜溶解消失,溶液变成蓝色。
CuO + H2SO4 === CuSO4 + H2O
稀硫酸 + 某些金属氧化物 === 硫酸盐 + 水
MgO + H2SO4 = _____________
Al2O3 + H2SO4 = ________________
ZnO + H2SO4 =________________
MgSO4 + H2O
Al2(SO4)3 + H2O
3
3
ZnSO4 + H2O
练习:
稀硫酸
酚酞
NaOH溶液
实验四:往酚酞NaOH溶液中滴入稀硫酸
结论:
硫酸与碱反应中和反应生成盐和水
H2SO4+2NaOH=Na2SO4+2H2O
现象: 无色→红色→无色
化学方程式:
(强酸强碱反应一般无现象)
现象:
化学方程式:
结论:
稀硫酸
氢氧化铜
蓝色氢氧化铜固体溶解消失,溶液变成蓝色.
Cu(OH)2 + H2SO4 === CuSO4 +2H2O
稀硫酸+碱 ======== 硫酸盐+水
中和反应
练习:
Fe2(SO4)3+ H2O
3
6
2
Fe(OH)3+ H2SO4=____________
回顾旧知识:
实验室制取CO2的反应原理:
Na2CO3 +H2SO4==Na2SO4 + H2O +CO2↑
CaCO3 +2HCl == CaCl2↓ +H2O +CO2↑
灭火器的反应原理:
说明了酸能与盐反应生成新酸和新盐
碳酸盐 + 酸 == 盐 + H2O + CO2↑
碳酸根离子(CO32-)的检验:
(1)取样加盐酸,冒气泡
(2)将生成的气体通入澄清石灰水,变浑浊.
稀硫酸
BaCl2溶液
实验五:往稀硫酸溶液中滴入氯化钡溶液
结论:
H2SO4+BaCl2=BaSO4↓+H2O
稀硝酸
产生不溶于稀硝酸的白色沉淀
反应方程式:
酸+某些盐 → 新酸+新盐
化合物+化合物======化合物+化合物
交换
成分
(复分解反应)
练习: H2SO4+Ba(NO3)2=______________
BaSO4↓+ HNO3
2
化学方程式:H2SO4 +BaCl2 ==BaSO4↓+2HCl
重点内容: 硫酸根离子(SO42-)的检验
(即检验硫酸及可溶性硫酸盐)
取样
操作1:
滴加BaCl2或Ba(NO3)2
现象1:白色沉淀
操作2:
滴加稀硝酸(HNO3)
现象2:白色沉淀不溶于酸
得出结论:含SO42-
硫酸根离子(SO42-)的检验时,产生白色沉淀后,为何还要滴加稀硝酸呢
演示实验
碳酸钠
氯化钡
白色沉淀
滴加稀硝酸
白色沉淀溶解
检验SO42—时,要加几滴稀硝酸,目的是除去CO32-等杂质离子的干扰;因为CO32-与BaCl2溶液接触时,也有白色沉淀BaCO3生成,但BaCO3沉淀都溶于稀硝酸.
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
而BaSO4不溶于稀硝酸,所以在检验时一定要加些稀硝酸,如果白色沉淀不溶解,才能确认有SO42-.
Na2CO3+BaCl2==BaCO3↓+2NaCl
稀硫酸化学性质:
(1)与酸碱指示剂作用
能使紫色石蕊试液变红,无色酚酞不变色(仍为无色)
(2)跟某些金属单质反应
Zn + H2SO4==ZnSO4 +H2↑
Fe + H2SO4== FeSO4 + H2↑
(3)与金属氧化物反应
CuO + H2SO4==CuSO4 + H2O
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
(4)与氢氧化物(碱)反应
2NaOH+H2SO4==Na2SO4+2H2O
Cu(OH)2+H2SO4==CuSO4+2H2O
(5)与氯化钡溶液反应(与某些盐反应)
H2SO4 + BaCl2==BaSO4↓ +2HCl
(该反应用于检验SO42-)
浓硫酸特性:
吸水性
脱水性
不易挥发
SO42—的检验方法:滴加氯化钡(或硝酸钡)溶液出现白色沉淀,再滴入稀硝酸沉淀不溶解.
如何检验某一瓶溶液是硫酸溶液?
(想一想:如何检验某一瓶溶液是硫酸溶液与检验硫酸根离子一样吗 )
1.取少量硫酸样品于试管中,滴加紫色石蕊试液,使试液变红,证明含有H+
(或取硫酸样品加锌粒冒气泡,证明含有H+)
2.取少量硫酸样品于试管中,滴加BaCl2试液和稀硝酸,产生不溶于酸的白色沉淀,证明含有SO42-
复分解反应的特征:
AB + CD === AD + CB
写出硫酸钠.硫酸铜和氯化钡溶液反应的化学方程式:
Na2SO4 +BaCl2==BaSO4 ↓+2NaCl
CuSO4 + BaCl2 ==BaSO4 ↓+ CuCl2
写出碳酸钠.碳酸钡跟硫酸反应的化学方程式:
Na2CO3 +H2SO4==Na2SO4 + H2O +CO2↑
BaCO3 +H2SO4 == BaSO4↓ +H2O +CO2↑
1.下列物质中不能跟稀硫酸反应的是( )
A.铁 B.氧化镁 C.二氧化碳 D.碳酸钠
C
2.下列物质不属于稀硫酸的用途的是( )
A.实验室制取氢气 B.实验室制取二氧化碳
C.工业除锈 D.制硫酸铵化肥
B
3.下列物质中,能除去铁制品表面铁锈的是( )
A.稀硫酸 B、水 C.氢氧化钠溶液 D.硫酸铜溶液
A
5.为了使硫酸溶液的导电性几乎降到零,应加入适量的( ) A.NaOH B.Na2CO3 C.Ca(OH)2 D.Ba(OH)2
A
4.下列四种物质中,能和其他三种物质反应的是( )
A.盐酸 B.锌 C.铁锈 D.氢氧化铜
A
A
6.在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )
A.ZnO B.Fe C.Cu(OH)2 D.Fe2O3
7.H2.O2.CO2三种气体都能用浓硫酸做干燥剂,是因为浓硫酸具有( ) A.脱水性 B.酸性 C.吸水性 D.氧化性
C
8.浓盐酸.浓硫酸在空气中敞口放置一段时间后(假设水分没蒸发),这两种溶液( ) A.都会变质 B.溶质质量都不改变 C.溶液体积都变大 D.溶质的质量分数都变小
D
9.下列物质能与稀硫酸反应且放出气体的是( )
A.NaOH B.CuO C.BaCl2 D.Na2CO3
D
10.下列描述属于物质化学性质的是( ) A.盐酸具有挥发性 B.浓硫酸的吸水性 C.HNO3的强氧化性 D.溶液的导电性
C
B
11.有一种无色溶液可使紫色石蕊试液变红色,还能和BaCl2溶液产生白色沉淀,这种溶液可能是( )
A.盐酸 B.稀硫酸 C.硫酸钠溶液 D.石灰水
12.下列属于中和反应的是( )
A.氧化铜和盐酸反应 B.纯碱和硫酸反应 C.氢氧化钡和硝酸反应 D.二氧化碳和石灰水反应
13.某三价金属的相对原子质量为27,它跟稀硫酸反应后生成的化合物的相对分子质量为( )
A.123 B.273 C.342 D.348
14.生活中接触到的下列物质中,不含酸的是( )
A.汽水 B.食醋 C.食盐 D.发酵后的面粉
15.下列说法正确的是( ) A.石蕊试液使盐酸变红 B.中和反应一定生成盐和水 C.生成盐和水的反应一定是中和反应 D.测定溶液的pH值时,应先将pH试纸用蒸馏水润湿
C
C
C
B
16.下列几种酸的命名错误的是( )
A.HCl 盐酸 B.HNO3 硝酸 C.H2SO4 氢硫酸 D.H2SiO3 硅酸
18.在H2R的分子中共有18个电子,则R表示的元素是( ),H2R的水溶液叫( ).
硫元素
氢硫酸
C
17.下列各酸中,既属于二元酸,又属于无氧酸的是( ) A.HNO3 B.H2S C.HCl D.H2CO3
B
19.16g铁和铜的混合物与50g稀硫酸恰好完全反应,生
成0.5g氢气,计算: (1)混合物中铁的质量是多少? (2)所用稀硫酸中硫酸的质量分数是多少? (3)生成物的溶液中,溶质的质量分数是多少?
20.用一定质量稀盐酸中和40g溶质质量分数10%的氢氧化钠溶液,当反应至溶液的pH=7时,所得溶液中溶质的质量分数为7.8%,试计算所用盐酸中溶质的质量分数
解:设消耗HCl和生成NaCl的质量分别为x、y, m NaOH =40 g×10%=4 g NaOH + HCl = NaCl + H2O 40 36.5 58.5 4g x y 40/4克 = 36.5/X 解得:x=3.65 g 40/4克 = 58.5/Y 解得:y=5.85 g m NaCl溶液 = 5.85/7.8% =75.0 g m 盐酸 =75.0 g-40 g=35 g HCl =3.65/35×100%=10.4% 答:盐酸中溶质的质量分数为10.4%。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
