高中化学鲁科版选修3第3章第二节 课时达标·效果检测(含解析)
文档属性
| 名称 | 高中化学鲁科版选修3第3章第二节 课时达标·效果检测(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 256.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-09 23:26:50 | ||
图片预览


文档简介
课时达标·效果检测
一、选择题
1. 在金属晶体中,自由电子与金属离子的碰撞中有能量传递,可以用此来解释的金属的物理性质是( )
A. 延展性 B. 导电性 C. 导热性 D. 还原性
【解析】选C。金属具有延展性主要是因为金属在受到外力作用时,原子之间可以发生相对滑动,各层金属原子之间仍然保持金属键的作用。金属具有导电性主要是因为金属晶体内部存在自由电子,在外电场的作用下,自由电子在金属内部发生定向运动。金属的还原性是金属的化学性质,与能量传递无关。金属的导热性主要是由于金属晶体内部,自由电子与金属离子的碰撞中有能量传递。因此选C。
【加固训练】金属晶体具有延展性的原因是( )
A. 金属键很微弱
B. 金属键没有饱和性
C. 密堆积层的阳离子容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键
D. 金属阳离子之间存在斥力
【解析】选C。金属晶体具有延展性是由于密堆积层的阳离子受到外力作用时容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键。
2. (双选)有关晶格能的叙述中正确的是( )
A. 晶格能是气态原子形成1 mol离子晶体释放的能量
B. 晶格能通常取正值,但是有时也取负值
C. 晶格能越大,形成的离子晶体越稳定
D. 晶格能越大,物质的硬度越大
【解析】选C、D。晶格能是将1 mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量,晶格能取正值,且晶格能越大,晶体越稳定,熔、沸点越高,硬度越大。
3. 下列说法中正确的是( )
A. 固态时能导电的晶体一定是金属晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
【解析】选D。离子晶体是由阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电;熔融状态时,离子化合物电离,能够导电。而石墨晶体固态时也能导电。
4. 元素X的某价态离子Xn+与N3-所形成晶体的结构单元如图所示,则Xn+中n的值为( )
A. 1 B. 2 C. 3 D. 4
【解析】选A。晶胞中小黑点为12×1/4=3,空心圆圈为8×1/8=1,根据化学式中化合价代数和为0,则n=1。
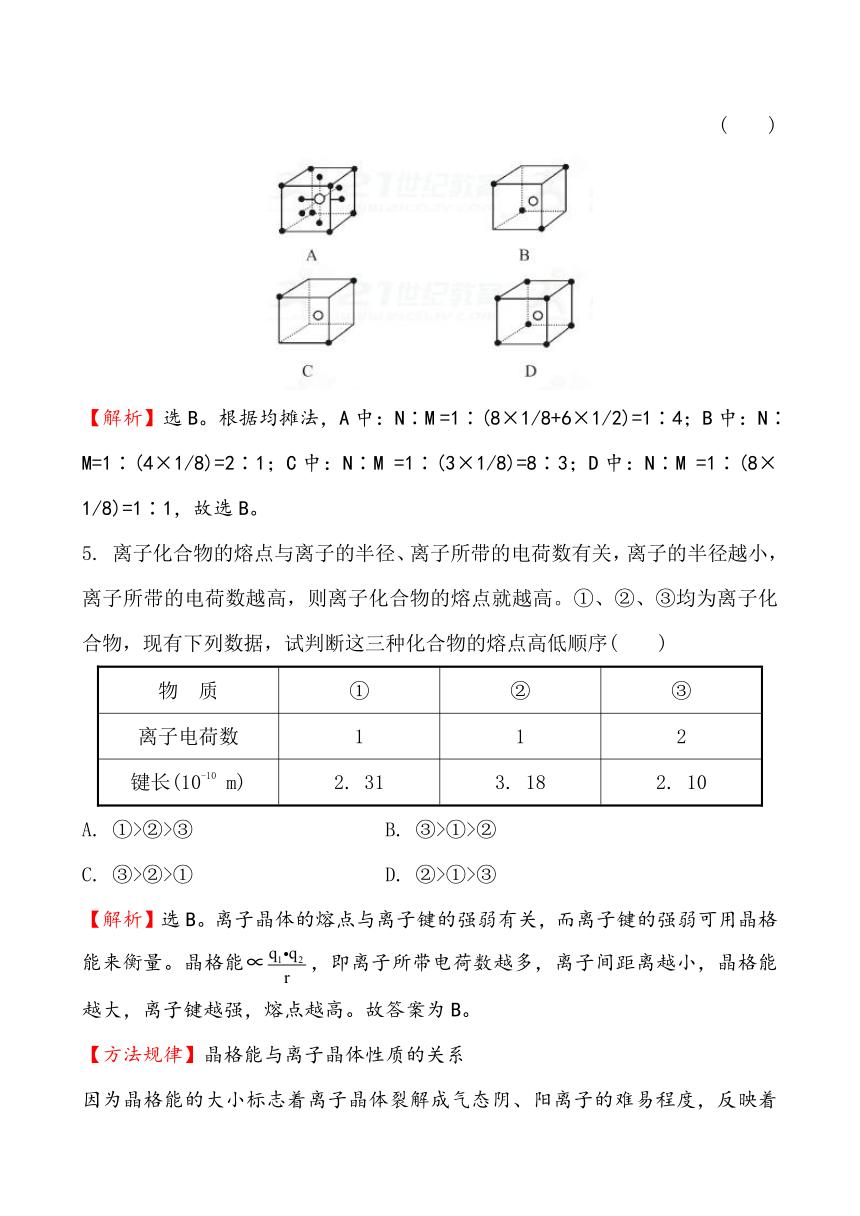
【加固训练】有下列离子晶体空间结构示意图:为阳离子,为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为
( )
【解析】选B。根据均摊法,A中:N∶M =1∶(8×1/8+6×1/2)=1∶4;B中:N∶M=1∶(4×1/8)=2∶1;C中:N∶M =1∶(3×1/8)=8∶3;D中:N∶M =1∶(8×1/8)=1∶1,故选B。
5. 离子化合物的熔点与离子的半径、离子所带的电荷数有关,离子的半径越小,离子所带的电荷数越高,则离子化合物的熔点就越高。①、②、③均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序( )
物 质
①
②
③
离子电荷数
1
1
2
键长(10-10 m)
2. 31
3. 18
2. 10
A. ①>②>③ B. ③>①>②
C. ③>②>① D. ②>①>③
【解析】选B。离子晶体的熔点与离子键的强弱有关,而离子键的强弱可用晶格能来衡量。晶格能∝,即离子所带电荷数越多,离子间距离越小,晶格能越大,离子键越强,熔点越高。故答案为B。
【方法规律】晶格能与离子晶体性质的关系
因为晶格能的大小标志着离子晶体裂解成气态阴、阳离子的难易程度,反映着离子晶体中离子键的强度,故它与离子晶体的性质有着密切联系。
对于相同类型的离子晶体:晶格能越大,离子键越强,熔、沸点越高。
6. 根据晶体的晶胞,可求晶体中微粒个数比,现有四种晶体,晶胞如下图所示,对应微粒个数比不正确的是( )
A. A∶B=1∶8 B. C∶D=2∶1
C. E∶F=1∶1 D. X∶Y∶Z=1∶3∶1
【解析】选A。A项中,A:1×1=1,B:8×=1;
B项中,C:1×1=1,D:4×=;
C项中,E:4×=,F:4×=;
D项中,X:1×1=1,Y:6×=3,Z:8×=1。
【加固训练】已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式中正确的是( )
A. ZXY3 B. ZX2Y6
C. ZX4Y8 D. ZX8Y12
【解析】选A。处于立方体顶点的微粒同时为8个晶胞所共有,处于立方体棱上的微粒同时为4个晶胞所共有,处于立方体面上的微粒同时为2个晶胞所共有,处于立方体内部的微粒,完全属于该晶胞。故晶胞中X的原子数为8×=1,
Y原子数为12×=3,Z原子数为1,该化合物的化学式为ZXY3。
二、非选择题
7. 请回答下列问题:
(1)31Ga基态原子的核外电子排布式是 。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是 ,其晶体结构类型可能为 。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为:
以下关于维生素B1的说法正确的是 。
A. 只含σ键和π键
B. 既有共价键又有离子键
C. 该物质的熔点可能高于NaCl
D. 该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间作用力有 ?
A. 离子键、共价键
B. 离子键、氢键、共价键
C. 氢键、范德华力
D. 离子键、氢键、范德华力
【解析】(1)Ga与Al同主族,位于第4周期ⅢA族,从而可得其电子排布式为1s22s22p63s23p63d104s24p1。由于Ga和As组成的物质是半导体材料,不是离子化合物,Ga最外层有3个电子,As最外层有5个电子,两者以共价键形成GaAs,属于原子晶体。
(2)双键含1个σ键和1个π键,其中还有Cl-与N+的离子键,A错误、B正确;与氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,晶格能小,熔点低,C错误;维生素B1中的—NH2是碱性基团,能与盐酸反应,D正确。
(3)维生素B1中含有离子键,水中含有氢键和分子间作用力,维生素B1溶于水时需要克服维生素B1中的离子键、水中的氢键和范德华力。
答案:(1)1s22s22p63s23p63d104s24p1 GaAs 原子晶体
(2)B、D (3)D
8. (能力挑战题)用X射线研究某金属晶体,测得在边长为360 pm的立方晶胞中含有4个金属原子,此时金属的密度为9. 0 g·cm-3。试回答:
(1)此金属晶体属于哪一种堆积方式?
(2)每个晶胞的质量是多少克?
(3)求此金属的相对原子质量。
(4)求此原子的原子半径(pm)。
【解析】(1)根据题意,此金属晶胞属于面心立方晶胞类型。(如图所示,一个晶胞所含有的金属原子个数=8×+6×=4。)
(2)根据晶胞的边长为360 pm,可得晶胞的体积为(3. 6×10-8)3cm3。根据质量=密度×体积,可得晶胞的质量=9. 0 g·cm-3×(3. 6×10-8)3cm3=4. 2×10-22 g。
(3)金属的相对原子质量=NA×原子的质量=4. 2×10-22×6. 02×1023÷4=63. 21。
(4)在面心立方晶胞中,晶胞的边长=,因此,原子的原子半径=×
360 pm=127. 28 pm。
答案:(1)面心立方最密堆积 (2)4. 2×10-22g
(3)63. 21 (4)127. 28 pm
【加固训练】晶体具有规则的几何外形,晶体中最基本的重复单元称晶胞。氯化钠晶体晶胞结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7. 4 g·cm-3,晶胞边长为4. 0×
10-10 m[NA用6. 02×1023计算Ar(Ni)=58. 69]。试回答(要求计算过程):
(1)NixO晶体中的x值= (精确到0. 01)。
(2)晶体中的Ni分别为Ni2+、Ni3+,此晶体化学式为 (用含Ni2+、Ni3+表示)。
【解析】(1)NixO晶体晶胞结构为氯化钠型,则一个晶胞中有Ni:8×1/8+6×1/2=4,O:1+12×1/4=4个,即晶体晶胞为4个“NixO分子”所占的体积。晶体晶胞的边长为4. 0×10-10 m=4. 0×10-8 cm,其体积V=64×10-24 cm3,故每个“NixO分子”所占的体积为16×10-24 cm3;由密度公式ρ===
7. 4 g·cm-3,得出x≈0. 94;
(2)设Ni2+为a,Ni3+为b,可得方程式a+b=0. 94和2a+3b=1×2,解得a=0. 82,b=0. 12,所以晶体化学式为。
答案:(1)0. 94 (2)
一、选择题
1. 在金属晶体中,自由电子与金属离子的碰撞中有能量传递,可以用此来解释的金属的物理性质是( )
A. 延展性 B. 导电性 C. 导热性 D. 还原性
【解析】选C。金属具有延展性主要是因为金属在受到外力作用时,原子之间可以发生相对滑动,各层金属原子之间仍然保持金属键的作用。金属具有导电性主要是因为金属晶体内部存在自由电子,在外电场的作用下,自由电子在金属内部发生定向运动。金属的还原性是金属的化学性质,与能量传递无关。金属的导热性主要是由于金属晶体内部,自由电子与金属离子的碰撞中有能量传递。因此选C。
【加固训练】金属晶体具有延展性的原因是( )
A. 金属键很微弱
B. 金属键没有饱和性
C. 密堆积层的阳离子容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键
D. 金属阳离子之间存在斥力
【解析】选C。金属晶体具有延展性是由于密堆积层的阳离子受到外力作用时容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键。
2. (双选)有关晶格能的叙述中正确的是( )
A. 晶格能是气态原子形成1 mol离子晶体释放的能量
B. 晶格能通常取正值,但是有时也取负值
C. 晶格能越大,形成的离子晶体越稳定
D. 晶格能越大,物质的硬度越大
【解析】选C、D。晶格能是将1 mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量,晶格能取正值,且晶格能越大,晶体越稳定,熔、沸点越高,硬度越大。
3. 下列说法中正确的是( )
A. 固态时能导电的晶体一定是金属晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
【解析】选D。离子晶体是由阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电;熔融状态时,离子化合物电离,能够导电。而石墨晶体固态时也能导电。
4. 元素X的某价态离子Xn+与N3-所形成晶体的结构单元如图所示,则Xn+中n的值为( )
A. 1 B. 2 C. 3 D. 4
【解析】选A。晶胞中小黑点为12×1/4=3,空心圆圈为8×1/8=1,根据化学式中化合价代数和为0,则n=1。
【加固训练】有下列离子晶体空间结构示意图:为阳离子,为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为
( )
【解析】选B。根据均摊法,A中:N∶M =1∶(8×1/8+6×1/2)=1∶4;B中:N∶M=1∶(4×1/8)=2∶1;C中:N∶M =1∶(3×1/8)=8∶3;D中:N∶M =1∶(8×1/8)=1∶1,故选B。
5. 离子化合物的熔点与离子的半径、离子所带的电荷数有关,离子的半径越小,离子所带的电荷数越高,则离子化合物的熔点就越高。①、②、③均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序( )
物 质
①
②
③
离子电荷数
1
1
2
键长(10-10 m)
2. 31
3. 18
2. 10
A. ①>②>③ B. ③>①>②
C. ③>②>① D. ②>①>③
【解析】选B。离子晶体的熔点与离子键的强弱有关,而离子键的强弱可用晶格能来衡量。晶格能∝,即离子所带电荷数越多,离子间距离越小,晶格能越大,离子键越强,熔点越高。故答案为B。
【方法规律】晶格能与离子晶体性质的关系
因为晶格能的大小标志着离子晶体裂解成气态阴、阳离子的难易程度,反映着离子晶体中离子键的强度,故它与离子晶体的性质有着密切联系。
对于相同类型的离子晶体:晶格能越大,离子键越强,熔、沸点越高。
6. 根据晶体的晶胞,可求晶体中微粒个数比,现有四种晶体,晶胞如下图所示,对应微粒个数比不正确的是( )
A. A∶B=1∶8 B. C∶D=2∶1
C. E∶F=1∶1 D. X∶Y∶Z=1∶3∶1
【解析】选A。A项中,A:1×1=1,B:8×=1;
B项中,C:1×1=1,D:4×=;
C项中,E:4×=,F:4×=;
D项中,X:1×1=1,Y:6×=3,Z:8×=1。
【加固训练】已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式中正确的是( )
A. ZXY3 B. ZX2Y6
C. ZX4Y8 D. ZX8Y12
【解析】选A。处于立方体顶点的微粒同时为8个晶胞所共有,处于立方体棱上的微粒同时为4个晶胞所共有,处于立方体面上的微粒同时为2个晶胞所共有,处于立方体内部的微粒,完全属于该晶胞。故晶胞中X的原子数为8×=1,
Y原子数为12×=3,Z原子数为1,该化合物的化学式为ZXY3。
二、非选择题
7. 请回答下列问题:
(1)31Ga基态原子的核外电子排布式是 。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是 ,其晶体结构类型可能为 。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为:
以下关于维生素B1的说法正确的是 。
A. 只含σ键和π键
B. 既有共价键又有离子键
C. 该物质的熔点可能高于NaCl
D. 该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间作用力有 ?
A. 离子键、共价键
B. 离子键、氢键、共价键
C. 氢键、范德华力
D. 离子键、氢键、范德华力
【解析】(1)Ga与Al同主族,位于第4周期ⅢA族,从而可得其电子排布式为1s22s22p63s23p63d104s24p1。由于Ga和As组成的物质是半导体材料,不是离子化合物,Ga最外层有3个电子,As最外层有5个电子,两者以共价键形成GaAs,属于原子晶体。
(2)双键含1个σ键和1个π键,其中还有Cl-与N+的离子键,A错误、B正确;与氯化钠晶体相比,维生素B1中的阳离子比Na+半径大,晶格能小,熔点低,C错误;维生素B1中的—NH2是碱性基团,能与盐酸反应,D正确。
(3)维生素B1中含有离子键,水中含有氢键和分子间作用力,维生素B1溶于水时需要克服维生素B1中的离子键、水中的氢键和范德华力。
答案:(1)1s22s22p63s23p63d104s24p1 GaAs 原子晶体
(2)B、D (3)D
8. (能力挑战题)用X射线研究某金属晶体,测得在边长为360 pm的立方晶胞中含有4个金属原子,此时金属的密度为9. 0 g·cm-3。试回答:
(1)此金属晶体属于哪一种堆积方式?
(2)每个晶胞的质量是多少克?
(3)求此金属的相对原子质量。
(4)求此原子的原子半径(pm)。
【解析】(1)根据题意,此金属晶胞属于面心立方晶胞类型。(如图所示,一个晶胞所含有的金属原子个数=8×+6×=4。)
(2)根据晶胞的边长为360 pm,可得晶胞的体积为(3. 6×10-8)3cm3。根据质量=密度×体积,可得晶胞的质量=9. 0 g·cm-3×(3. 6×10-8)3cm3=4. 2×10-22 g。
(3)金属的相对原子质量=NA×原子的质量=4. 2×10-22×6. 02×1023÷4=63. 21。
(4)在面心立方晶胞中,晶胞的边长=,因此,原子的原子半径=×
360 pm=127. 28 pm。
答案:(1)面心立方最密堆积 (2)4. 2×10-22g
(3)63. 21 (4)127. 28 pm
【加固训练】晶体具有规则的几何外形,晶体中最基本的重复单元称晶胞。氯化钠晶体晶胞结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7. 4 g·cm-3,晶胞边长为4. 0×
10-10 m[NA用6. 02×1023计算Ar(Ni)=58. 69]。试回答(要求计算过程):
(1)NixO晶体中的x值= (精确到0. 01)。
(2)晶体中的Ni分别为Ni2+、Ni3+,此晶体化学式为 (用含Ni2+、Ni3+表示)。
【解析】(1)NixO晶体晶胞结构为氯化钠型,则一个晶胞中有Ni:8×1/8+6×1/2=4,O:1+12×1/4=4个,即晶体晶胞为4个“NixO分子”所占的体积。晶体晶胞的边长为4. 0×10-10 m=4. 0×10-8 cm,其体积V=64×10-24 cm3,故每个“NixO分子”所占的体积为16×10-24 cm3;由密度公式ρ===
7. 4 g·cm-3,得出x≈0. 94;
(2)设Ni2+为a,Ni3+为b,可得方程式a+b=0. 94和2a+3b=1×2,解得a=0. 82,b=0. 12,所以晶体化学式为。
答案:(1)0. 94 (2)
