溶液的导电性[上学期]
图片预览









文档简介
课件37张PPT。物质纯净物混合物单质化合物氧化物其他金属非金属稀有气体提问:指出下列物质是单质还是化合物,并写出化学式:
硝酸钾 氢氧化钠 水银
去离子水 铝 氦气
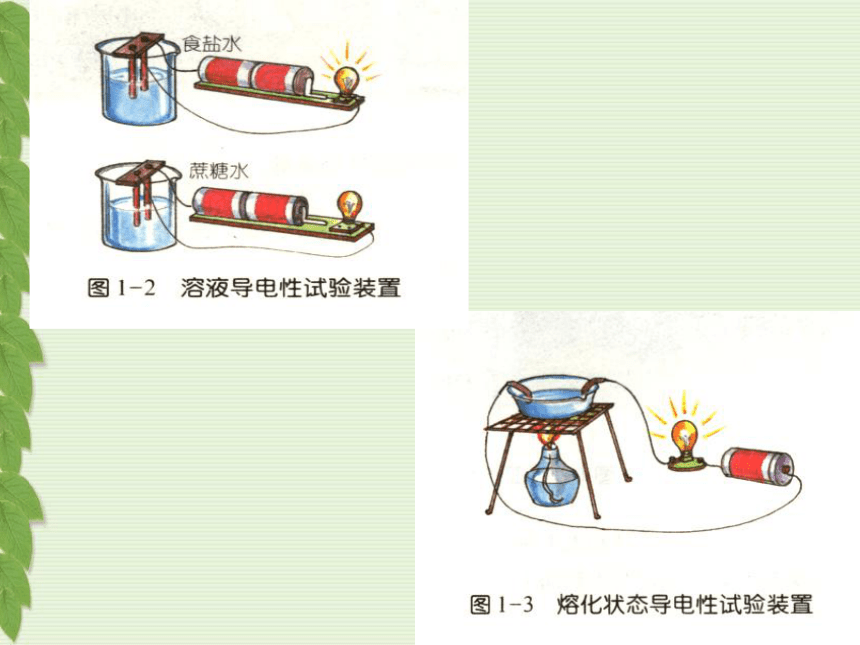
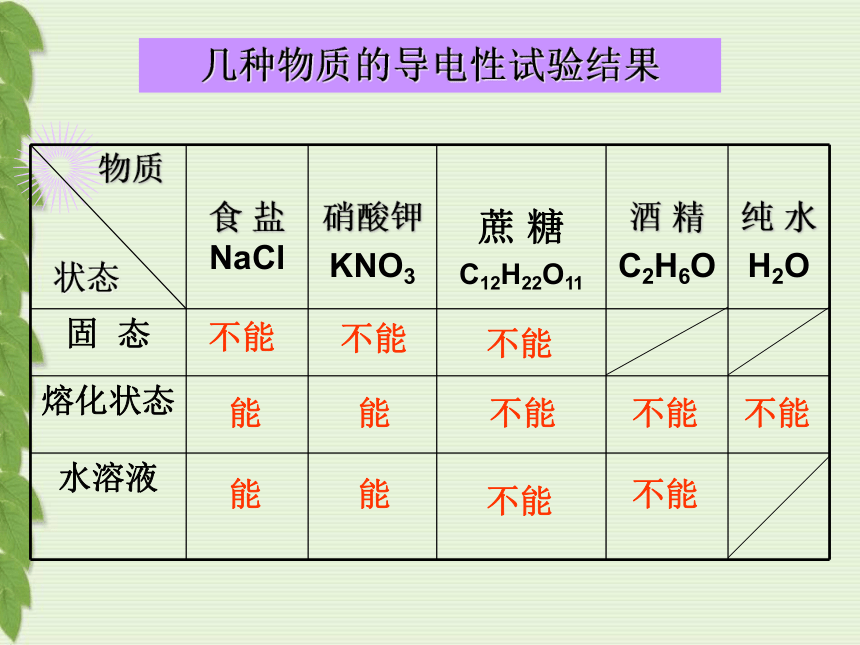
硫酸 氯化钠 石墨 化合物的分类CO2 SO2 P2O5 Fe3O4 MgO H2O…氧化物 NaCl CaCO3 KNO3 …………………盐 HCl H2SO4 ……………………………………酸NaOH Ca(OH)2 …………………………………碱第一章 酸 碱 盐第一节 溶 液 的 导 电 性一.电解质和非电解质实验1:1.氯化钠晶体的导电性2.蒸馏水的导电性3.氯化钠溶于水中的导电性通过本实验你能提出什么问题?实验2:1.蔗糖固体的导电性2.蔗糖溶于水中的导电性实验3:1.酒精和酒精溶液的导电性2.硝酸钾和硝酸钾熔液的导电性不能能不能不能不能不能不能不能不能能能能状态几种物质的导电性试验结果化合物电解质非电解质在水溶液里或熔化状态下能够导电的化合物在水溶液里或熔化状态下都不能够导电的化合物实验结论:食盐、硝酸钾是电解质;蔗糖、酒精是非电解质。重要提示:酸、碱、盐是电解质条件:(1)水溶液里练习: 判断下列是否是电解质或非电解质食盐晶体 食盐水溶液 铜 蔗糖 熔化的食盐 HCl气体 酒精溶液 石墨 SO3气体 熔化的蔗糖 蔗糖水前提: 必须是化合物结果: 能否导电(2) 熔化状态(不包括与水反应)巩固练习:
1、根据电解质和非电解质两个概念,判
断下列说法是否正确:
(l) 能导电的都是电解质。
(2)不能导电的都不是电解质。
(3)食盐溶液能导电,食盐是电解质。
(4)金属铜放在水里,熔化时都能导电,
铜是电解质。 2、下列物质的水溶液不能导电的是 ( )
A、酒精 B、氯化钡
C、盐酸 D、氢氧化钠
3、下列物质能导电,并且是溶液的是( )
A、石墨 B、铜丝
C、熔化的硝酸钾 D、稀硫酸4、下列物质中
①属于电解质的是 ( )
②属于非电解质是 ( )
③既能导电,又是电解质的是 ( )
A.食盐晶体 B.氢氧化钠溶液
C.熔化的硝酸钾 D.蔗糖晶体
E.酒精水溶液 F.铜丝1、带电的原子或原子集团叫做离子。
如:Na+、Clˉ、 K+ 、NO3ˉ
①带正电荷的叫阳离子
如Na+、 K+
②带负电荷的叫阴离子
如Clˉ、NO3ˉ二、电离和离子二、电离和离子2、电解质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。①在电解质溶液里,所有的阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,整个溶液不显电性。
②阴、阳离子所带的电荷数一般可以根据它们的化合物的化合价来判断。说明:问题:
1.金属为什么能导电?
2.为什么氯化钠等固体不导电,溶于水却能导电?因为金属中存在自由电子因为固体中离子不能自由移动,而溶于水时离解成能自由移动的离子。电解质溶液导电的原因: (内因)(1)有带电的离子(2)离子能自由移动(外因)有离子,不能自由移动有离子,能自由移动有离子,不能自由移动有离子,能自由移动没有离子,只有分子,不能自由移动没有离子,只有分子,能自由移动溶液导电与金属导电的区别:自由移动的阴、阳离子的定向移动自由电子的定向移动温度升高,导电性增强温度升高,导电性减弱化学变化物理变化电离与电解的比较:电解质溶于水或受热熔化时,离解成自由离子的过程物质在电流的作用下,生成新物质的过程溶于水或受热熔化,不需要电流的作用在溶液或在熔化状态下,还必须通直流电一般无明显的外在现象有新物质生成,一般实验现象较为明显1.mNa+与nSO42-离子:(1)每个离子所带的电荷数之比(2)两种离子的个数比(3)两种离子所带的电荷总数之比 NaCl === Na+ + Cl-KNO3 === K+ + NO3-NaOH === Na+ + OH-Ca(OH)2 === Ca2+ + 2OH-1.用化学用语(化学式和离子符号)表示物质电离的式子叫电离方程式三、电离方程式2.书写电离方程式的步骤①在左边写出物质的化学式,右边写出物质电离后生成阳离子和阴离子②配平。使左、右两边相同离子的个数相等,用等号连接左、右两边符号。 书写电离方程式的注意事项: 1. 正价元素或原子团离解成阳离子,负价元素或原子团离解成阴离子,在电离过程中,原子团并不拆散。 2. 离解发生在正价元素(或原子团)与负价元素(或原子团)联接处。离子所带电荷数与元素(或原子团)在该化合物中的化 合 价 一致 , 离子所带电荷数标在离子符号右上角 , 数字在前,“+” “-”号在后。4. 配平。离子个数写在离子符号之前。问题:
硫酸氢钠的电离方程式为: NaHSO4==Na+ + H+ + SO42-[资料]在报纸上曾登载过这样的信息: 有农民在收割水稻时,随意把打稻机的电线插头扔到有水的稻田里。当他重新使用即把插头插入插座,触电身亡。请分析原因。练习
1. 下列物质不能导电的是
A. 金属铝 B. 固体食盐
C. 硫酸溶液 D. 固体石墨( B ) 2 . 下列电离方程式正确的是
A. H2SO4 === H2+ + SO42-
B. Ca(OH)2== Ca2+ + 2OH
C. Na2CO3 === 2Na+ + CO32-
D. BaCl2 ==== Ba2+ + Cl-(C)3. 电离发生在通电____(填“前”或“后”)4. 物质溶解于水时, 产生________的离子的过程, 叫 _____ 。 该过程可用______________来表示。自由移动电离电离方程式前 5. 写出下列物质在溶液里的电离方程式,
a. 硫酸: ______________________
b.氢氧化钡:______________________
c. 碳酸钾 : ______________________
d.氯化镁: ______________________
e.硝酸 : _______________________
f.氢氧化钾: _______________________ H2SO4==2H+ + SO42- Ba(OH)2==Ba2+ + 2OH-K2CO3==2K+ + CO32- MgCl2== Mg2+ + 2Cl- HNO3== H+ + NO3-KOH==K+ + OH-6、下列说法正确的是 ( )
A、KNO3晶体不导电是因为KNO3晶体中没有离子
B、KNO3溶于水后再通上电,KNO3才能电离
C、KNO3溶液中含有能自由移动的K+ 和NO3ˉ所以KNO3溶液能导电
D、KNO3溶液中含有能自由移动的电子,所以KNO3溶液可以导电C7、氯化钠晶体不能导电,这是因为氯化钠晶体 ( )
A、不存在离子
B、不存在电子
C、不是离子化合物
D、没有自由移动的离子D8、下列关于物质电离后的说法正确的是( )
A.电离出的阴阳离子个数相等
B.电离出的每个阴离子和每个阳离子电荷数相等
C、电离出的阳离子带正电荷总数等于阴离子带负电荷总数
D.离出的阴阳离子所带电荷总数不相等C*9、完成下列电离方程式
AmBn—
HnRO2n-1—*10、某溶液中只含有K+、Mg2+、SO42- 和Cl-四种离子,测得K+、Mg2+、SO42-的个数比为5:2:4。则SO42-和Cl-的个数比为多少?11、写出下列物质在溶液里的电离方程式:
氯化钡 ;
碳酸钾 ;
硝酸镁 ;
硫酸亚铁 。
12、完成下列电离方程式:
=Na++H++SO42-小 结:
第一节 溶液的导电性
一、 电解质和非电解质
1、在水溶液里或熔化状态下能够导电的化合物叫做电解质
2、在水溶液里和熔化状态下都不能导电的化合物叫做非电解质
电解质溶液导电的原因:
(1)有带电的离子 (2)离子能自由移动
二、电离和离子
1、带电的原子或原子集团叫做离子
①带正电荷的叫阳离子 ②带负电荷的叫阴离子
2、电解质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。
三、电离方程式:用化学用语(化学式和离子符号)表示物质电离的式子叫电离方程式
硝酸钾 氢氧化钠 水银
去离子水 铝 氦气
硫酸 氯化钠 石墨 化合物的分类CO2 SO2 P2O5 Fe3O4 MgO H2O…氧化物 NaCl CaCO3 KNO3 …………………盐 HCl H2SO4 ……………………………………酸NaOH Ca(OH)2 …………………………………碱第一章 酸 碱 盐第一节 溶 液 的 导 电 性一.电解质和非电解质实验1:1.氯化钠晶体的导电性2.蒸馏水的导电性3.氯化钠溶于水中的导电性通过本实验你能提出什么问题?实验2:1.蔗糖固体的导电性2.蔗糖溶于水中的导电性实验3:1.酒精和酒精溶液的导电性2.硝酸钾和硝酸钾熔液的导电性不能能不能不能不能不能不能不能不能能能能状态几种物质的导电性试验结果化合物电解质非电解质在水溶液里或熔化状态下能够导电的化合物在水溶液里或熔化状态下都不能够导电的化合物实验结论:食盐、硝酸钾是电解质;蔗糖、酒精是非电解质。重要提示:酸、碱、盐是电解质条件:(1)水溶液里练习: 判断下列是否是电解质或非电解质食盐晶体 食盐水溶液 铜 蔗糖 熔化的食盐 HCl气体 酒精溶液 石墨 SO3气体 熔化的蔗糖 蔗糖水前提: 必须是化合物结果: 能否导电(2) 熔化状态(不包括与水反应)巩固练习:
1、根据电解质和非电解质两个概念,判
断下列说法是否正确:
(l) 能导电的都是电解质。
(2)不能导电的都不是电解质。
(3)食盐溶液能导电,食盐是电解质。
(4)金属铜放在水里,熔化时都能导电,
铜是电解质。 2、下列物质的水溶液不能导电的是 ( )
A、酒精 B、氯化钡
C、盐酸 D、氢氧化钠
3、下列物质能导电,并且是溶液的是( )
A、石墨 B、铜丝
C、熔化的硝酸钾 D、稀硫酸4、下列物质中
①属于电解质的是 ( )
②属于非电解质是 ( )
③既能导电,又是电解质的是 ( )
A.食盐晶体 B.氢氧化钠溶液
C.熔化的硝酸钾 D.蔗糖晶体
E.酒精水溶液 F.铜丝1、带电的原子或原子集团叫做离子。
如:Na+、Clˉ、 K+ 、NO3ˉ
①带正电荷的叫阳离子
如Na+、 K+
②带负电荷的叫阴离子
如Clˉ、NO3ˉ二、电离和离子二、电离和离子2、电解质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。①在电解质溶液里,所有的阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,整个溶液不显电性。
②阴、阳离子所带的电荷数一般可以根据它们的化合物的化合价来判断。说明:问题:
1.金属为什么能导电?
2.为什么氯化钠等固体不导电,溶于水却能导电?因为金属中存在自由电子因为固体中离子不能自由移动,而溶于水时离解成能自由移动的离子。电解质溶液导电的原因: (内因)(1)有带电的离子(2)离子能自由移动(外因)有离子,不能自由移动有离子,能自由移动有离子,不能自由移动有离子,能自由移动没有离子,只有分子,不能自由移动没有离子,只有分子,能自由移动溶液导电与金属导电的区别:自由移动的阴、阳离子的定向移动自由电子的定向移动温度升高,导电性增强温度升高,导电性减弱化学变化物理变化电离与电解的比较:电解质溶于水或受热熔化时,离解成自由离子的过程物质在电流的作用下,生成新物质的过程溶于水或受热熔化,不需要电流的作用在溶液或在熔化状态下,还必须通直流电一般无明显的外在现象有新物质生成,一般实验现象较为明显1.mNa+与nSO42-离子:(1)每个离子所带的电荷数之比(2)两种离子的个数比(3)两种离子所带的电荷总数之比 NaCl === Na+ + Cl-KNO3 === K+ + NO3-NaOH === Na+ + OH-Ca(OH)2 === Ca2+ + 2OH-1.用化学用语(化学式和离子符号)表示物质电离的式子叫电离方程式三、电离方程式2.书写电离方程式的步骤①在左边写出物质的化学式,右边写出物质电离后生成阳离子和阴离子②配平。使左、右两边相同离子的个数相等,用等号连接左、右两边符号。 书写电离方程式的注意事项: 1. 正价元素或原子团离解成阳离子,负价元素或原子团离解成阴离子,在电离过程中,原子团并不拆散。 2. 离解发生在正价元素(或原子团)与负价元素(或原子团)联接处。离子所带电荷数与元素(或原子团)在该化合物中的化 合 价 一致 , 离子所带电荷数标在离子符号右上角 , 数字在前,“+” “-”号在后。4. 配平。离子个数写在离子符号之前。问题:
硫酸氢钠的电离方程式为: NaHSO4==Na+ + H+ + SO42-[资料]在报纸上曾登载过这样的信息: 有农民在收割水稻时,随意把打稻机的电线插头扔到有水的稻田里。当他重新使用即把插头插入插座,触电身亡。请分析原因。练习
1. 下列物质不能导电的是
A. 金属铝 B. 固体食盐
C. 硫酸溶液 D. 固体石墨( B ) 2 . 下列电离方程式正确的是
A. H2SO4 === H2+ + SO42-
B. Ca(OH)2== Ca2+ + 2OH
C. Na2CO3 === 2Na+ + CO32-
D. BaCl2 ==== Ba2+ + Cl-(C)3. 电离发生在通电____(填“前”或“后”)4. 物质溶解于水时, 产生________的离子的过程, 叫 _____ 。 该过程可用______________来表示。自由移动电离电离方程式前 5. 写出下列物质在溶液里的电离方程式,
a. 硫酸: ______________________
b.氢氧化钡:______________________
c. 碳酸钾 : ______________________
d.氯化镁: ______________________
e.硝酸 : _______________________
f.氢氧化钾: _______________________ H2SO4==2H+ + SO42- Ba(OH)2==Ba2+ + 2OH-K2CO3==2K+ + CO32- MgCl2== Mg2+ + 2Cl- HNO3== H+ + NO3-KOH==K+ + OH-6、下列说法正确的是 ( )
A、KNO3晶体不导电是因为KNO3晶体中没有离子
B、KNO3溶于水后再通上电,KNO3才能电离
C、KNO3溶液中含有能自由移动的K+ 和NO3ˉ所以KNO3溶液能导电
D、KNO3溶液中含有能自由移动的电子,所以KNO3溶液可以导电C7、氯化钠晶体不能导电,这是因为氯化钠晶体 ( )
A、不存在离子
B、不存在电子
C、不是离子化合物
D、没有自由移动的离子D8、下列关于物质电离后的说法正确的是( )
A.电离出的阴阳离子个数相等
B.电离出的每个阴离子和每个阳离子电荷数相等
C、电离出的阳离子带正电荷总数等于阴离子带负电荷总数
D.离出的阴阳离子所带电荷总数不相等C*9、完成下列电离方程式
AmBn—
HnRO2n-1—*10、某溶液中只含有K+、Mg2+、SO42- 和Cl-四种离子,测得K+、Mg2+、SO42-的个数比为5:2:4。则SO42-和Cl-的个数比为多少?11、写出下列物质在溶液里的电离方程式:
氯化钡 ;
碳酸钾 ;
硝酸镁 ;
硫酸亚铁 。
12、完成下列电离方程式:
=Na++H++SO42-小 结:
第一节 溶液的导电性
一、 电解质和非电解质
1、在水溶液里或熔化状态下能够导电的化合物叫做电解质
2、在水溶液里和熔化状态下都不能导电的化合物叫做非电解质
电解质溶液导电的原因:
(1)有带电的离子 (2)离子能自由移动
二、电离和离子
1、带电的原子或原子集团叫做离子
①带正电荷的叫阳离子 ②带负电荷的叫阴离子
2、电解质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。
三、电离方程式:用化学用语(化学式和离子符号)表示物质电离的式子叫电离方程式
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
