浙江省金华一中2017-2018学年高一上学期第二次段考化学
文档属性
| 名称 | 浙江省金华一中2017-2018学年高一上学期第二次段考化学 |
|
|
| 格式 | zip | ||
| 文件大小 | 164.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-01-11 00:00:00 | ||
图片预览


文档简介
金华一中2017—2018学年第一学期第二次段考试卷
高 一 化 学
相对原子质量:H:1, C:12,O:16, N :14,Na:23, S:32,Cl:35.5,Fe :56,
Cu:64, Ba:137。
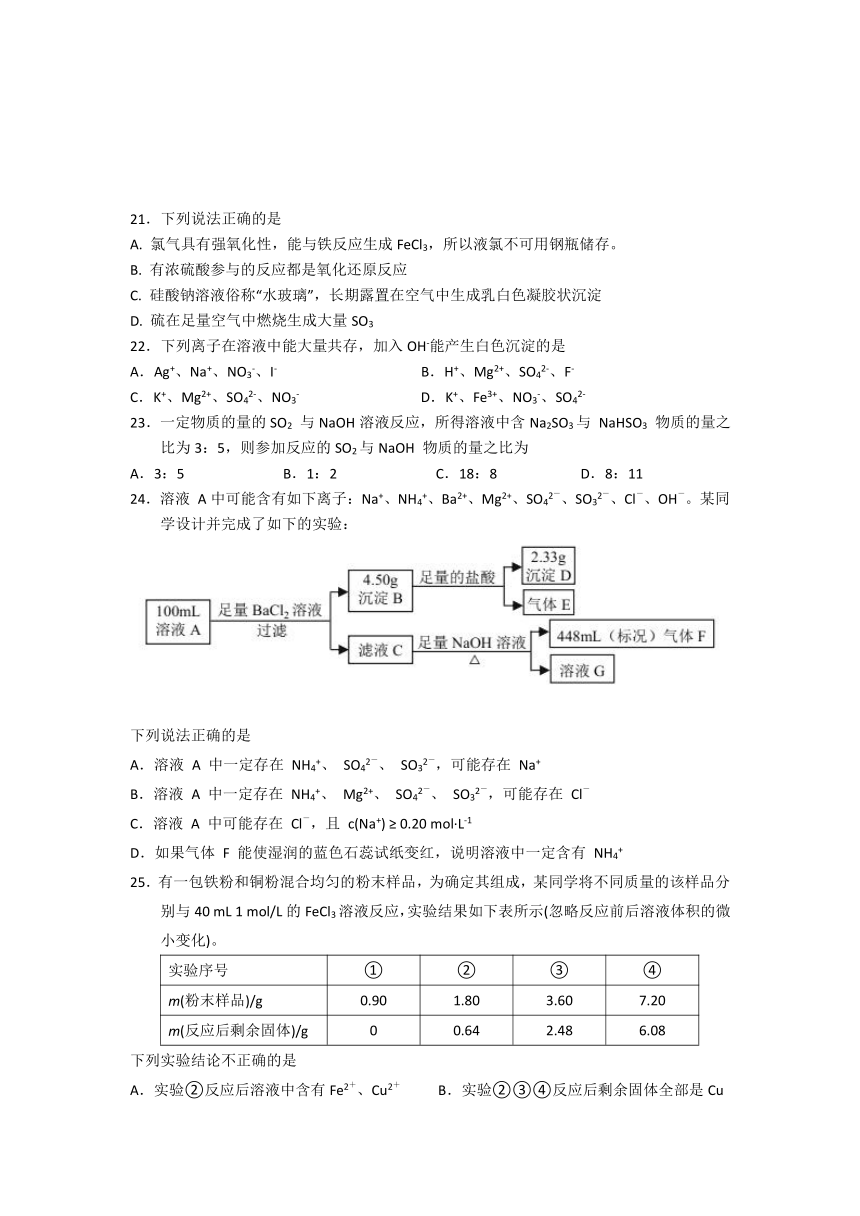
一、选择题(本大题共25小题,每小题2分,共50分。每小题只有一个选项符题意)
1.下列属于氧化物的是
A.NaCl B.MgO C.H2SO4 D.NaOH
2.下列玻璃仪器中,可以用酒精灯直接加热的是
A. B. C. D.
3.在反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O中,氧化产物是
A.C B.H2SO4 C.CO2 D.SO2
4.下列属于非电解质的是
A.铜 B.硝酸钾 C.氢氧化钠 D.蔗糖
5.下列溶液,其电离方程式不正确的是
A.NaOH = Na+ + OH( B.NH3?H2O = NH4+ + OH(
C.CH3COOH CH3COO( + H+ D.NaHSO4 = Na+ + H++SO42(
6. Fe2O3+3CO2Fe+3CO2的反应类型是
A.化合反应 B.置换反应 C.氧化还原反应 D.复分解反应
7.下列说法不正确的是
A.酸雨是指PH值小于5.6的雨、雪和霜等 B.溴被称为海洋元素
C.钠可以从四氯化钛中置换出钛 D.电解饱和食盐水可制取金属钠
8.实验室有两瓶失去标签的溶液,其中一瓶是H2SO4,另一瓶是蔗糖溶液。鉴别时,下列选用的试纸或试剂不正确的是
A.pH试纸 B.KCl溶液 C.BaCl2溶液 D.Na2CO3溶液
9.下列说法中,不正确的是
A.硫酸的产量是衡量一个国家化学工业生产水平的重要标志
B.利用丁达尔效应可鉴别溶液和胶体
C.运用蒸馏的方法,可以分离沸点相差较大的液体混合物
D.催化剂中毒是指其完全失去催化作用的过程
10.欲分离某酒精和水的混合液,除铁架台、铁圈等外,还需要用到的仪器是
11. 下列物质中,不能由金属跟非金属单质直接化合而成的是
A . Fe3O4 B .Cu2S C. FeS D. FeCl2
12.向BaCl2溶液中通入SO2气体后,未见沉淀,继续通入下列物质仍未出现明显变化的是
A.NH3 B.Cl2 C.CO2 D.H2S
13.下列离子方程式书写正确的是
A.碳酸钠溶液中滴入过量的醋酸溶液:CO32-+2H+=H2O+CO2
B.Fe3+的检验:Fe3++3SCN-Fe(SCN)3↓
C.酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+=3I2+3H2O
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3+H2O
14.下列说法不正确的是
A.用pH试纸检验某干燥气体的酸碱性时,一定要先用蒸馏水湿润
B.烧瓶、烧杯、锥形瓶在酒精灯上加热时,都需要要垫石棉网,以防仪器炸裂
C.焰色反应时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检物是钾盐
D.35Cl与37Cl互为同位素
15.下列说法不正确的是
A.硫酸工业的接触室内,有一个热交换器
B.在玻璃、水泥和高炉炼铁工业生产中,都需要用到石灰石
C.利用光线在硅晶体内的全反射现象,可以制备光导纤维
D.氢氧化铁胶体有较强吸附性,可用于水的净化
16.下列最终能使湿润的紫色石蕊试纸变红的试剂是
A.NH3 B.SO2 C.Cl2 D.18.4mol/L的H2SO4
17.下列说法不正确的是
A.实验室应将钠保存在煤油或石蜡油中 B.分液漏斗和容量瓶在使用前都要检漏
C.不能用酒精代替CCl4萃取碘水中的碘单质 D.常温下铁遇浓硫酸不发生化学反应
18.下列说法正确的是
A. 氯水、双氧水、二氧化硫、活性炭都有漂白作用,漂白原理相同。
B. 氢氧化钠的熔化可以用石英坩埚
C. SO2可用于抑制酒类物质中细菌的生长,可在葡萄酒中微量添加。
D. 浓硫酸具有吸水性,因而能使蔗糖炭化
19.下列工业生产中的主要反应,涉及置换反应的是
A. 制取粗硅 B. 海水提镁 C. 硫酸工业 D. 氯碱工业
20.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取二氧化碳、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
21.下列说法正确的是
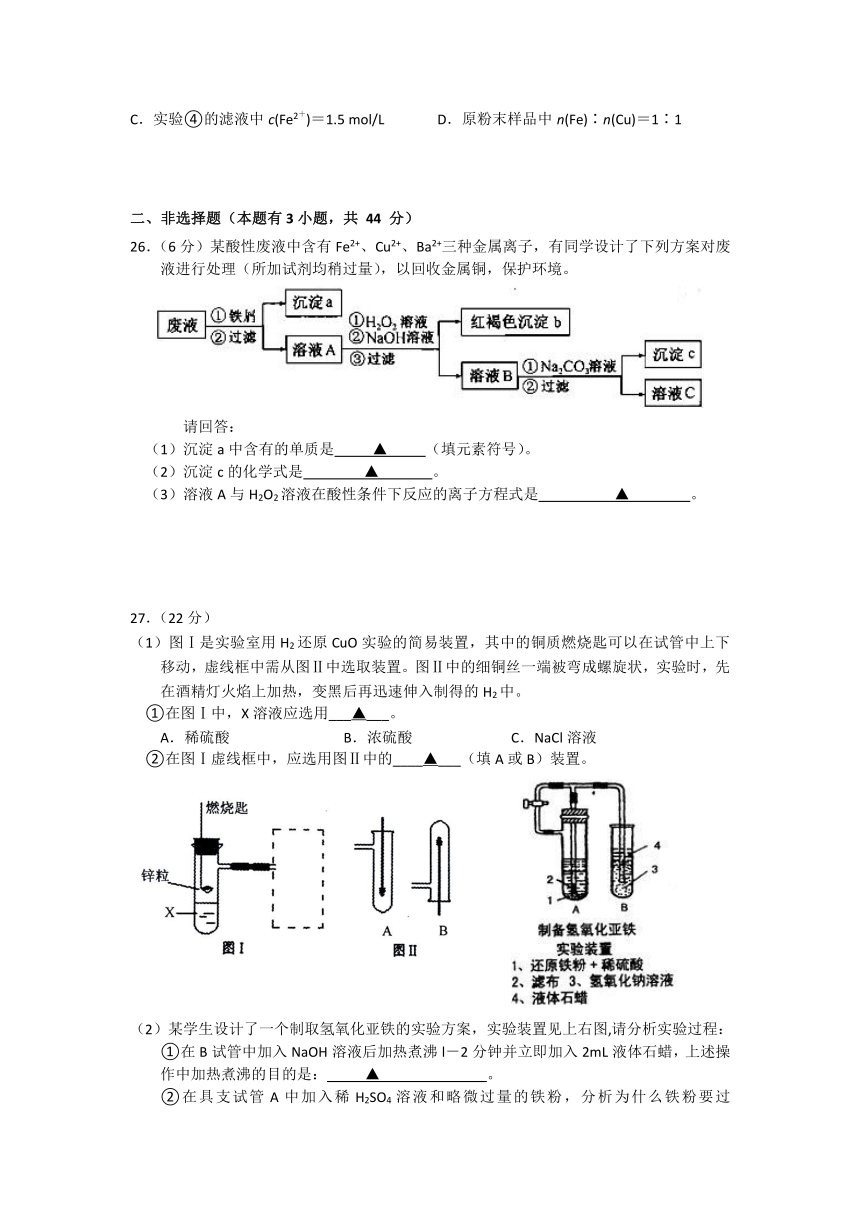
A. 氯气具有强氧化性,能与铁反应生成FeCl3,所以液氯不可用钢瓶储存。
B. 有浓硫酸参与的反应都是氧化还原反应
C. 硅酸钠溶液俗称“水玻璃”,长期露置在空气中生成乳白色凝胶状沉淀
D. 硫在足量空气中燃烧生成大量SO3
22.下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是
A.Ag+、Na+、NO3-、I- B.H+、Mg2+、SO42-、F-
C.K+、Mg2+、SO42-、NO3- D.K+、Fe3+、NO3-、SO42-
23.一定物质的量的SO2 与NaOH溶液反应,所得溶液中含Na2SO3与 NaHSO3 物质的量之比为3:5,则参加反应的SO2与NaOH 物质的量之比为
A.3:5 B.1:2 C.18:8 D.8:11
24.溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
下列说法正确的是 A.溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B.溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C.溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D.如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
25.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
实验序号
①
②
③
④
m(粉末样品)/g
0.90
1.80
3.60
7.20
m(反应后剩余固体)/g
0
0.64
2.48
6.08
下列实验结论不正确的是
A.实验②反应后溶液中含有Fe2+、Cu2+ B.实验②③④反应后剩余固体全部是Cu
C.实验④的滤液中c(Fe2+)=1.5 mol/L D.原粉末样品中n(Fe)∶n(Cu)=1∶1
二、非选择题(本题有3小题,共 44 分)
26.(6分)某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。
请回答:
(1)沉淀a中含有的单质是 ▲ (填元素符号)。
(2)沉淀c的化学式是 ▲ 。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 ▲ 。
27.(22分)
(1)图Ⅰ是实验室用H2还原CuO实验的简易装置,其中的铜质燃烧匙可以在试管中上下移动,虚线框中需从图Ⅱ中选取装置。图Ⅱ中的细铜丝一端被弯成螺旋状,实验时,先在酒精灯火焰上加热,变黑后再迅速伸入制得的H2中。
①在图Ⅰ中,X溶液应选用___▲___。
A.稀硫酸 B.浓硫酸 C.NaCl溶液
②在图Ⅰ虚线框中,应选用图Ⅱ中的____▲___(填A或B)装置。
(2)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见上右图,请分析实验过程: ①在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作中加热煮沸的目的是:???????????▲????????? 。 ②在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉要过量???????▲??????。 ③连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中??????▲???(填现象),B试管中????▲???? (填现象)。 ④如果B中产生的氢氧化亚铁遇到空气,出现的现象是 ▲ ,发生变化的化学方程式为______▲_______。
(3)现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是___▲____。
A.dcabh B.feabh C.feabg
②本实验除去SO2的原理是利用SO2的___▲_____性质(填序号)。
A.氧化性 B.漂白性 C.还原性 D.酸性
③SO2与酸性高锰酸钾反应的离子方程式是 ▲ 。
28.(16分)
(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:
现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式 ▲ ,X溶液应选用 ▲ 。
②尾气处理过程中,多余的氯气可用 ▲ 吸收,写出该过程的离子方程式 ▲ 。
(2)FeSO4?7H2O受热分解的化学方程式为:
2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO4?7H2O俗名叫 ▲ 矾,将其受热产
生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是
____▲____;为测定BaSO4沉淀的质量,后续的操作步骤依次为____▲____、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)
▲ 。
三、计算题(本题共 6分)
29.将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比(写出计算过程,只有答案不给分)。
金华一中2017—2018学年第一学期第二次段考试卷
高一化学答题卷
一、选择题(本大题共25小题,每小题2分,共50分。)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
二、非选择题(本题有3小题,共 44 分)
26.(6分)(1) ;(2) _;
(3) 。
27.(22分)(1)① 。② 。
(2)① 。
② 。
③ ;
。
④ ;
。
(3)① ;② ;
③ 。
28.(16分)(1)① ; 。
② ; 。
(2)① ; ; 。
②
。
三、计算题(本题共 6分)
29.(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比。
第二次段考化学参考答案
一、选择题(本大题共25小题,每小题2分,共50分。)
1
2
3
4
5
6
7
8
9
10
11
12
13
B
B
C
D
B
C
D
B
D
D
D
C
C
14
15
16
17
18
19
20
21
22
23
24
25
C
C
B
D
C
A
C
C
C
D
C
B
二、非选择题(本题有3小题,共 44 分)
26
(1)Cu、Fe ( 2分)
(2)BaCO3( 2分)
(3)2Fe2++H2O2+2H+=2Fe3++ 2H2O( 2分)
27
(1)①A ( 2分) ②B( 2分)
(2)①为了驱除溶在NaOH溶液中的氧气( 2分)
②保证溶液中不存在Fe3+( 2分)
③溶液经导管压入B试管中( 2分),产生白色沉淀( 2分)。
④白色、灰绿色、红褐色( 2分)
4Fe(OH)2+O2+2H2O==4Fe(OH)3??( 2分)
(3)①B ( 2分) ②C( 2分)
③5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+( 2分)
28
(1)① MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O (无加热符号,不给分) ( 2分) A ( 2分)
② B ( 2分) Cl2+2OH-=Cl-+ClO-+H2O ( 2分)
(2)① 绿( 2分) 品红溶液褪色( 2分) 过滤( 2分)
② 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4 ( 2分)
三、计算题(本题共 6分)
29.(1)0. 4 (3分) (2)2︰1 (3分)
高 一 化 学
相对原子质量:H:1, C:12,O:16, N :14,Na:23, S:32,Cl:35.5,Fe :56,
Cu:64, Ba:137。
一、选择题(本大题共25小题,每小题2分,共50分。每小题只有一个选项符题意)
1.下列属于氧化物的是
A.NaCl B.MgO C.H2SO4 D.NaOH
2.下列玻璃仪器中,可以用酒精灯直接加热的是
A. B. C. D.
3.在反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O中,氧化产物是
A.C B.H2SO4 C.CO2 D.SO2
4.下列属于非电解质的是
A.铜 B.硝酸钾 C.氢氧化钠 D.蔗糖
5.下列溶液,其电离方程式不正确的是
A.NaOH = Na+ + OH( B.NH3?H2O = NH4+ + OH(
C.CH3COOH CH3COO( + H+ D.NaHSO4 = Na+ + H++SO42(
6. Fe2O3+3CO2Fe+3CO2的反应类型是
A.化合反应 B.置换反应 C.氧化还原反应 D.复分解反应
7.下列说法不正确的是
A.酸雨是指PH值小于5.6的雨、雪和霜等 B.溴被称为海洋元素
C.钠可以从四氯化钛中置换出钛 D.电解饱和食盐水可制取金属钠
8.实验室有两瓶失去标签的溶液,其中一瓶是H2SO4,另一瓶是蔗糖溶液。鉴别时,下列选用的试纸或试剂不正确的是
A.pH试纸 B.KCl溶液 C.BaCl2溶液 D.Na2CO3溶液
9.下列说法中,不正确的是
A.硫酸的产量是衡量一个国家化学工业生产水平的重要标志
B.利用丁达尔效应可鉴别溶液和胶体
C.运用蒸馏的方法,可以分离沸点相差较大的液体混合物
D.催化剂中毒是指其完全失去催化作用的过程
10.欲分离某酒精和水的混合液,除铁架台、铁圈等外,还需要用到的仪器是
11. 下列物质中,不能由金属跟非金属单质直接化合而成的是
A . Fe3O4 B .Cu2S C. FeS D. FeCl2
12.向BaCl2溶液中通入SO2气体后,未见沉淀,继续通入下列物质仍未出现明显变化的是
A.NH3 B.Cl2 C.CO2 D.H2S
13.下列离子方程式书写正确的是
A.碳酸钠溶液中滴入过量的醋酸溶液:CO32-+2H+=H2O+CO2
B.Fe3+的检验:Fe3++3SCN-Fe(SCN)3↓
C.酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+=3I2+3H2O
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3+H2O
14.下列说法不正确的是
A.用pH试纸检验某干燥气体的酸碱性时,一定要先用蒸馏水湿润
B.烧瓶、烧杯、锥形瓶在酒精灯上加热时,都需要要垫石棉网,以防仪器炸裂
C.焰色反应时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检物是钾盐
D.35Cl与37Cl互为同位素
15.下列说法不正确的是
A.硫酸工业的接触室内,有一个热交换器
B.在玻璃、水泥和高炉炼铁工业生产中,都需要用到石灰石
C.利用光线在硅晶体内的全反射现象,可以制备光导纤维
D.氢氧化铁胶体有较强吸附性,可用于水的净化
16.下列最终能使湿润的紫色石蕊试纸变红的试剂是
A.NH3 B.SO2 C.Cl2 D.18.4mol/L的H2SO4
17.下列说法不正确的是
A.实验室应将钠保存在煤油或石蜡油中 B.分液漏斗和容量瓶在使用前都要检漏
C.不能用酒精代替CCl4萃取碘水中的碘单质 D.常温下铁遇浓硫酸不发生化学反应
18.下列说法正确的是
A. 氯水、双氧水、二氧化硫、活性炭都有漂白作用,漂白原理相同。
B. 氢氧化钠的熔化可以用石英坩埚
C. SO2可用于抑制酒类物质中细菌的生长,可在葡萄酒中微量添加。
D. 浓硫酸具有吸水性,因而能使蔗糖炭化
19.下列工业生产中的主要反应,涉及置换反应的是
A. 制取粗硅 B. 海水提镁 C. 硫酸工业 D. 氯碱工业
20.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取二氧化碳、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
21.下列说法正确的是
A. 氯气具有强氧化性,能与铁反应生成FeCl3,所以液氯不可用钢瓶储存。
B. 有浓硫酸参与的反应都是氧化还原反应
C. 硅酸钠溶液俗称“水玻璃”,长期露置在空气中生成乳白色凝胶状沉淀
D. 硫在足量空气中燃烧生成大量SO3
22.下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是
A.Ag+、Na+、NO3-、I- B.H+、Mg2+、SO42-、F-
C.K+、Mg2+、SO42-、NO3- D.K+、Fe3+、NO3-、SO42-
23.一定物质的量的SO2 与NaOH溶液反应,所得溶液中含Na2SO3与 NaHSO3 物质的量之比为3:5,则参加反应的SO2与NaOH 物质的量之比为
A.3:5 B.1:2 C.18:8 D.8:11
24.溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
下列说法正确的是 A.溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B.溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C.溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D.如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
25.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40 mL 1 mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化)。
实验序号
①
②
③
④
m(粉末样品)/g
0.90
1.80
3.60
7.20
m(反应后剩余固体)/g
0
0.64
2.48
6.08
下列实验结论不正确的是
A.实验②反应后溶液中含有Fe2+、Cu2+ B.实验②③④反应后剩余固体全部是Cu
C.实验④的滤液中c(Fe2+)=1.5 mol/L D.原粉末样品中n(Fe)∶n(Cu)=1∶1
二、非选择题(本题有3小题,共 44 分)
26.(6分)某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。
请回答:
(1)沉淀a中含有的单质是 ▲ (填元素符号)。
(2)沉淀c的化学式是 ▲ 。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 ▲ 。
27.(22分)
(1)图Ⅰ是实验室用H2还原CuO实验的简易装置,其中的铜质燃烧匙可以在试管中上下移动,虚线框中需从图Ⅱ中选取装置。图Ⅱ中的细铜丝一端被弯成螺旋状,实验时,先在酒精灯火焰上加热,变黑后再迅速伸入制得的H2中。
①在图Ⅰ中,X溶液应选用___▲___。
A.稀硫酸 B.浓硫酸 C.NaCl溶液
②在图Ⅰ虚线框中,应选用图Ⅱ中的____▲___(填A或B)装置。
(2)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见上右图,请分析实验过程: ①在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作中加热煮沸的目的是:???????????▲????????? 。 ②在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉要过量???????▲??????。 ③连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中??????▲???(填现象),B试管中????▲???? (填现象)。 ④如果B中产生的氢氧化亚铁遇到空气,出现的现象是 ▲ ,发生变化的化学方程式为______▲_______。
(3)现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是___▲____。
A.dcabh B.feabh C.feabg
②本实验除去SO2的原理是利用SO2的___▲_____性质(填序号)。
A.氧化性 B.漂白性 C.还原性 D.酸性
③SO2与酸性高锰酸钾反应的离子方程式是 ▲ 。
28.(16分)
(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:
现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式 ▲ ,X溶液应选用 ▲ 。
②尾气处理过程中,多余的氯气可用 ▲ 吸收,写出该过程的离子方程式 ▲ 。
(2)FeSO4?7H2O受热分解的化学方程式为:
2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO4?7H2O俗名叫 ▲ 矾,将其受热产
生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是
____▲____;为测定BaSO4沉淀的质量,后续的操作步骤依次为____▲____、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)
▲ 。
三、计算题(本题共 6分)
29.将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比(写出计算过程,只有答案不给分)。
金华一中2017—2018学年第一学期第二次段考试卷
高一化学答题卷
一、选择题(本大题共25小题,每小题2分,共50分。)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
二、非选择题(本题有3小题,共 44 分)
26.(6分)(1) ;(2) _;
(3) 。
27.(22分)(1)① 。② 。
(2)① 。
② 。
③ ;
。
④ ;
。
(3)① ;② ;
③ 。
28.(16分)(1)① ; 。
② ; 。
(2)① ; ; 。
②
。
三、计算题(本题共 6分)
29.(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比。
第二次段考化学参考答案
一、选择题(本大题共25小题,每小题2分,共50分。)
1
2
3
4
5
6
7
8
9
10
11
12
13
B
B
C
D
B
C
D
B
D
D
D
C
C
14
15
16
17
18
19
20
21
22
23
24
25
C
C
B
D
C
A
C
C
C
D
C
B
二、非选择题(本题有3小题,共 44 分)
26
(1)Cu、Fe ( 2分)
(2)BaCO3( 2分)
(3)2Fe2++H2O2+2H+=2Fe3++ 2H2O( 2分)
27
(1)①A ( 2分) ②B( 2分)
(2)①为了驱除溶在NaOH溶液中的氧气( 2分)
②保证溶液中不存在Fe3+( 2分)
③溶液经导管压入B试管中( 2分),产生白色沉淀( 2分)。
④白色、灰绿色、红褐色( 2分)
4Fe(OH)2+O2+2H2O==4Fe(OH)3??( 2分)
(3)①B ( 2分) ②C( 2分)
③5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+( 2分)
28
(1)① MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O (无加热符号,不给分) ( 2分) A ( 2分)
② B ( 2分) Cl2+2OH-=Cl-+ClO-+H2O ( 2分)
(2)① 绿( 2分) 品红溶液褪色( 2分) 过滤( 2分)
② 取适量固体,加足量的稀盐酸溶解,分成两份,一份中滴加KSCN溶液,若是血红色,则有Fe3+,说明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,则有SO42- ,说明含有未分解的FeSO4 ( 2分)
三、计算题(本题共 6分)
29.(1)0. 4 (3分) (2)2︰1 (3分)
同课章节目录
