课题3溶液的浓度(共33张PPT)
图片预览










文档简介
课件33张PPT。第九单元 溶 液
课题3 溶液的浓度实验 9-7
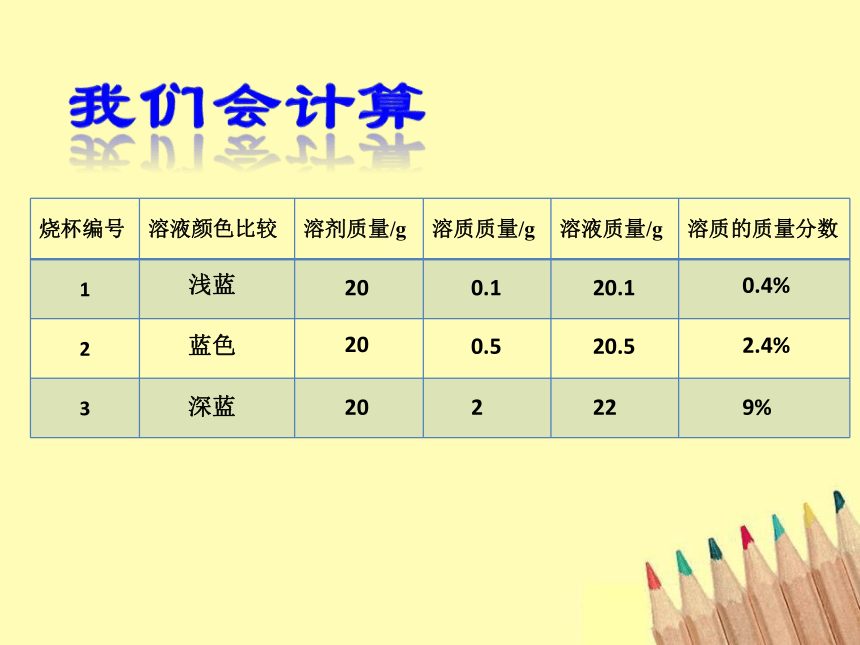
在室温下,向三个小烧杯中各加入20 mL水,然后分别加入0.1 g、0.5 g、2 g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。在这三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?浅蓝蓝色深蓝2020200.10.5220.120.522一、溶质的质量分数
1.定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。
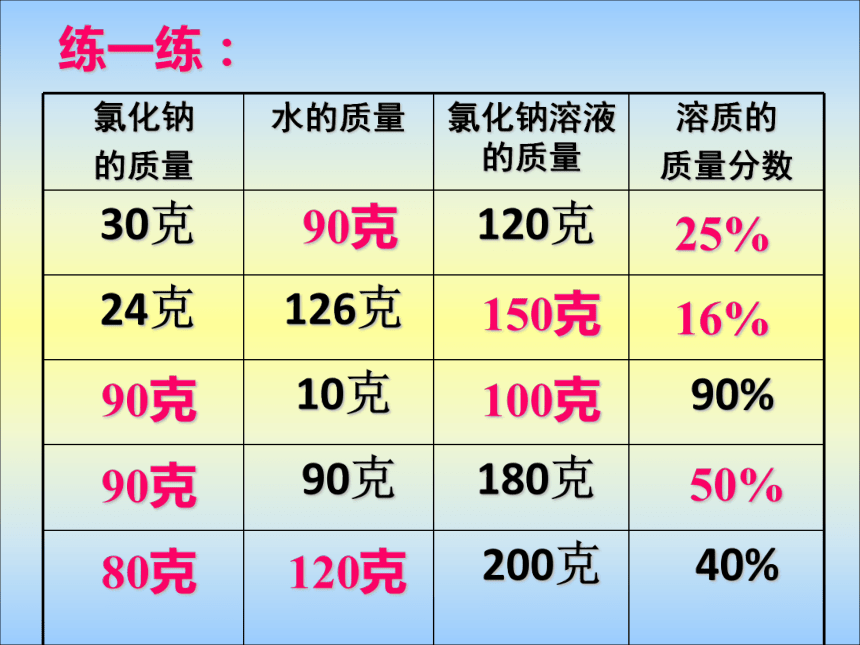
2.计算公式:浅蓝蓝色深蓝2020200.10.5220.120.5220.4%2.4%9%练一练:90克25%150克16%90克100克90克50%80克120克实验9-8
在室温下,很据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1 g/cm3)。全部溶解全部溶解10%20%讨论已知20℃时,氯化钠的溶解度为36g。有人说:“20℃时,氯化钠饱和溶液中溶质的质量分数为36%.”这种说法对吗? 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较[题型一] :有关溶质、溶剂和溶液之间的换算 二、有关溶质质量分数的计算溶质质量溶液质量?100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :例题1
在农业生产上,常需要用质量分数为16%的氯化钠溶液选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?解:
溶质的质量分数= ×100%溶质质量=溶液质量×溶质的质量分数
=150 kg×16%
=24 kg溶剂质量=溶液质量—溶质质量
=150 kg—24 kg
=126 kg答:配制150 kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。溶质质量
溶液质量[题型二]:要考虑溶解度的溶质质量分数的计算计算的依据 :对于某温度下的饱和(或过饱和)溶液?100% 溶质质量分数=对于某温度下的不饱和溶液溶质质量溶液质量?100% 溶质质量分数=(未溶解的固体不能当成溶质来计算) 溶解度100g+溶解度 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为:=26.5%36g100g+36g答:略练一练某温度下,物质A的溶解度为60g,则该温度下的80g饱和溶液中溶质的质量分数是( )
A. 60% B. 80% C.30% D. 37.5%
练一练:变小变小变小不变不变变大变大变小不变变小变小变大变大不变变大变小不变变小变大变小 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 关键是找出溶质和溶液的质量1、对“ 10% ”的食盐溶液“的含义理解错误的是 ( AD )
A、100g水中溶解了10g食盐
B、100g食盐溶液中溶解有10g食盐
C、将10g食盐溶解在90g水中所得到的溶液
D、将食盐与水按1:10的质量比配成溶液课堂练习 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量加水稀释:
稀释前后溶质的质量不变
稀释后溶液的总质量=原溶液的质量+水的质量
公式: m浓 ? a%(浓) =m稀? b%(稀)
m浓 ? a%(浓) =(m浓+m水)? b%(稀)
用稀溶液稀释:
混合后溶液中溶质的总质量=浓溶液中溶质的质量+稀溶液中溶质的质量
计算式:
m浓 ? a%(浓)+m稀?b%(稀)=(m浓+m稀)? c%(稀)1、溶液稀释例3 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解题关键是把握稀释前后溶质的质量不变。设稀释后溶液的质量为x。50 g× 98% = x × 20% x=245 g
需要水的质量=245 g-50 g=195 g 答:需要水的质量为195 g。解:稀释前溶液中溶质质量稀释后溶液中溶质质量 解:设需要加水的质量为X
50 g× 98% = ( 50g+ x )× 20%X=195g答:需要水的质量为195g例4:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:略注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题5:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为: 100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 解析:求 所得溶液中溶质的质量分数。这种题目应该用“整体法”来求。先求出溶质的质量,然后溶液的质量用整体法,假想所有物质都在一个容器中反应,你把放进去的东西质量全加起来,然后减去生成的气体,和沉淀( 固体)(可能是不反应的杂质),最后剩下的就是溶液的质量。 例题6:已知19.5 g锌恰好能跟150 g稀硫酸完全反应。求:
(1)生成氢气的质量;
(2)反应前稀硫酸中溶质的质量分数;
(3)反应后所得溶液中溶质的质量分数。 解(1) 设生成氢气的质量为x;反应前稀硫酸中溶质的质量为y;生成硫酸锌的质量为z。
Zn + H2SO4 = ZnSO4 + H2 ↑
65 98 161 2
19.5 g y z x
(2)反应前稀硫酸的质量分数为:(3) 反应后所得溶液中溶质的质量分数 :
答:略提示:反应后硫酸锌溶液的质量为:
19.5 g+150 g-0.6 g=168.9 g
(或150 g-29.4 g+48.3 g=168.9 g)1、3.25克锌刚好跟100g盐酸完全反应,求:
(1)生成氢气的质量
(2) 盐酸溶质的质量分数。
(3)反应后所得溶液的溶质质量分数练一练? [题型5] :有关溶液浓缩的计算计算的依据 : 浓缩前溶质质量 = 浓缩后溶质质量2、溶液的浓缩 增大溶液浓度的方法即增大溶质质量分数的方法有增加溶质、蒸发溶剂、与同种溶质的浓溶液混合
(1)增加溶质
溶液中溶质的质量=原溶液中溶质的质量+增加的溶质质量
计算式:m稀 × a% +m质=(m稀+m质)×b %
(2)蒸发溶剂
蒸发溶剂前后,溶质质量不变
计算式:m稀 × a% =(m稀-m水)×b %
(3)与同种溶质的浓溶液混合:
溶质的总质量=浓溶液中溶质的质量+稀溶液中溶质的质量
m稀×a %+m浓×b %=(m稀+m浓) ×c %
练一练:有50g质量分数为5%的硝酸钾溶液,若将其溶质质量分数提高到10%,可采用的方法是:( )
A、蒸发掉25g水
B、蒸发掉23.75g水
C、加入2g硝酸钾晶体
D、加入50g溶质质量分数为5%的硝酸钾溶液 A通过这节课的学习,你对溶液又多了哪些了解?谈谈你的感受。
课题3 溶液的浓度实验 9-7
在室温下,向三个小烧杯中各加入20 mL水,然后分别加入0.1 g、0.5 g、2 g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。在这三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?浅蓝蓝色深蓝2020200.10.5220.120.522一、溶质的质量分数
1.定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2.计算公式:浅蓝蓝色深蓝2020200.10.5220.120.5220.4%2.4%9%练一练:90克25%150克16%90克100克90克50%80克120克实验9-8
在室温下,很据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1 g/cm3)。全部溶解全部溶解10%20%讨论已知20℃时,氯化钠的溶解度为36g。有人说:“20℃时,氯化钠饱和溶液中溶质的质量分数为36%.”这种说法对吗? 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较[题型一] :有关溶质、溶剂和溶液之间的换算 二、有关溶质质量分数的计算溶质质量溶液质量?100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :例题1
在农业生产上,常需要用质量分数为16%的氯化钠溶液选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?解:
溶质的质量分数= ×100%溶质质量=溶液质量×溶质的质量分数
=150 kg×16%
=24 kg溶剂质量=溶液质量—溶质质量
=150 kg—24 kg
=126 kg答:配制150 kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。溶质质量
溶液质量[题型二]:要考虑溶解度的溶质质量分数的计算计算的依据 :对于某温度下的饱和(或过饱和)溶液?100% 溶质质量分数=对于某温度下的不饱和溶液溶质质量溶液质量?100% 溶质质量分数=(未溶解的固体不能当成溶质来计算) 溶解度100g+溶解度 例2、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为:=26.5%36g100g+36g答:略练一练某温度下,物质A的溶解度为60g,则该温度下的80g饱和溶液中溶质的质量分数是( )
A. 60% B. 80% C.30% D. 37.5%
练一练:变小变小变小不变不变变大变大变小不变变小变小变大变大不变变大变小不变变小变大变小 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 关键是找出溶质和溶液的质量1、对“ 10% ”的食盐溶液“的含义理解错误的是 ( AD )
A、100g水中溶解了10g食盐
B、100g食盐溶液中溶解有10g食盐
C、将10g食盐溶解在90g水中所得到的溶液
D、将食盐与水按1:10的质量比配成溶液课堂练习 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量加水稀释:
稀释前后溶质的质量不变
稀释后溶液的总质量=原溶液的质量+水的质量
公式: m浓 ? a%(浓) =m稀? b%(稀)
m浓 ? a%(浓) =(m浓+m水)? b%(稀)
用稀溶液稀释:
混合后溶液中溶质的总质量=浓溶液中溶质的质量+稀溶液中溶质的质量
计算式:
m浓 ? a%(浓)+m稀?b%(稀)=(m浓+m稀)? c%(稀)1、溶液稀释例3 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解题关键是把握稀释前后溶质的质量不变。设稀释后溶液的质量为x。50 g× 98% = x × 20% x=245 g
需要水的质量=245 g-50 g=195 g 答:需要水的质量为195 g。解:稀释前溶液中溶质质量稀释后溶液中溶质质量 解:设需要加水的质量为X
50 g× 98% = ( 50g+ x )× 20%X=195g答:需要水的质量为195g例4:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:略注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题5:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为: 100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 解析:求 所得溶液中溶质的质量分数。这种题目应该用“整体法”来求。先求出溶质的质量,然后溶液的质量用整体法,假想所有物质都在一个容器中反应,你把放进去的东西质量全加起来,然后减去生成的气体,和沉淀( 固体)(可能是不反应的杂质),最后剩下的就是溶液的质量。 例题6:已知19.5 g锌恰好能跟150 g稀硫酸完全反应。求:
(1)生成氢气的质量;
(2)反应前稀硫酸中溶质的质量分数;
(3)反应后所得溶液中溶质的质量分数。 解(1) 设生成氢气的质量为x;反应前稀硫酸中溶质的质量为y;生成硫酸锌的质量为z。
Zn + H2SO4 = ZnSO4 + H2 ↑
65 98 161 2
19.5 g y z x
(2)反应前稀硫酸的质量分数为:(3) 反应后所得溶液中溶质的质量分数 :
答:略提示:反应后硫酸锌溶液的质量为:
19.5 g+150 g-0.6 g=168.9 g
(或150 g-29.4 g+48.3 g=168.9 g)1、3.25克锌刚好跟100g盐酸完全反应,求:
(1)生成氢气的质量
(2) 盐酸溶质的质量分数。
(3)反应后所得溶液的溶质质量分数练一练? [题型5] :有关溶液浓缩的计算计算的依据 : 浓缩前溶质质量 = 浓缩后溶质质量2、溶液的浓缩 增大溶液浓度的方法即增大溶质质量分数的方法有增加溶质、蒸发溶剂、与同种溶质的浓溶液混合
(1)增加溶质
溶液中溶质的质量=原溶液中溶质的质量+增加的溶质质量
计算式:m稀 × a% +m质=(m稀+m质)×b %
(2)蒸发溶剂
蒸发溶剂前后,溶质质量不变
计算式:m稀 × a% =(m稀-m水)×b %
(3)与同种溶质的浓溶液混合:
溶质的总质量=浓溶液中溶质的质量+稀溶液中溶质的质量
m稀×a %+m浓×b %=(m稀+m浓) ×c %
练一练:有50g质量分数为5%的硝酸钾溶液,若将其溶质质量分数提高到10%,可采用的方法是:( )
A、蒸发掉25g水
B、蒸发掉23.75g水
C、加入2g硝酸钾晶体
D、加入50g溶质质量分数为5%的硝酸钾溶液 A通过这节课的学习,你对溶液又多了哪些了解?谈谈你的感受。
同课章节目录
