物质的转化规律(第6、7课时)[上学期]
文档属性
| 名称 | 物质的转化规律(第6、7课时)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 222.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2006-11-06 00:00:00 | ||
图片预览








文档简介
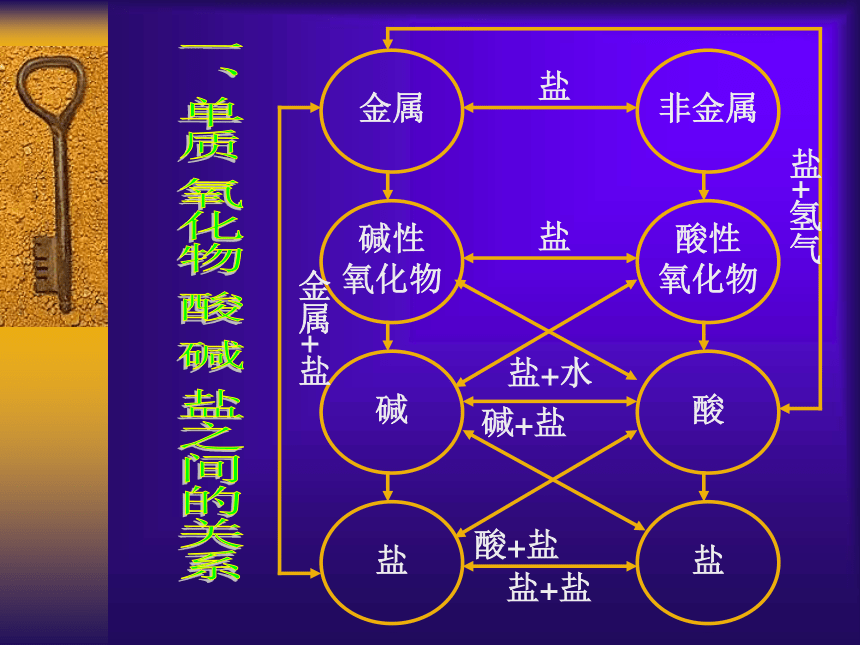
课件25张PPT。单质、氧化物、酸碱盐的关系第二章 第二节 物质的转化规律第六、七课时一、单质 氧化物 酸 碱 盐之间的关系1、金属氧化物+酸→盐+水 3、酸 + 盐 = 酸 + 盐
2、非金属氧化物+碱→盐+水 4、碱 + 盐 = 碱 + 盐
1、金属+非金属→无氧酸盐
2、金属氧化物+非金属氧化物→含氧酸盐
3、酸+碱→盐+水
4、盐+盐→新盐+新盐
1、金属→金属氧化物→碱→盐
2、非金属→非金属氧化物→酸→盐
一、两条纵线
二、四条横
三、四条交叉斜
四、两条弯线
1、金属+盐→新金属+新盐
2、金属+酸→盐+氢气
二、相互转化的关系 :三、相互反应的关系:1、金属 + 非金属 = 无氧酸盐 2、碱性氧化物 +酸性氧化物 = 含氧酸盐 3、酸 + 碱 = 盐+水 4、盐 + 盐 = 盐 + 盐5、酸性氧化物 + 碱 = 盐 + 水 6、碱性氧化物 + 酸 = 盐 + 水7、酸 + 盐 = 酸 + 盐 8、碱 + 盐 = 碱 + 盐 9、金属 + 酸 = 盐 + 氢气10、金属 + 盐 = 金属 + 盐(注意各类反应发生的条件)三、生成盐的可能方法(一)、由金属生成盐的三种方法1、金属 + 非金属 == 盐(无氧酸盐)Fe + S == FeS 2Na + Cl2== 2NaCl 2、金属 + 酸 == 盐 + 氢气 Fe + 2HCl == FeCl2 + H2 ↑
Zn + H2SO4 (稀)== ZnSO4 + H2 ↑反应条件:在金属活动性顺序表中,金属必须排在氢的前面。3、金属+ 盐 ==盐 + 金属Fe + CuSO4 == FeSO4 + Cu
Cu + 2AgNO3== Cu(NO3)+ 2Ag反应条件:1、在金属活动性顺序表中金属单质位于盐中金属的前面 2、参加反应的盐可溶。问题3、判断下列置换反应能否发生,能发生反应的写出化学方程式,不能反应的说明理由: 4、金属氧化物 + 非金属氧化物 == 含氧酸盐 5、金属氧化物 + 酸 == 盐 + 水CuO + H2SO4 == CuSO4 + H2O
Fe2O3 +6 HCl ==2 FeCl3 +3 H2O 6、非金属氧化物 + 碱 == 盐 + 水(二)、由氧化物生成盐的三种方法1、Cu+HCl = 2、Fe + CuSO4= 3、Zn+MgSO4= 1、不反应 原因是在金属活动性顺序中,Cu排在了H的后面。2、反应:Fe + CuSO4== FeSO4 +Cu 3、不反应 原因:在金属活动性顺序中Zn排在Mg的后面反应条件:非金属氧化物与碱反应的条件:参加反应的碱可溶(三):酸生成盐的两种方法7、酸 +碱 == 盐 + 水问题4、判断下列反应能否发生,能反应的写出化学方程式:
A:SO2 + Fe(OH)3== B:CO2 + NaOH== A:不能反应,原因是Fe(OH)3不溶于水
B:CO2+2NaOH == Na2CO3 + H2O9、碱 + 盐 == 新盐 + 新碱(四):碱生成盐的方法8、酸 + 盐 == 新盐 + 新酸反应条件:参加反应的盐溶于酸,生成物满足复分解反应的条件。反应条件:反应物都可溶,生成物至少一种不溶(五)、盐生成盐的方法10、盐 + 盐 == 新盐 + 新盐NaCl + AgNO3 == AgCl ↓ + NaNO3
CuSO4 + BaCl2 == BaSO4 ↓ + CuCl2反应条件: 反应物都可溶,生成物至少一种不溶问题5、判断下列化学反应能否发生,能发生的写出反应的化学方程式,不能反应的说明理由:
A:BaCl2 +H2SO4— B:FeCl3 +NaOH—
C:CaCO3 + KCl— D:BaCl2 + AgNO3 — C:不反应,原因:CaCO3 不溶于水。
小结: 根据物质的相互转化规律,生成盐共有十种法:
1、金属 + 非金属 == 盐(无氧酸盐)
2、金属 + 酸 == 盐 + 氢气
3、金属+ 盐 ==盐 + 金属
4、金属氧化物 + 非金属氧化物 == 含氧酸盐
5、金属氧化物 + 酸 == 盐 + 水
6、非金属氧化物 + 碱 == 盐 + 水
7、酸 +碱 == 盐 + 水
8、酸 + 盐 == 新盐 + 新酸
9、碱 + 盐 == 新盐 + 新碱
10、盐 + 盐 == 新盐 + 新盐例题1:试设计制备ZnSO4的可能方法,并写出相关的
化学方程式。2、Zn + CuSO4 == ZnSO4 + Cu3、ZnO + SO3 == ZnSO44、ZnO + H2SO4 == ZnSO4 + H2O5、Zn(OH)2 + H2SO4 == ZnSO4 + 2H2O例题2、举出制备AlCl3可能方法,并写出相关的
化学方程式1、Zn + H2SO4 (稀)== ZnSO4 + H2 ↑6、ZnCO3 + H2SO4 == ZnSO4 + H2O + CO2 ↑ 7、ZnCl2 + Ag2SO4 == ZnSO4 + 2 AgCl↓1、2Al + 3Cl2 == 2AlCl3
2、2Al +3 CuCl2==2 AlCl3 +3 Cu3、2Al + 6HCl ==2AlCl3+3 H2↑4、Al2O3 + 6HCl == 2 AlCl3 + 3H2O
5、Al(OH)3 + 3HCl == AlCl3 + 3H2O
6、6HCl + Al2(CO3)3 == 2AlCl3 + 3H2O +3 CO2 ↑
7、3BaCl2 + Al2(SO4)3 == 3BaSO4 ↓ + 2AlCl31、判断下列反应能否发生?写出能发生反应的化学方程式,不能反应的说明理由。
(1)Mg+H2SO4 (2)Fe+HCl
(3)Ag+H2SO4(稀) (4)Zn+HNO3
(5)Zn+CuSO4 (6)Ag+ZnSO4
(7)Cu+AgCl (8)Cu+Hg(NO3)2(9)BaCl2+H2SO4 (10)Na2CO3+HCl
(11)NaCl+Cu(OH)2 (12)FeCl3+NaOH
(13)K2SO4+NaNO3 (14)CaCO3+NaCl
(15)NaCl+AgNO3 (16)Ca(OH)2+HNO3
跟踪练习一四、物质的制取方法:1、金属的制取:2、酸性氧化物的制取:3、碱性氧化物的制取:4、酸的制取:5、碱的制取:6、盐的制取:金属+盐=金属+盐
还原剂+金属氧化物=金属 +氧化物 非金属+氧气=酸性氧化物
酸=酸性氧化物+水
难溶性盐=碱性氧化物+酸性氧化物(共有10种方法,见前页)五、沉淀的颜色 白色白色白色不溶溶溶溶溶红褐色蓝色六、固体的颜色 白色红色黑色蓝绿色蓝色紫黑色七、溶液的颜色 蓝黄绿紫无色八、离子的鉴别 紫色石蕊(或碳酸盐)紫色石蕊或酚酞(或可溶性铁盐、铜盐)AgNO3溶液和稀HNO3含Ba2+的溶液和稀HNO3酸或含Ca2+ 、Ba2+的溶液跟踪练习二:1、完成下列物质的转化:酸碱盐盐21Cu CuO CuCl2
Cu(OH)2 Cu(NO3)2 3 HCO3 CaCO3
C CO2 Ca(HCO3)2
CO Na2CO33、试写出CaO、CO2、NaOH、H2SO4、BaCl2、CuSO4相互反应的化学方程式。
4、请学生写出右边物质间相互反应的化学方程式(共7个) 5、从Zn、BaCl2、Fe(OH)3、NaOH、KClO3、CuCl2、Na2SO4、CaO、H2O、H2SO4等物质中,选出适当的物质,按下列要求写化学方程式;①化合反应:______
②分解反应:______
③置换反应:______
④复分解反应:
a.______(酸与盐反应)
b.______(碱与盐反应)
c.______(盐与盐反应)
6、写出用五种方法制备硫酸锌的化学方程式。(练习1 )制取ZnSO4的可能方法有几种?并从中选出五种最佳制法,写出相应的化学方程式。
(练习2)写出制取MgCl2的可能方法的化学方程式。
(练习3)分别写出制取下列各物质的化学方程式:(1)以铁、氧化铜、稀硫酸三种物质为原料,用两种方法制取铜,(2)由氧化铁制备氢氧化铁。
物质的制取练习:小结一、相互转化的关系二、相互反应的关系三、物质的制取八圈图
2、非金属氧化物+碱→盐+水 4、碱 + 盐 = 碱 + 盐
1、金属+非金属→无氧酸盐
2、金属氧化物+非金属氧化物→含氧酸盐
3、酸+碱→盐+水
4、盐+盐→新盐+新盐
1、金属→金属氧化物→碱→盐
2、非金属→非金属氧化物→酸→盐
一、两条纵线
二、四条横
三、四条交叉斜
四、两条弯线
1、金属+盐→新金属+新盐
2、金属+酸→盐+氢气
二、相互转化的关系 :三、相互反应的关系:1、金属 + 非金属 = 无氧酸盐 2、碱性氧化物 +酸性氧化物 = 含氧酸盐 3、酸 + 碱 = 盐+水 4、盐 + 盐 = 盐 + 盐5、酸性氧化物 + 碱 = 盐 + 水 6、碱性氧化物 + 酸 = 盐 + 水7、酸 + 盐 = 酸 + 盐 8、碱 + 盐 = 碱 + 盐 9、金属 + 酸 = 盐 + 氢气10、金属 + 盐 = 金属 + 盐(注意各类反应发生的条件)三、生成盐的可能方法(一)、由金属生成盐的三种方法1、金属 + 非金属 == 盐(无氧酸盐)Fe + S == FeS 2Na + Cl2== 2NaCl 2、金属 + 酸 == 盐 + 氢气 Fe + 2HCl == FeCl2 + H2 ↑
Zn + H2SO4 (稀)== ZnSO4 + H2 ↑反应条件:在金属活动性顺序表中,金属必须排在氢的前面。3、金属+ 盐 ==盐 + 金属Fe + CuSO4 == FeSO4 + Cu
Cu + 2AgNO3== Cu(NO3)+ 2Ag反应条件:1、在金属活动性顺序表中金属单质位于盐中金属的前面 2、参加反应的盐可溶。问题3、判断下列置换反应能否发生,能发生反应的写出化学方程式,不能反应的说明理由: 4、金属氧化物 + 非金属氧化物 == 含氧酸盐 5、金属氧化物 + 酸 == 盐 + 水CuO + H2SO4 == CuSO4 + H2O
Fe2O3 +6 HCl ==2 FeCl3 +3 H2O 6、非金属氧化物 + 碱 == 盐 + 水(二)、由氧化物生成盐的三种方法1、Cu+HCl = 2、Fe + CuSO4= 3、Zn+MgSO4= 1、不反应 原因是在金属活动性顺序中,Cu排在了H的后面。2、反应:Fe + CuSO4== FeSO4 +Cu 3、不反应 原因:在金属活动性顺序中Zn排在Mg的后面反应条件:非金属氧化物与碱反应的条件:参加反应的碱可溶(三):酸生成盐的两种方法7、酸 +碱 == 盐 + 水问题4、判断下列反应能否发生,能反应的写出化学方程式:
A:SO2 + Fe(OH)3== B:CO2 + NaOH== A:不能反应,原因是Fe(OH)3不溶于水
B:CO2+2NaOH == Na2CO3 + H2O9、碱 + 盐 == 新盐 + 新碱(四):碱生成盐的方法8、酸 + 盐 == 新盐 + 新酸反应条件:参加反应的盐溶于酸,生成物满足复分解反应的条件。反应条件:反应物都可溶,生成物至少一种不溶(五)、盐生成盐的方法10、盐 + 盐 == 新盐 + 新盐NaCl + AgNO3 == AgCl ↓ + NaNO3
CuSO4 + BaCl2 == BaSO4 ↓ + CuCl2反应条件: 反应物都可溶,生成物至少一种不溶问题5、判断下列化学反应能否发生,能发生的写出反应的化学方程式,不能反应的说明理由:
A:BaCl2 +H2SO4— B:FeCl3 +NaOH—
C:CaCO3 + KCl— D:BaCl2 + AgNO3 — C:不反应,原因:CaCO3 不溶于水。
小结: 根据物质的相互转化规律,生成盐共有十种法:
1、金属 + 非金属 == 盐(无氧酸盐)
2、金属 + 酸 == 盐 + 氢气
3、金属+ 盐 ==盐 + 金属
4、金属氧化物 + 非金属氧化物 == 含氧酸盐
5、金属氧化物 + 酸 == 盐 + 水
6、非金属氧化物 + 碱 == 盐 + 水
7、酸 +碱 == 盐 + 水
8、酸 + 盐 == 新盐 + 新酸
9、碱 + 盐 == 新盐 + 新碱
10、盐 + 盐 == 新盐 + 新盐例题1:试设计制备ZnSO4的可能方法,并写出相关的
化学方程式。2、Zn + CuSO4 == ZnSO4 + Cu3、ZnO + SO3 == ZnSO44、ZnO + H2SO4 == ZnSO4 + H2O5、Zn(OH)2 + H2SO4 == ZnSO4 + 2H2O例题2、举出制备AlCl3可能方法,并写出相关的
化学方程式1、Zn + H2SO4 (稀)== ZnSO4 + H2 ↑6、ZnCO3 + H2SO4 == ZnSO4 + H2O + CO2 ↑ 7、ZnCl2 + Ag2SO4 == ZnSO4 + 2 AgCl↓1、2Al + 3Cl2 == 2AlCl3
2、2Al +3 CuCl2==2 AlCl3 +3 Cu3、2Al + 6HCl ==2AlCl3+3 H2↑4、Al2O3 + 6HCl == 2 AlCl3 + 3H2O
5、Al(OH)3 + 3HCl == AlCl3 + 3H2O
6、6HCl + Al2(CO3)3 == 2AlCl3 + 3H2O +3 CO2 ↑
7、3BaCl2 + Al2(SO4)3 == 3BaSO4 ↓ + 2AlCl31、判断下列反应能否发生?写出能发生反应的化学方程式,不能反应的说明理由。
(1)Mg+H2SO4 (2)Fe+HCl
(3)Ag+H2SO4(稀) (4)Zn+HNO3
(5)Zn+CuSO4 (6)Ag+ZnSO4
(7)Cu+AgCl (8)Cu+Hg(NO3)2(9)BaCl2+H2SO4 (10)Na2CO3+HCl
(11)NaCl+Cu(OH)2 (12)FeCl3+NaOH
(13)K2SO4+NaNO3 (14)CaCO3+NaCl
(15)NaCl+AgNO3 (16)Ca(OH)2+HNO3
跟踪练习一四、物质的制取方法:1、金属的制取:2、酸性氧化物的制取:3、碱性氧化物的制取:4、酸的制取:5、碱的制取:6、盐的制取:金属+盐=金属+盐
还原剂+金属氧化物=金属 +氧化物 非金属+氧气=酸性氧化物
酸=酸性氧化物+水
难溶性盐=碱性氧化物+酸性氧化物(共有10种方法,见前页)五、沉淀的颜色 白色白色白色不溶溶溶溶溶红褐色蓝色六、固体的颜色 白色红色黑色蓝绿色蓝色紫黑色七、溶液的颜色 蓝黄绿紫无色八、离子的鉴别 紫色石蕊(或碳酸盐)紫色石蕊或酚酞(或可溶性铁盐、铜盐)AgNO3溶液和稀HNO3含Ba2+的溶液和稀HNO3酸或含Ca2+ 、Ba2+的溶液跟踪练习二:1、完成下列物质的转化:酸碱盐盐21Cu CuO CuCl2
Cu(OH)2 Cu(NO3)2 3 HCO3 CaCO3
C CO2 Ca(HCO3)2
CO Na2CO33、试写出CaO、CO2、NaOH、H2SO4、BaCl2、CuSO4相互反应的化学方程式。
4、请学生写出右边物质间相互反应的化学方程式(共7个) 5、从Zn、BaCl2、Fe(OH)3、NaOH、KClO3、CuCl2、Na2SO4、CaO、H2O、H2SO4等物质中,选出适当的物质,按下列要求写化学方程式;①化合反应:______
②分解反应:______
③置换反应:______
④复分解反应:
a.______(酸与盐反应)
b.______(碱与盐反应)
c.______(盐与盐反应)
6、写出用五种方法制备硫酸锌的化学方程式。(练习1 )制取ZnSO4的可能方法有几种?并从中选出五种最佳制法,写出相应的化学方程式。
(练习2)写出制取MgCl2的可能方法的化学方程式。
(练习3)分别写出制取下列各物质的化学方程式:(1)以铁、氧化铜、稀硫酸三种物质为原料,用两种方法制取铜,(2)由氧化铁制备氢氧化铁。
物质的制取练习:小结一、相互转化的关系二、相互反应的关系三、物质的制取八圈图
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
